Слайд 1Содержание
Исследование зависимости электропроводности от рода вещества
Слайд 2I. Введение
I. Электрический ток в растворах электролитов
Вещества, растворы которых проводят
электрический ток, называются электролитами. Электрический ток в жидких проводниках—в растворах
электролитов (растворах солей, кислот, щелочей и др.) представляет собой поток заряженных частиц вещества — ионов. Ионы возникают в растворе вследствие взаимодействия молекул растворяемого вещества с молекулами растворителя (воды).
Ионы в растворах электролитов, как и свободные электроны в металлах, движутся беспорядочно. Но когда электроды присоединяют к полюсам источника тока, в растворе возникает электрическое поле. Под воздействием поля ионы, сохраняя хаотическое движение, одновременно начинают двигаться в определенном направлении. Положительные ионы направляются к электроду, соединенному с отрицательным полюсом источника (катоду), а отрицательные ионы — к электроду, соединенному с положительным полюсом (аноду). Дойдя до соответствующих электродов, ионы отдают им свои заряды и, став атомами или молекулами, выделяются на электродах или вступают в химические реакции.
При растворении электролита в жидкости, например хлорида натрия в воде, взаимодействие молекул жидкости с молекулами электролита ослабляет связь между частями молекул электролита, и некоторые из них разделяются на положительные и отрицательные ионы. Разделение молекул электролита на ионы происходит за счет энергии теплового движения молекул. В электрическом поле ионы электролита приходят в движение: положительные ионы движутся к катоду, отрицательные — к аноду. Так возникает электрический ток в электролите.
При повышении температуры кинетическая энергия движения молекул возрастает, что приводит к увеличению числа пар образующихся ионов, то есть к увеличению концентрации электролита. Из-за увеличения концентрации ионов значение электрического сопротивления электролита с повышением температуры уменьшается.
В данной исследовательской работе проводились опыты по определению зависимости силы тока от напряжения в водных растворах в зависимости от температуры, концентрации электролита и рода вещества раствора.
Цель данной работы – выяснить, насколько используемая человеком вода является чистой, и сделать сравнительный анализ используемой воды.

Слайд 3II. Исследование электропроводности водных растворов.
Условия проведения опыта
Для проведения опытов использовались
дождевая, речная и водопроводная вода, раствор поваренной соли (NaCl).
Электрическое
поле в растворе создавалось с помощью выпрямителя В24, прибора для электролиза (вместо угольных стержней использовались медные электроды).
Силу тока измеряли школьным лабораторным миллиамперметром.
Температуру измеряли лабораторным термометром.
Слайд 41).Исследование зависимости электропроводности от рода вещества
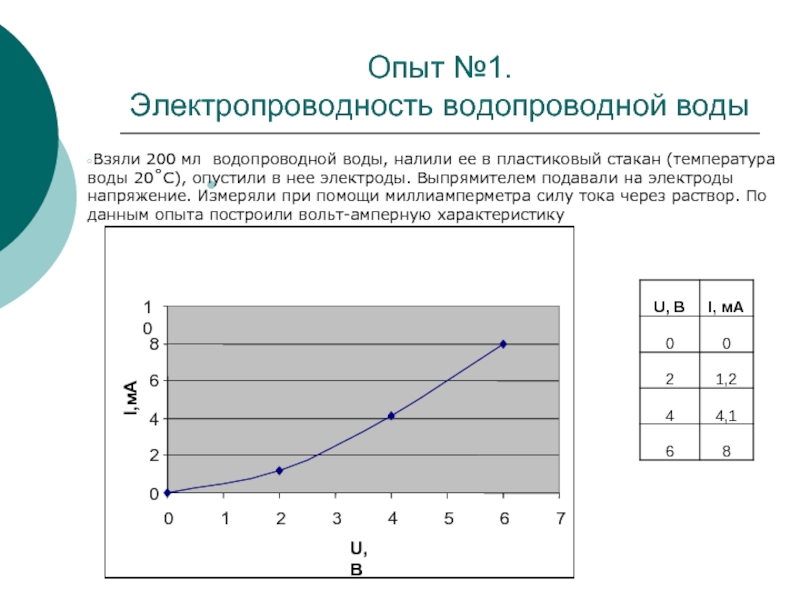
Слайд 5Опыт №1.
Электропроводность водопроводной воды
Взяли 200 мл водопроводной воды, налили ее в пластиковый стакан (температура воды 20˚С), опустили в нее электроды. Выпрямителем подавали на электроды напряжение. Измеряли при помощи миллиамперметра силу тока через раствор. По данным опыта построили вольт-амперную характеристику
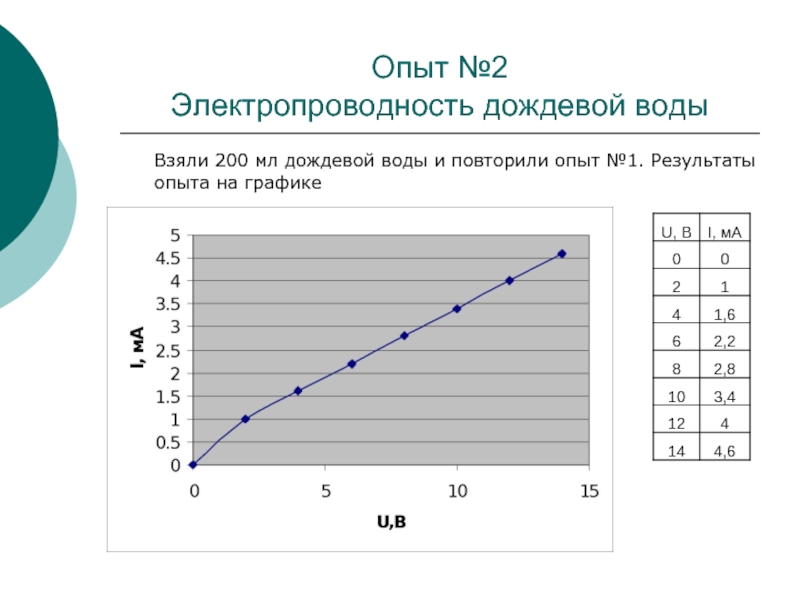
Слайд 6Опыт №2
Электропроводность дождевой воды
Взяли 200 мл дождевой воды и
повторили опыт №1. Результаты опыта на графике
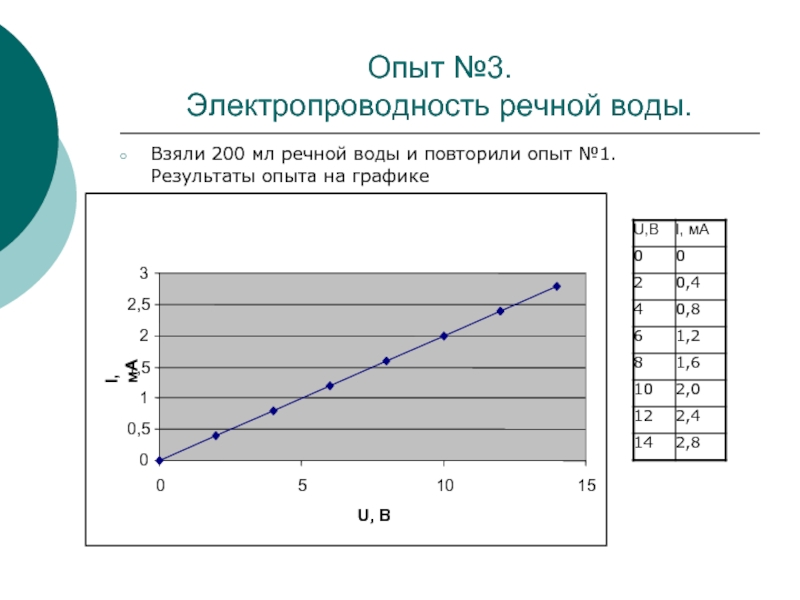
Слайд 7Опыт №3.
Электропроводность речной воды.
Взяли 200 мл речной воды и повторили
опыт №1. Результаты опыта на графике
Слайд 8Выводы о зависимости электропроводности от рода вещества
По результатам этих опытов
делаем выводы:
вода исследуемых видов не является чистой, так как
обладает определенной электропроводностью.
наибольшей электропроводностью обладает водопроводная вода; средней электропроводностью -дождевая вода, а наименьшую электропроводность имеет речная вода.
Слайд 92) Исследование зависимости
электропроводности от
концентрации электролита.
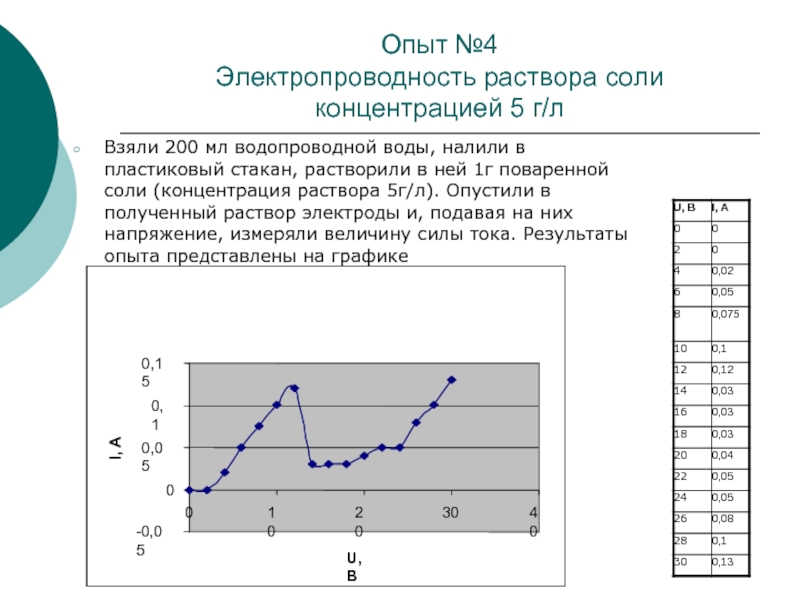
Слайд 10Опыт №4
Электропроводность раствора соли концентрацией 5 г/л
Взяли 200 мл
водопроводной воды, налили в пластиковый стакан, растворили в ней 1г
поваренной соли (концентрация раствора 5г/л). Опустили в полученный раствор электроды и, подавая на них напряжение, измеряли величину силы тока. Результаты опыта представлены на графике
Слайд 11В последующих опытах увеличивали концентрацию раствора от 5 г/л до
20 г/л. Результаты этих опытов представлены соответственно на графиках №№5,
6, 7.
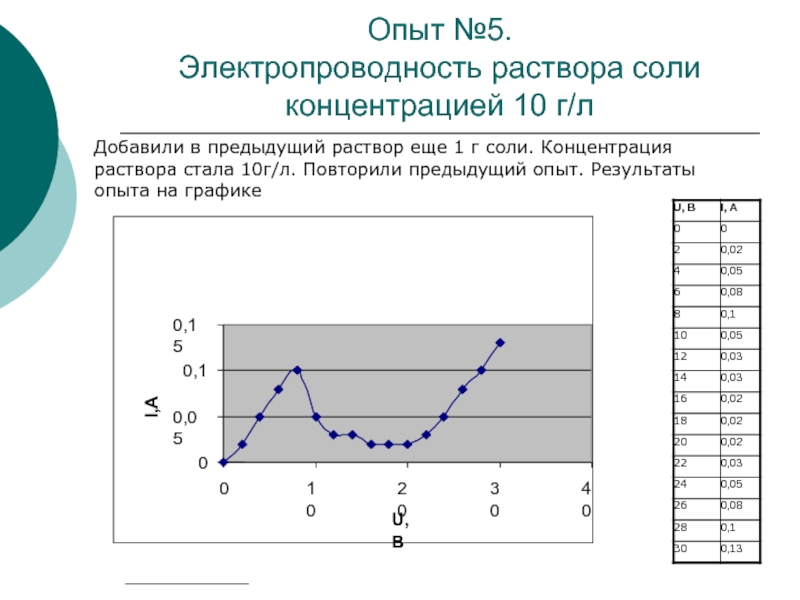
Слайд 12Опыт №5.
Электропроводность раствора соли концентрацией 10 г/л
Добавили в предыдущий
раствор еще 1 г соли. Концентрация раствора стала 10г/л. Повторили
предыдущий опыт. Результаты опыта на графике
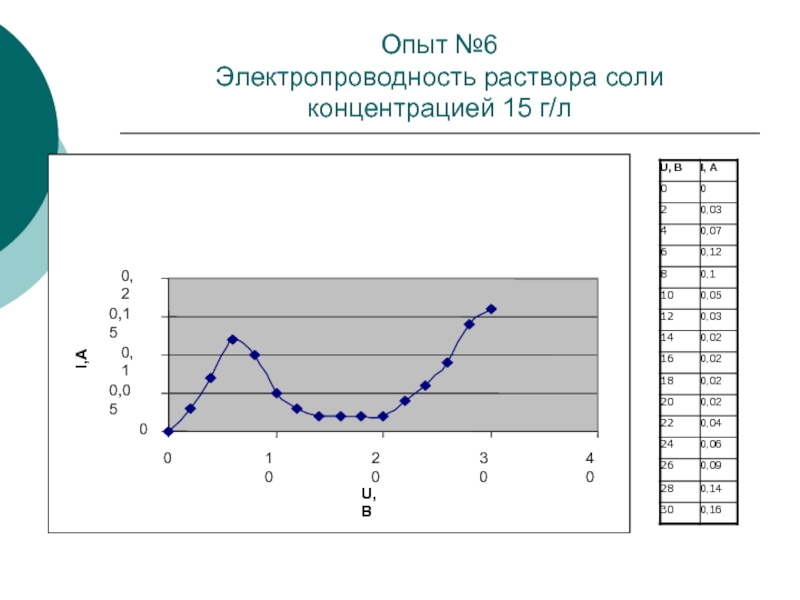
Слайд 13Опыт №6
Электропроводность раствора соли концентрацией 15 г/л
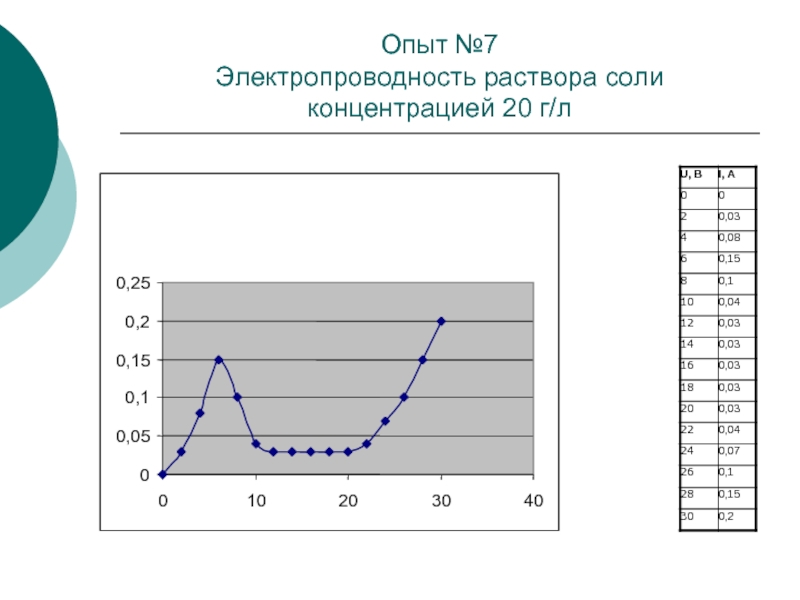
Слайд 14Опыт №7
Электропроводность раствора соли концентрацией 20 г/л
Слайд 15Выводы о зависимости электропроводности от концентрации электролита
По результатам опытов 4
– 7 делаем вывод:
при повышении концентрации электролита электропроводность раствора
возрастает.
При проведении этих опытов обнаружено интересное явление – при концентрации 25 г/л электропроводность раствора может резко увеличиваться даже при неизменном подаваемом напряжении.
Слайд 163) Исследование зависимости
электропроводности от температуры
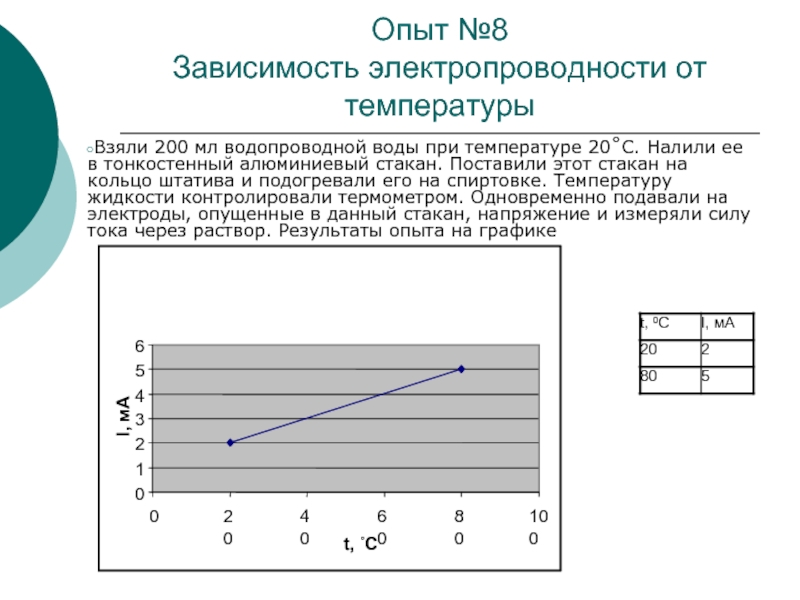
Слайд 17Опыт №8
Зависимость электропроводности от температуры
Взяли 200 мл водопроводной воды
при температуре 20˚С. Налили ее в тонкостенный алюминиевый стакан. Поставили
этот стакан на кольцо штатива и подогревали его на спиртовке. Температуру жидкости контролировали термометром. Одновременно подавали на электроды, опущенные в данный стакан, напряжение и измеряли силу тока через раствор. Результаты опыта на графике
Слайд 18Выводы о зависимости электропроводности от температуры
при повышении температуры электропроводность раствора
возрастает
Слайд 19III. Заключение.
Данная работа показала, что абсолютно чистой воды в природе
не существует. Любая вода в той или иной степени содержит
в себе растворы других веществ, это обуславливает ее электропроводность. Хотя в сравнении с металлами эта электропроводность невелика.
Результаты работы подтверждают необходимость соблюдения ТБ при выполнении работ с электроприборами: нельзя выполнять данные работы мокрыми руками или в сырых помещениях, так как существует опасность поражения электрическим током.
Слайд 20Список использованной литературы:
Детская энциклопедия для старшего и среднего возраста. 2-е
издание. Т.3. «Просвещение», М., 1966.
Иллюстрированная энциклопедия школьника. Наука и техника.
М., «Росмэн»,1999.
Кабардин О.Ф. Физика. Справочные материалы. М., «Просвещение»,1985.
Справочник школьника. Физика: М.; Филологическое общество «Слово