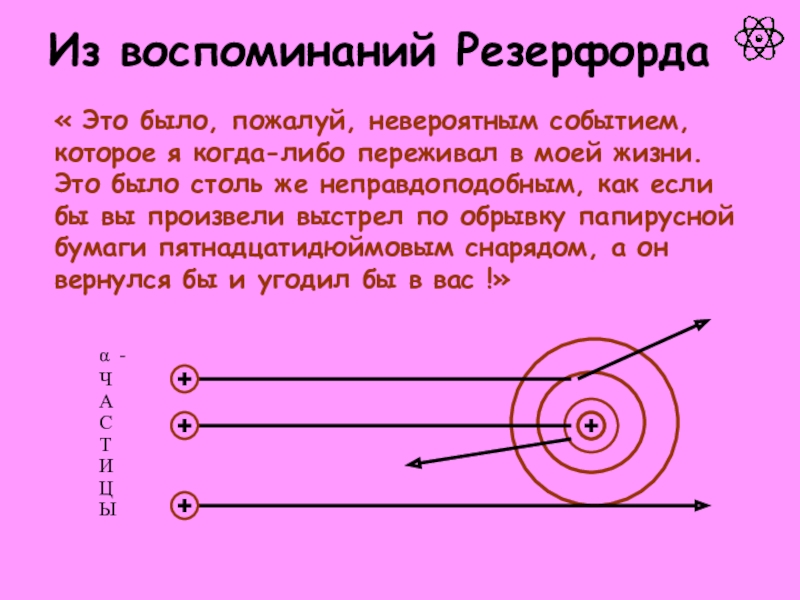
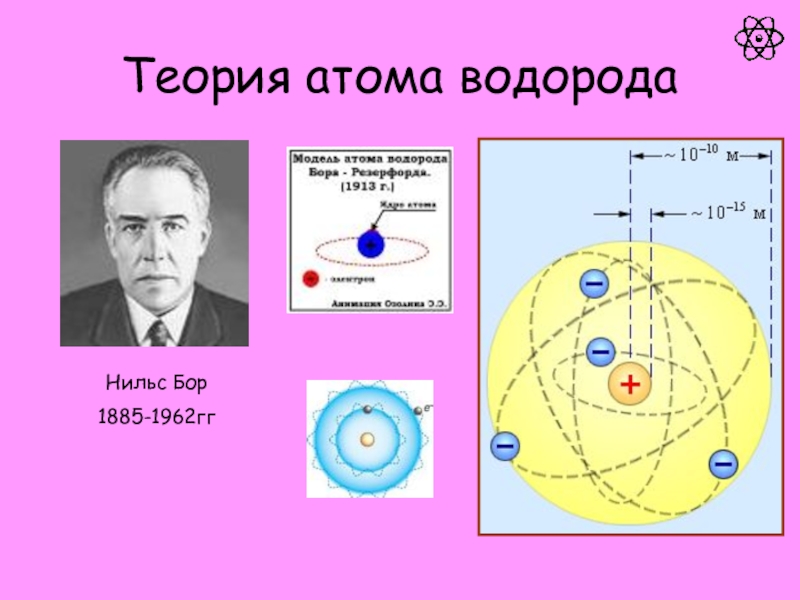
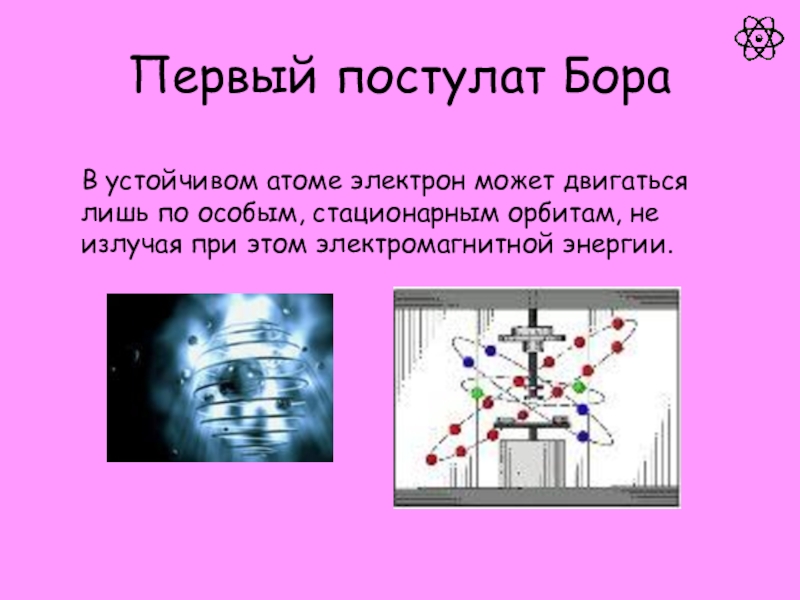
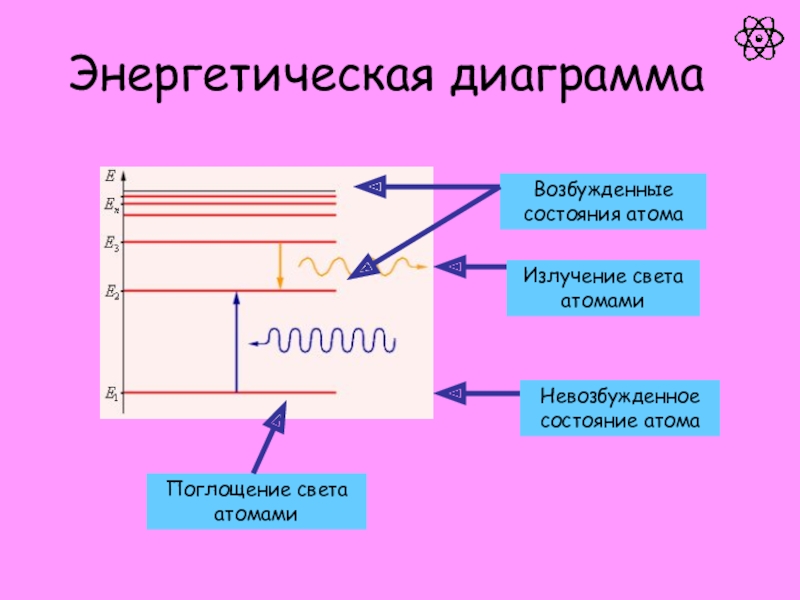
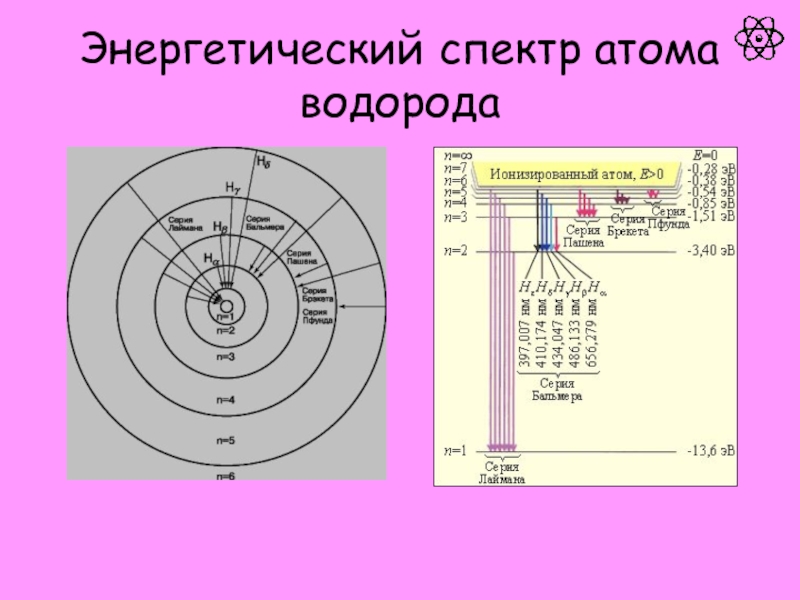
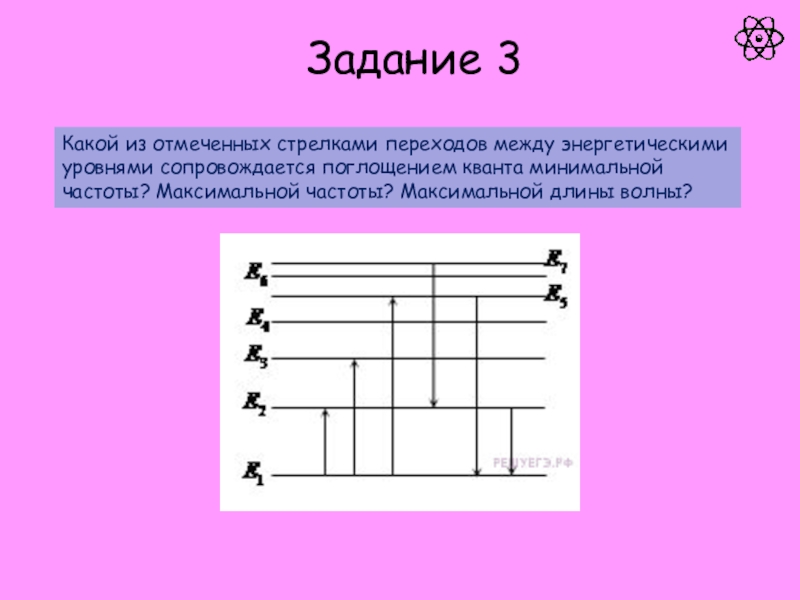
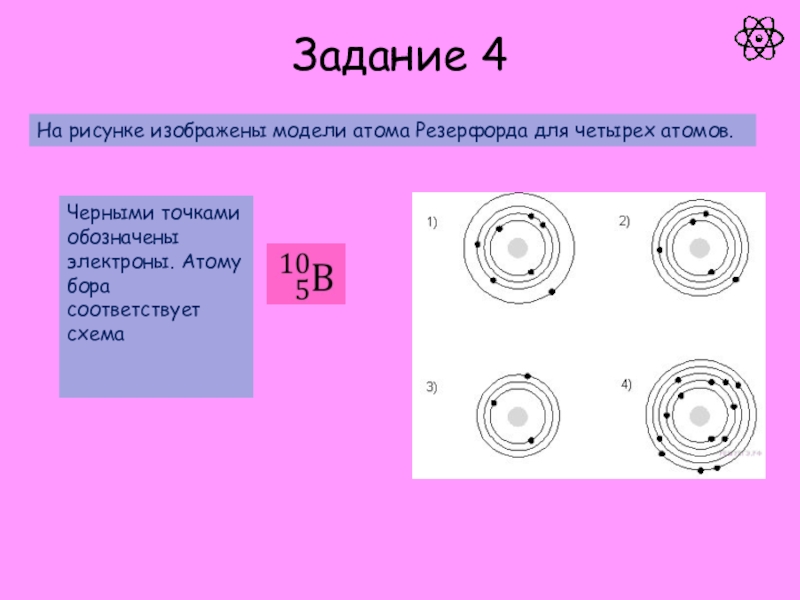
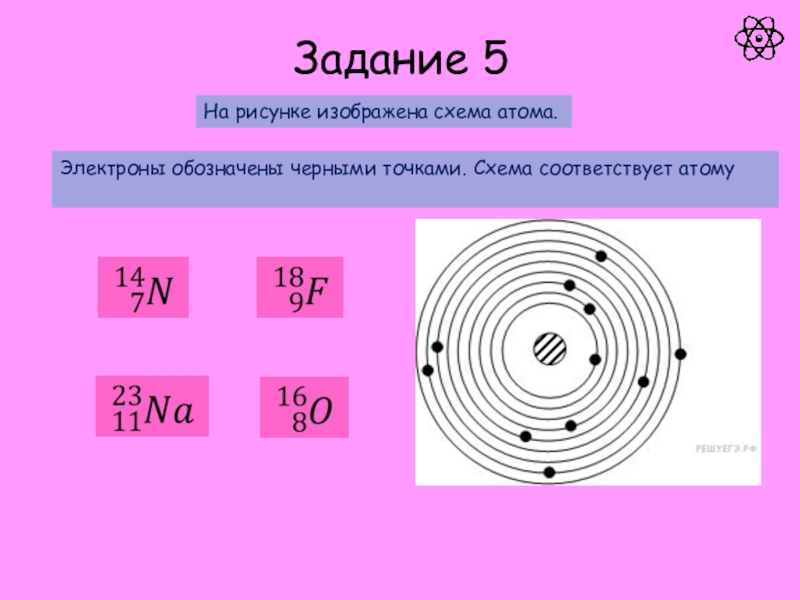
атом.
Но теперь твердит наука:
Атом - не простая штука
И устроен он
хитро.В центре - плотное ядро,
Пляшут электроны крошки…
В электронных облаках,
Как кораблик на волнах,
Плыть стремиться каждый атом
По своим координатам
В Менделеевской таблице.