Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Развитие представлений о строении атома
Содержание
- 1. Развитие представлений о строении атома
- 2. Как развивалось учение о строении атома?Строение атома Дж. Дж. ТомсонаОпыт РезерфордаПланетарная модель РезерфордаКвантовые постулаты Бора
- 3. Атом по теории древних ученых Слово
- 4. Атом – сложная частицаОткрытия конца XIX, начала
- 5. Представление о неделимости атома
- 6. Теории строения атомаГипотеза Дж.Томсона 1904 г. «Сливовый
- 7. Дж.Дж. Томсон Английский физик,
- 8. Строение атома по представлениям Томсона В 1903
- 9. Почему модель Томсона нуждалась в проверке?
- 10. Схема опыта РезерфордаОсновная идея опыта:Узкий пучек а-частиц,
- 11. Чем же объяснить рассеяние а-частиц при прохождении
- 12. Модель Резерфорда Планетарная модель атома,
- 13. Как же устроен атом?Проанализировав результаты опытов, Резерфорд
- 14. Как Нильс Бор помог Резерфорду?В 1913 году
- 15. Почему атомы излучают?Согласно постулатам Бора
- 16. На пороге квантовой механики Выбранный Нильсом Бором
- 17. ЛитератураФизика для всех / Купер Л.- «Мир»1974гФизики
- 18. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Сергеева Л. Ф.
Профессиональный лицей № 21
Г. Георгиевск
Развитие представлений о строении
атома
Слайд 2Как развивалось учение о строении атома?
Строение атома Дж. Дж. Томсона
Опыт
Резерфорда
Планетарная модель Резерфорда
Квантовые постулаты Бора
Слайд 3Атом по теории древних ученых
Слово «атом» по -
гречески означает неделимый. Древнегреческие ученые считали атомы неделимыми частицами, своеобразными
кирпичиками из которых построены все тела природы.Слайд 4Атом – сложная частица
Открытия конца XIX, начала XX века.
Дж.Томсон,
1897
г. – природа катодных лучей
А.Г.Столетов 1889 г. – явление фотоэффекта
Э.Резерфорд
1889-1900 г. – природа a-частицА.Беккерель. М.,Складовская-Кюри,
1896-1900г. – радиоактивность химических элементов.
Электрон(e)
Нейтрон(n)
Протон(p)
-
+
Слайд 5 Представление о неделимости атома утверждалось в физике
почти до конца 19 века. Дальнейшее развитие физики в корне
изменило это представление. Изучение электромагнитных явлений в конце 19 – начале 20 века показало, что атомы вещества представляют сложные образования: они состоят из частиц, являющихся носителями положительного и отрицательного электричества. Из атома вещества удалось выделить сначала мельчайшие (элементарные) отрицательно заряженные частицы – электроны. Затем были обнаружены входящие в состав атома элементарные положительно заряженные частицы – протоны.Перед учеными возникли важнейшие вопросы:
Как построен атом?
Что представляют собой отдельные части атома?
Как они взаимно расположены?
Слайд 6Теории строения атома
Гипотеза Дж.Томсона 1904 г. «Сливовый пудинг»
Планетарная модель атома
Э.Резерфорда 1911г.
Квантовые постулаты Н. Бора
1. Е=0
2. Е>0
е
е
е
е
е
е
е
Слайд 7Дж.Дж. Томсон
Английский физик, член Лондонского королевского
общества. Его работы посвящены изучению катодных и рентгеновских лучей, атомной
физике. В 1897 году, исследуя отклонение катодных лучей в магнитном и электрических полях, открыл электрон. В 1903 году предложил одну из первых атомных моделейСлайд 8Строение атома по представлениям Томсона
В 1903 г. Томсон предложил
модель атома, в которой положительный заряд считался распределенным в некоторой
небольшой области пространства сферической формы, тогда как электроны вкраплены в этот заряд подобно изюму в пироге.Каждый электрон может совершать колебательные движения около своего положения равновесия.
Положительный заряд шара равен по модулю отрицательному заряду электронов.
Поэтому электрический заряд атома в целом равен нулю.:
Слайд 9Почему модель Томсона нуждалась в проверке?
Модель строения
атома, предложенная Томсоном, нуждалась в экспериментальной проверке так как явления
радиоактивности, фотоэффекта нельзя было объяснить, применив модель атома Томсона. Важно было проверить, действительно ли положительный заряд распределен по всему объему атома с постоянной плотностью.Поэтому в 1911 году Эрнест Резерфорд провел ряд опытов по исследованию состава и строения атомов
Слайд 10Схема опыта Резерфорда
Основная идея опыта:
Узкий пучек а-частиц, испускаемых радиоактивным веществом
,направлялся на тонкую золотую фольгу, за которой помещался экран, способный
светиться под ударами быстрых частиц.Если на а- пути частиц нет никаких препятствий, то они падают на экран узким пучком.
Если на их пути поместить тонкую золотую фольгу, то а-частицы рассеиваются по всем направлениям на разные углы, а некоторые в результате взаимодействия с фольгой были отброшены назад.
Слайд 11Чем же объяснить рассеяние а-частиц при прохождении ими вещества?
Напряженность(E) создаваемого
ядром электрического поля, а значит, и сила действия на а-частицу
довольно быстро убывает с увеличением расстояния от ядра. Поэтому направление полета частицы сильно меняется, если эта проходит очень близко к ядру.Поскольку диаметр ядра значительно меньше диаметра атома, то большая часть из числа всех а-частиц проходит сквозь атом на таких расстояниях от ядра где сила отталкивания создаваемого им поля слишком мала, чтобы существенно изменить направление движения а-частиц. И только очень немногие частицы пролетают рядом с ядром, т. е. в области сильного поля, и отклоняются на большие углы.
Слайд 12Модель Резерфорда
Планетарная модель атома, предложенная Резерфордом, –
это попытка применения классических представлений о движении тел к явлениям
атомных масштабов. Эта попытка оказалась несостоятельной. Классический атом неустойчив. Электроны, движущиеся по орбите с ускорением, должны неизбежно упасть на ядро, растратив всю энергию на излучение электромагнитных волн. Впервые прозвучало, что законы классической механики не могут объяснить явления, происходящие на атомном уровне.Слайд 13Как же устроен атом?
Проанализировав результаты опытов, Резерфорд в 1911 году
предложил следующую модель атома:
Атом состоит из положительно заряженного ядра,
которое занимает ничтожно малый объем атома. Вокруг ядра расположены электроны.Электроны вращаются вокруг ядра на достаточно больших расстояниях от него. Совокупность этих электронов называют электронной оболочкой.
Таким образом, Атом представляется в виде планетной системы в маленьком масштабе(поэтому такую модель назвали планетарной)
Слайд 14Как Нильс Бор помог Резерфорду?
В 1913 году датский физик Нильс
Бор развил теорию квантовых представлений о процессах в природе. Он
сформулировал в виде постулатов основные положения новой теории, которые налагали некоторые ограничения на допускаемые классической физикой движения.Нильс Бор применил свои постулаты для простейшей атомной системы – атома водорода.
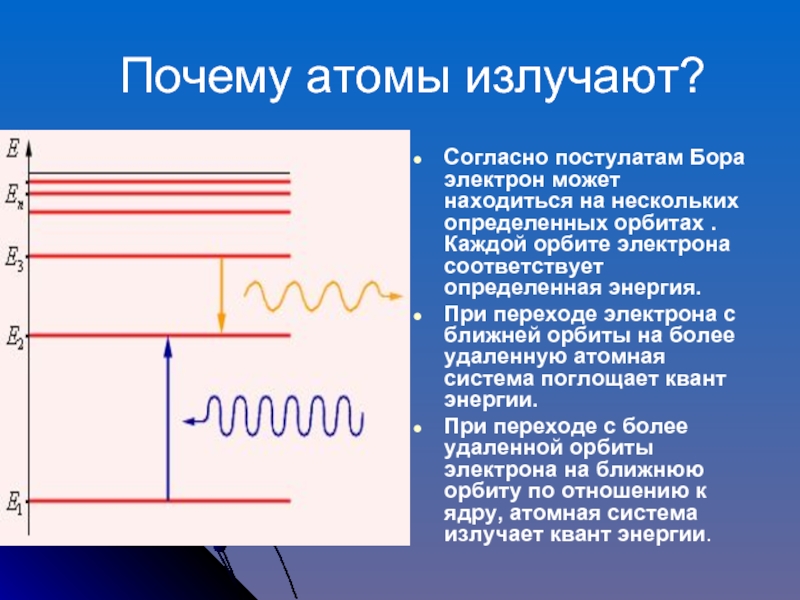
Слайд 15 Почему атомы излучают?
Согласно постулатам Бора электрон может находиться
на нескольких определенных орбитах .Каждой орбите электрона соответствует определенная энергия.
При
переходе электрона с ближней орбиты на более удаленную атомная система поглощает квант энергии.При переходе с более удаленной орбиты электрона на ближнюю орбиту по отношению к ядру, атомная система излучает квант энергии.