Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Урок физики в 10 классе по теме "Изопроцессы. Газовые законы"
Содержание
- 1. Урок физики в 10 классе по теме "Изопроцессы. Газовые законы"
- 2. Цели урока: познакомитьсяс понятием «изопроцесс»с видами изопроцессовс законами протекания различных изопроцессов
- 3. Задачи урока: с помощью демонстрационного,
- 4. Вопросы для повторения: Что называют уравнением состояния?Запишите
- 5. Итак, зная уравнение состояния, можно
- 6. Изопроцессы в газахПроцессы, протекающие при неизменном значении одного из параметров, называют изопроцессами.Рассмотрим следующие изопроцессы:
- 7. Газовые законы количественноописывают изопроцессы, происходящие в газах.Газовый
- 8. Слайд 8
- 9. Установка для демонстрации закономерностей изотермического процесса
- 10. Несколько раз медленно
- 11. Зависимость давления газа от объема в изотермическом процессе
- 12. Вывод:При уменьшении объема давление газа увеличивается, а
- 13. Этот закон экспериментально был открыт английским ученым
- 14. Закон Бойля- Мариотта Т =
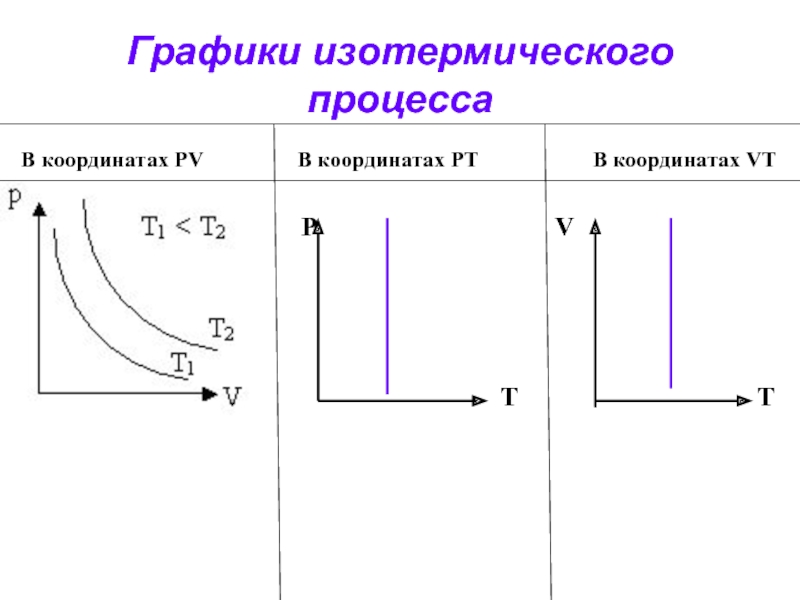
- 15. Графики изотермического процесса В координатах PV
- 16. Какие параметры газа остаются постоянными при изотермическом
- 17. Лабораторная работа «Изучение закономерностей изохорного процесса»
- 18. Цель работы: выяснить характер зависимости
- 19. Вывод:При уменьшении температуры давление газа уменьшается, при
- 20. Этот закон экспериментально был открыт французским ученым Шарлем. Поэтому он носит название закона Шарля.
- 21. Закон Шарля V=const, процесс изохорный.1 состояние газа:2 состояние газа:m = const
- 22. Графики изохорного процессаВ координатах PV
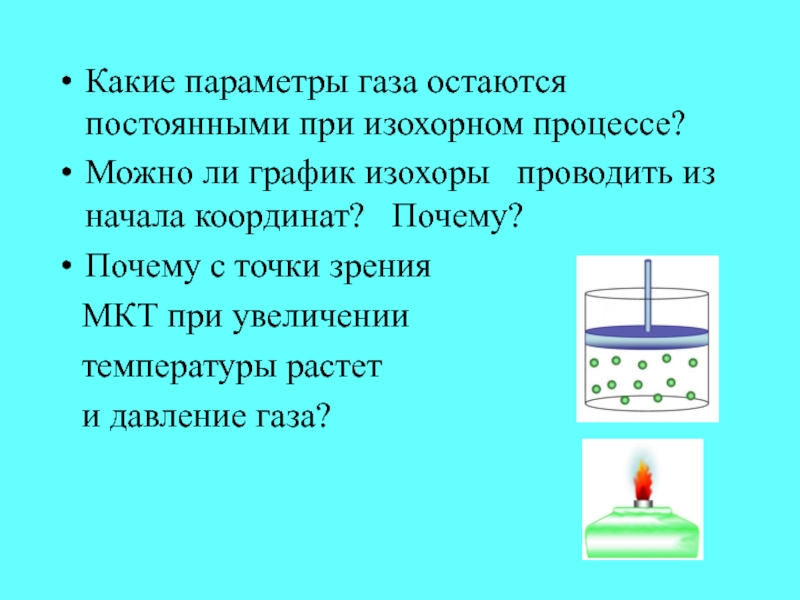
- 23. Какие параметры газа остаются постоянными при изохорном
- 24. Изобарный процесс р=const, процесс изобарный. 1
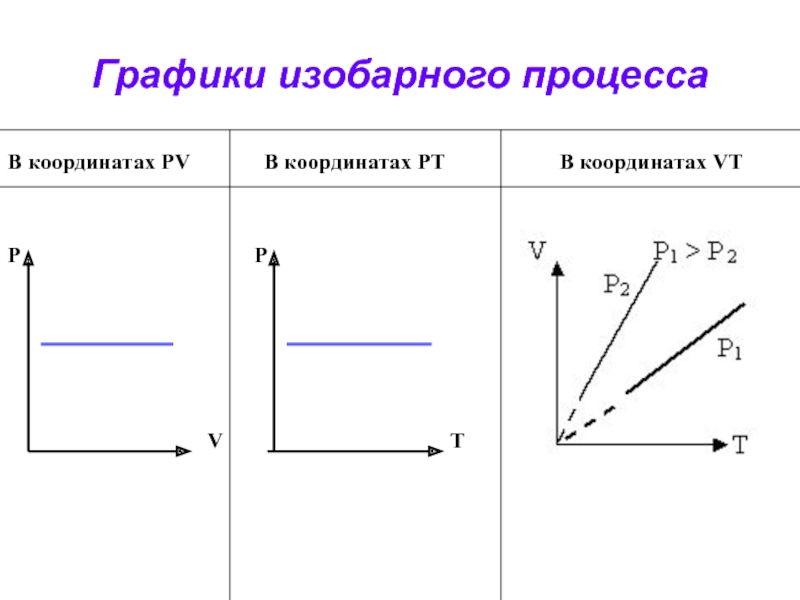
- 25. Графики изобарного процессаВ координатах PV
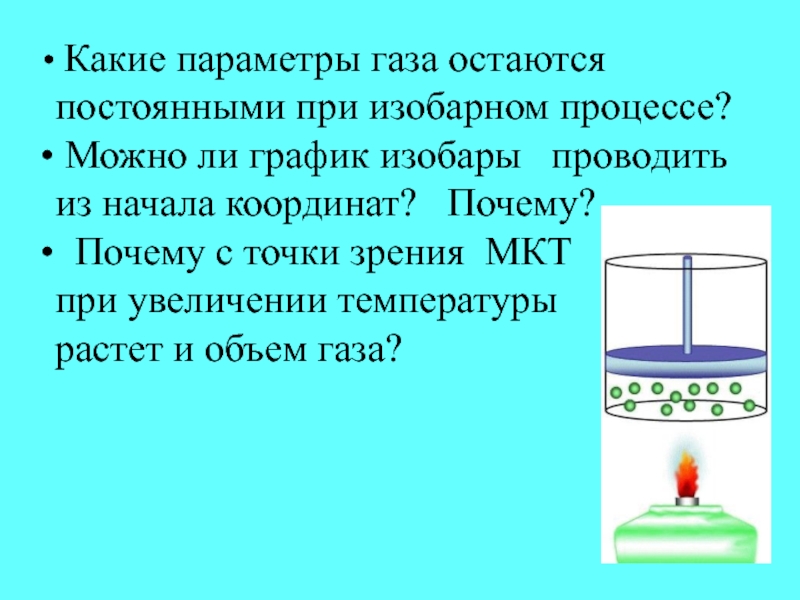
- 26. Какие параметры газа остаются постоянными при
- 27. Изопроцессы в природе и техникеУвеличение давления газа
- 28. Для поддержания температуры газа постоянной необходимо, чтобы
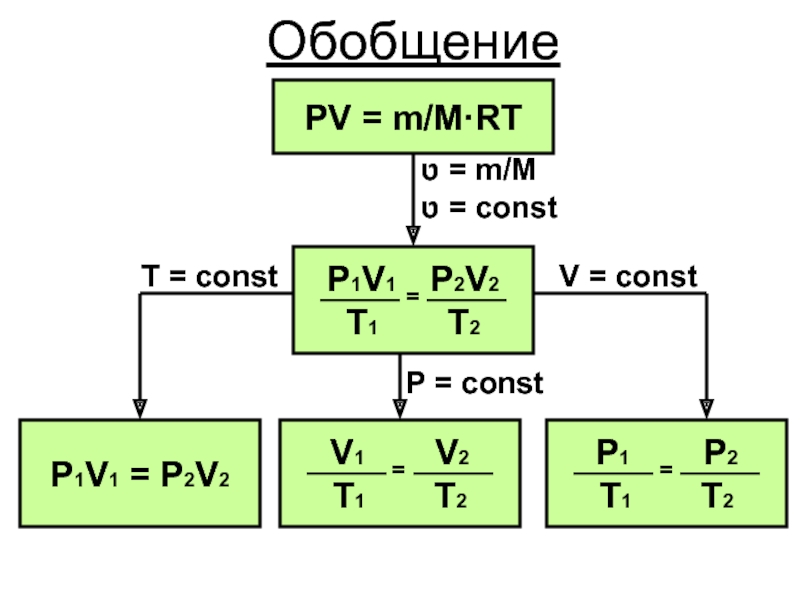
- 29. ОбобщениеPV = m/M·RTט = m/Mט = constP1V1 = P2V2V = constT = constP = const
- 30. Домашнее задание: § 71, ответить на вопросы на стр.194
- 31. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2 Цели урока: познакомиться
с понятием «изопроцесс»
с видами изопроцессов
с
законами протекания различных изопроцессов
Слайд 3 Задачи урока:
с помощью демонстрационного, лабораторного и виртуального
экспериментов установить закономерности изопроцессов;
доказать, что данные законы являются следствием уравнения
Менделеева-Клапейрона;познакомиться с графиками изопроцессов.
Слайд 4Вопросы для повторения:
Что называют уравнением состояния?
Запишите уравнение Менделеева —
Клапейрона.
Почему газовая постоянная R называется универсальной?
Для чего нужно уравнение состояния?
Слайд 5 Итак, зная уравнение состояния, можно сказать, как протекают
в системе различные процессы при определенных внешних условиях: например, как
будет меняться давление газа, если увеличивать его объем при неизменной температуре, и т. д. Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами.Слайд 6Изопроцессы в газах
Процессы, протекающие при неизменном значении одного из параметров,
называют изопроцессами.
Рассмотрим следующие изопроцессы:
Слайд 7Газовые законы количественно
описывают изопроцессы, происходящие в газах.
Газовый закон –
количественная зависимость
между
двумя параметрами газа
одной и той же массы при
фиксированном значении третьего.Слайд 10 Несколько раз медленно будем изменять на одну условную единицу объем
воздуха в цилиндре и наблюдать за показаниями манометра, фиксируя значение
давления воздуха. Данные опыта запишем в таблицу.2
2
Слайд 12Вывод:
При уменьшении объема давление газа увеличивается, а при увеличении объема
газа давление уменьшается.
Произведение PV для любого состояния остается постоянным
при неизменной массе газа и постоянной температуре.При изотермическом процессе давление газа обратно пропорционально его объему.
Слайд 13Этот закон экспериментально был открыт английским ученым Р.Бойлем и несколько
позже французским ученым Э.Мариоттом. Поэтому он носит название Бойля-Мариотта.
Английский
ученый Р.БойльФранцузский ученый Э. Мариотт
Слайд 14Закон Бойля- Мариотта
Т = const, процесс изотермический
1 состояние газа:
2 состояние газа:
m = const
PV = PV
= const при Т = constPV = const при Т = const
1
1
2
2
Слайд 16Какие параметры газа остаются постоянными при изотермическом процессе?
Как эти
условия обеспечиваются в опыте ?
Почему с точки зрения МКТ при
уменьшении объема растет давление газа? Слайд 18 Цель работы: выяснить характер зависимости давления идеального газа
от температуры при неизменном объеме газа.
Оборудование: пластиковый сосуд объемом 55 мл, медицинский манометр, соединительные ПВХ трубки, термометр, стакан с горячей водой.Выполнение работы: сравнить 2 состояния воздуха в сосуде при постоянном объеме 60 мл .
Слайд 19Вывод:
При уменьшении температуры давление газа уменьшается, при увеличении температуры давление
газа увеличивается.
Отношение для
любого состояния остается постоянным при неизменной массе газа и постоянном объеме.При изохорном процессе давление газа прямо пропорционально температуре.
Слайд 20Этот закон экспериментально был открыт французским ученым Шарлем. Поэтому он
носит название закона Шарля.
Слайд 23Какие параметры газа остаются постоянными при изохорном процессе?
Можно ли
график изохоры проводить из начала координат? Почему?
Почему
с точки зрения МКТ при увеличении
температуры растет
и давление газа?
Слайд 26 Какие параметры газа остаются постоянными при изобарном процессе?
Можно ли график изобары проводить из начала координат?
Почему?Почему с точки зрения МКТ
при увеличении температуры
растет и объем газа?
Слайд 27Изопроцессы в природе и технике
Увеличение давления газа в любой емкости
или в электрической лампочке при нагревании является изохорным процессом. Изохорный
процесс используется в газовых термометрах постоянного объема.Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня.