Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Аммиак: состав, строение, свойства, применение
Содержание
- 1. Аммиак: состав, строение, свойства, применение
- 2. Аммиак может быть обязан своим названием оазису
- 3. По некоторым другим сведениям, аммиак мог получить
- 4. Сокращенное название «аммиак» которым мы всегда пользуемся,
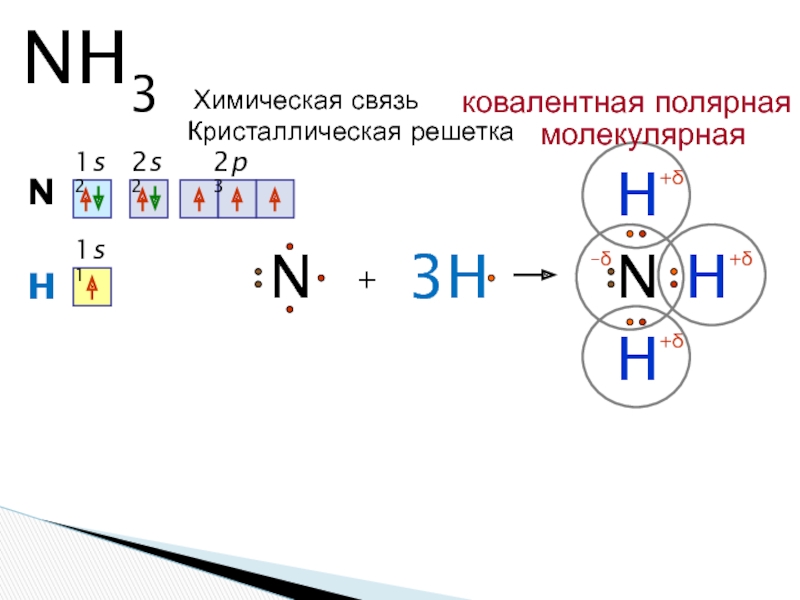
- 5. Строение молекулы
- 6. NH3N1s22s22p3+HNHH3HHN1s1+δ+δ+δ–δХимическая связьковалентная полярнаяКристаллическая решеткамолекулярная
- 7. Молекула аммиака имеет форму тригональной пирамиды с
- 8. Физические свойства (при н.у. )бесцветный газ с
- 9. По физиологическому действию на организм относится к
- 10. Получение аммиакаДля получения аммиака в лаборатории используют
- 11. Промышленный способ получения аммиака основан на прямом
- 12. Химические свойства аммиакаДля аммиака характерны реакции:1) с
- 13. Реакции с изменением степени окисления атома азота (реакции окисления)N-3 → N0→ N+2NH3-сильный восстановитель
- 14. с кислородомГорение аммиака (при нагревании)4NH3 + 3O2 → 2N2 + 6H20 Каталитическое окисление амииака (катализатор Pt – Rh, температура)4NH3 + 5O2 → 4NO + 6H2O
- 15. с оксидами металлов2NH3 +3CuO =3Cu + N2 +3H2O
- 16. с сильными окислителями2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
- 17. Реакции без изменения степени окисления атома азота (присоединение - образование иона аммония NH4+ по донорно-акцепторному механизму
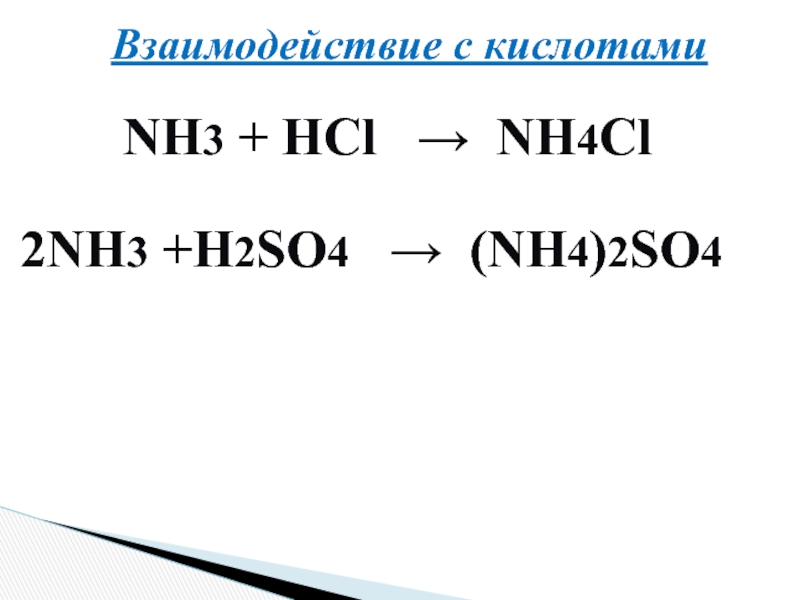
- 18. Взаимодействие с кислотамиNH3 + HCl → NH4Cl2NH3 +H2SO4 → (NH4)2SO4
- 19. Взаимодействие с водойNH3 + H2O = NH4OHПри добавлении фенолфталеина‑ раствор становится
- 20. Применение аммиакаПроизводство пластмасс и волокон2. В составе моющих средств
- 21. 3. Производство азотных удобрений4. В сельском хозяйстве
- 22. 5. Производство азотной кислоты 6. Получение взрывчатых веществ
- 23. 7. В медицине
- 24. По объемам производства аммиак занимает одно из
- 25. Это интересноПары нашатырного спирта способны изменять окраску
- 26. Скачать презентанцию
Аммиак может быть обязан своим названием оазису бога Аммона в Северной Африке, находящемуся на перекрестке караванных путей. В очень жарком климате мочевина (NH2)2CO, разлагается особенно быстро. Одним из основных
Слайды и текст этой презентации
Слайд 1Аммиак: состав, строение, свойства, применение
NH3
Лукуша Елена Фёдоровна, учитель химии МБОУ
«Морская средняя школа» городского округа Судак, Республики Крым
Слайд 2Аммиак может быть обязан своим названием оазису бога Аммона в
Северной Африке, находящемуся на перекрестке караванных путей.
В очень жарком
климате мочевина (NH2)2CO, разлагается особенно быстро. Одним из основных продуктов разложения и является аммиак.
Оазис «Аммон»
в Северной Африке
Слайд 3По некоторым другим сведениям, аммиак мог получить современное название от
древнеегипетского слова «амониан».
Так называли всех
верующих людей, поклоняющихся богу Амону. Люди во время своих ритуальных обрядов нюхали NH4Cl, который при нагревании издаёт запах аммиака.
Бог Аммон в образе барана
Слайд 4Сокращенное название «аммиак» которым мы всегда пользуемся, ввел в обиход
в 1801 году русский ученый - химик, академик
Яков Дмитриевич
Захаров, который впервые разработал также и систему русской химической номенклатуры. 1781-1852 г.
Слайд 6NH3
N
1s2
2s2
2p3
+
H
N
H
H
3H
H
N
1s1
+δ
+δ
+δ
–δ
Химическая связь
ковалентная полярная
Кристаллическая решетка
молекулярная
Слайд 7Молекула аммиака имеет форму тригональной пирамиды с атомом азота в
вершине.
Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей
с 1s-электроном трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+Слайд 8Физические свойства (при н.у. )
бесцветный газ
с резким характерным запахом
(запах нашатырного спирта)
легче воздуха (М=17 г/моль)
хорошо растворяется в воде (1200
объёмов при 0 °C) и 700 объёмов (при 20 °C) в объёме водытемпература плавления -77.73 °C
температура кипения -33.34 °C
ЯДОВИТ!
Слайд 9По физиологическому действию на организм относится к группе веществ удушающего
и нейротропного действия, способных вызвать токсический отёк лёгких и тяжёлое
поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы.Слайд 10
Получение аммиака
Для получения аммиака в лаборатории используют действие сильных щелочей
на соли аммония:
2NH4Cl + Ca(OH)2= 2NH3↑ + СaCl2+ 2H2O
(NH4)2SO4 + 2NaOH = 2NH3↑ + Na2SO4 + 2H2O
Гидроксид аммония неустойчивое основание,
разлагается:NH4OH ↔ NH3↑ + H2O
При получении аммиака держите пробирку - приёмник дном кверху, так как аммиак легче воздуха:
Слайд 11Промышленный способ получения аммиака основан на прямом взаимодействии водорода и
азота:
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
Условия:
катализатор – пористое железо
температура – 450 – 500
˚Сдавление – 25 – 30 МПа
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).