Слайд 1Ароматические углеводороды (арены)
Слайд 2Арены
Ароматическими углеводородами (аренами) называются вещества, в молекулах которых содержится одно
или несколько бензольных колец — циклических групп атомов углерода с
особым характером связей.
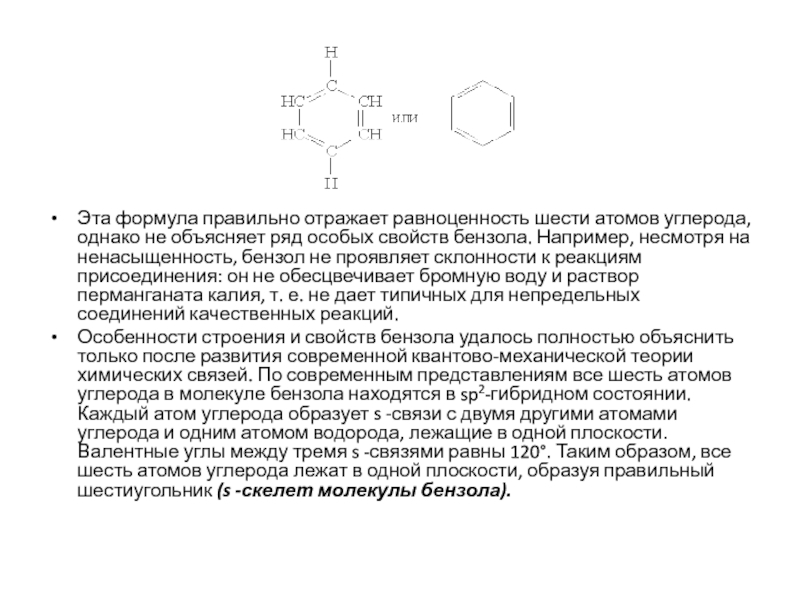
Понятие “бензольное кольцо” требует расшифровки. Для этого необходимо рассмотреть строение молекулы бензола. Первая структура бензола была предложена в 1865г. немецким ученым А. Кекуле:
Слайд 3Эта формула правильно отражает равноценность шести атомов углерода, однако не
объясняет ряд особых свойств бензола. Например, несмотря на ненасыщенность, бензол
не проявляет склонности к реакциям присоединения: он не обесцвечивает бромную воду и раствор перманганата калия, т. е. не дает типичных для непредельных соединений качественных реакций.
Особенности строения и свойств бензола удалось полностью объяснить только после развития современной квантово-механической теории химических связей. По современным представлениям все шесть атомов углерода в молекуле бензола находятся в sp2-гибридном состоянии. Каждый атом углерода образует s -связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Валентные углы между тремя s -связями равны 120°. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник (s -скелет молекулы бензола).
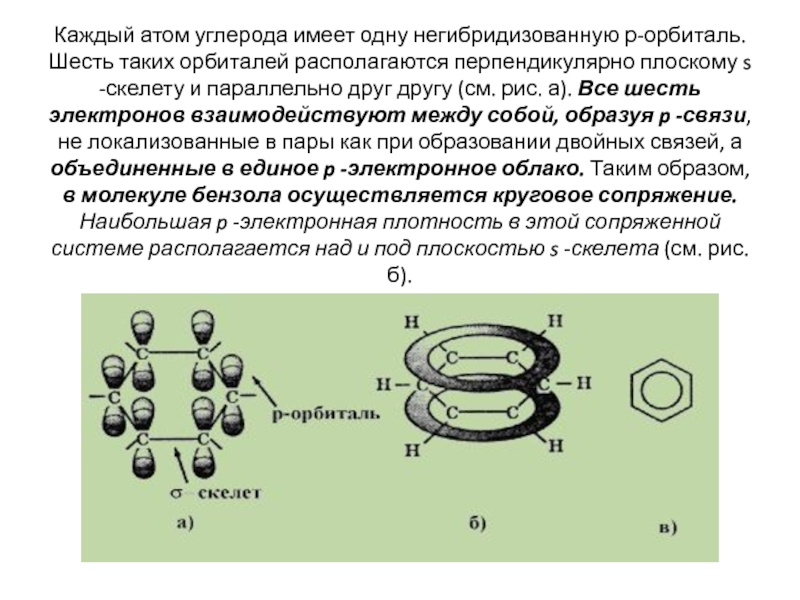
Слайд 4Каждый атом углерода имеет одну негибридизованную р-орбиталь. Шесть таких орбиталей
располагаются перпендикулярно плоскому s -скелету и параллельно друг другу (см.
рис. а). Все шесть электронов взаимодействуют между собой, образуя p -связи, не локализованные в пары как при образовании двойных связей, а объединенные в единое p -электронное облако. Таким образом, в молекуле бензола осуществляется круговое сопряжение. Наибольшая p -электронная плотность в этой сопряженной системе располагается над и под плоскостью s -скелета (см. рис. б).
Слайд 5В результате все связи между атомами углерода в бензоле выровнены
и имеют длину 0,139нм. Эта величина является промежуточной между длиной
одинарной связи в алканах (0,154нм) и длиной двойной связи в алкенах (0,133 им). Равноценность связей принято изображать кружком внутри цикла (см. рис. в). Круговое сопряжение дает выигрыш в энергии 150 кДж/моль. Эта величина составляет энергию сопряжения — количество энергии, которое нужно затратить, чтобы нарушить ароматическую систему бензола.
Такое электронное строение объясняет все особенности бензола. В частности, понятно, почему бензол трудно вступает в реакции присоединения, — это привело бы к нарушению сопряжения. Такие реакции возможны только в очень жестких условиях.
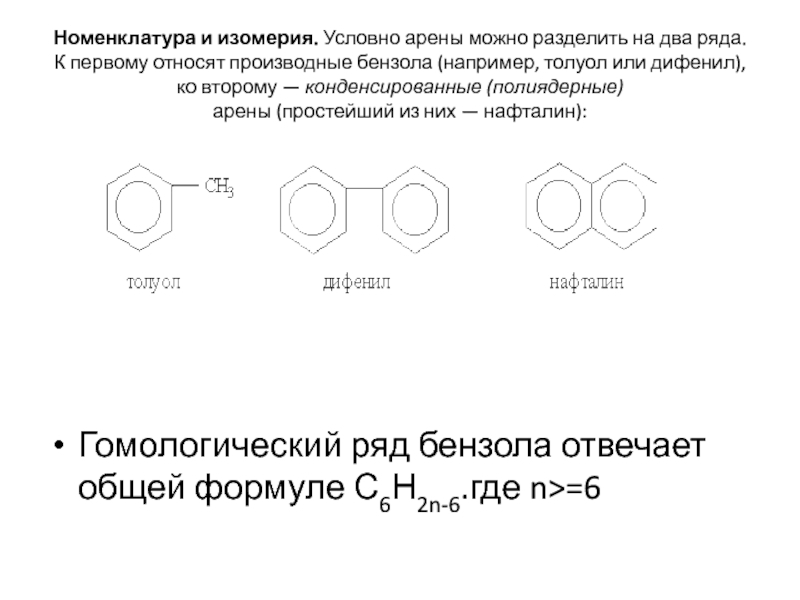
Слайд 6Номенклатура и изомерия. Условно арены можно разделить на два ряда.
К первому относят производные бензола (например, толуол или дифенил), ко
второму — конденсированные (полиядерные)
арены (простейший из них — нафталин):
Гомологический ряд бензола отвечает общей формуле С6Н2n-6.где n>=6
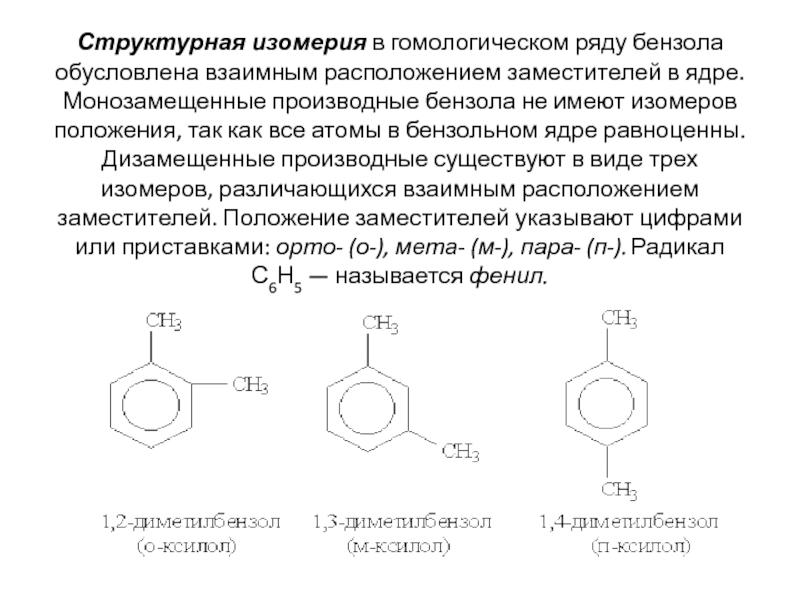
Слайд 7Структурная изомерия в гомологическом ряду бензола обусловлена взаимным расположением заместителей
в ядре. Монозамещенные производные бензола не имеют изомеров положения, так
как все атомы в бензольном ядре равноценны. Дизамещенные производные существуют в виде трех изомеров, различающихся взаимным расположением заместителей. Положение заместителей указывают цифрами или приставками: орто- (о-), мета- (м-), пара- (п-). Радикал С6Н5 — называется фенил.
Слайд 8Физические свойства.
Первые члены гомологического ряда бензола (например, толуол, этилбензол и
др.) — бесцветные жидкости со специфическим запахом. Они легче воды
и нерастворимы в ней. Хорошо растворяются в органических растворителях. Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Слайд 9Способы получения.
1. Получение из алифатических углеводородов. При пропускании алканов
с неразветвленной цепью, имеющих не менее шести атомов углерода в
молекуле, над нагретой платиной или оксидом хрома происходит дегидроциклизация — образование арена с выделением водорода:
Слайд 102. Дегидрирование циклоалканов. Реакция происходит при пропускании паров циклогексана и
его гомологов над нагретой платиной:
3. Получение бензола тримеризацией ацетилена.
4. Получение
гомологов бензола по реакции Фриделя—Крафтса (см. далее).
5. Сплавление солей ароматических кислот со щелочью:
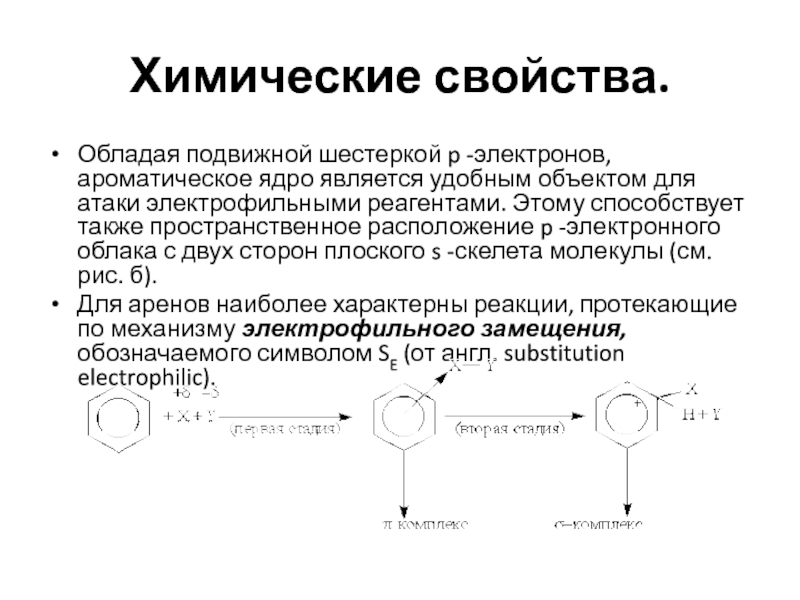
Слайд 11Химические свойства.
Обладая подвижной шестеркой p -электронов, ароматическое ядро является
удобным объектом для атаки электрофильными реагентами. Этому способствует также пространственное
расположение p -электронного облака с двух сторон плоского s -скелета молекулы (см. рис. б).
Для аренов наиболее характерны реакции, протекающие по механизму электрофильного замещения, обозначаемого символом SE (от англ. substitution electrophilic).
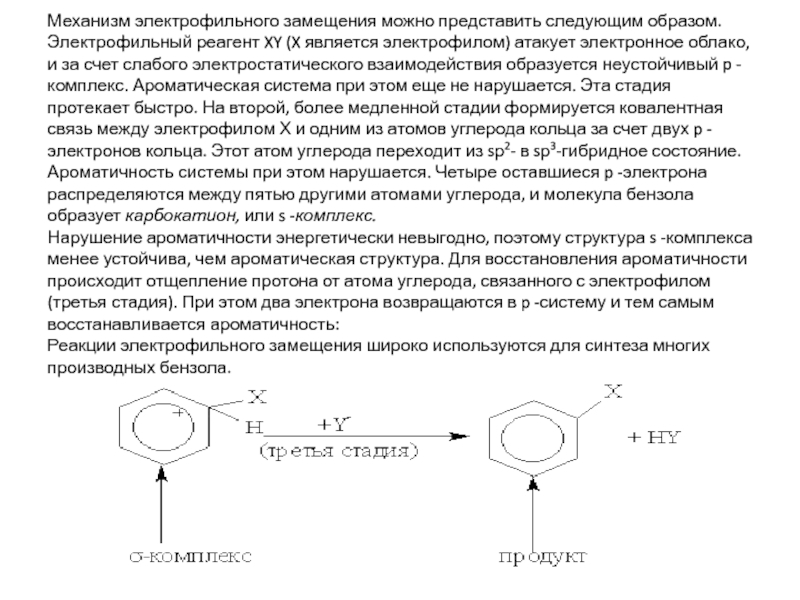
Слайд 12Механизм электрофильного замещения можно представить следующим образом. Электрофильный реагент XY
(X является электрофилом) атакует электронное облако, и за счет слабого
электростатического взаимодействия образуется неустойчивый p -комплекс. Ароматическая система при этом еще не нарушается. Эта стадия протекает быстро. На второй, более медленной стадии формируется ковалентная связь между электрофилом Х и одним из атомов углерода кольца за счет двух p -электронов кольца. Этот атом углерода переходит из sр2- в sр3-гибридное состояние. Ароматичность системы при этом нарушается. Четыре оставшиеся p -электрона распределяются между пятью другими атомами углерода, и молекула бензола образует карбокатион, или s -комплекс.
Нарушение ароматичности энергетически невыгодно, поэтому структура s -комплекса менее устойчива, чем ароматическая структура. Для восстановления ароматичности происходит отщепление протона от атома углерода, связанного с электрофилом (третья стадия). При этом два электрона возвращаются в p -систему и тем самым восстанавливается ароматичность:
Реакции электрофильного замещения широко используются для синтеза многих производных бензола.
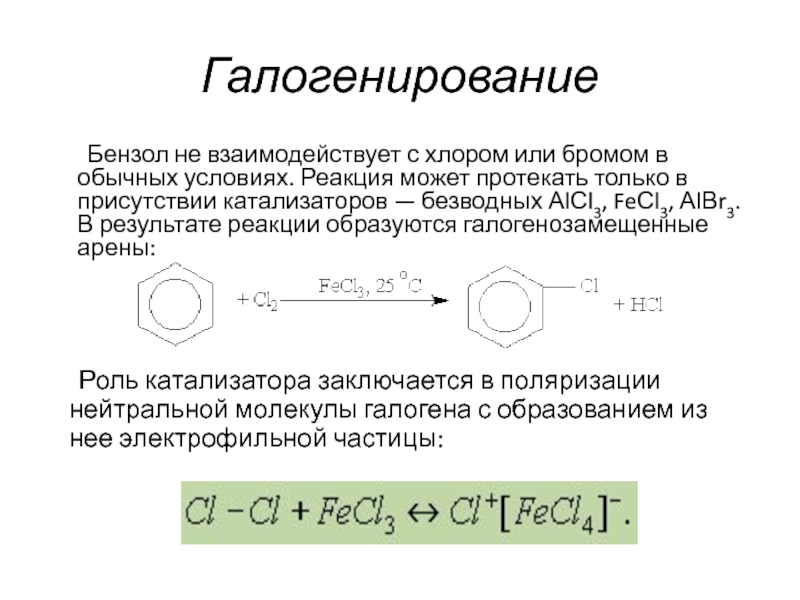
Слайд 13Галогенирование
Бензол не взаимодействует с хлором или бромом в обычных условиях.
Реакция может протекать только в присутствии катализаторов — безводных АlСl3,
FeСl3, АlВr3. В результате реакции образуются галогенозамещенные арены:
Роль катализатора заключается в поляризации нейтральной молекулы галогена с образованием из нее электрофильной частицы:
Слайд 14Нитрование.
Бензол очень медленно реагирует с концентрированной азотной кислотой даже
при сильном нагревании. Однако при действии так называемой нитрующей смеси
(смесь концентрированных азотной и серной кислот) реакция нитрования проходит достаточно легко:
Слайд 15Сулъфирование.Реакция легко проходит под действием “дымящей” серной кислоты (олеума):
Алкилирование по
Фриделю—Крафтсу. В результате реакции происходит введение в бензольное ядро алкильной
группы с получением гомологов бензола. Реакция протекает при действии на бензол галогеналканов RСl в присутствии катализаторов — галогенидов алюминия. Роль катализатора сводится к поляризации молекулы RСl с образованием электрофильной частицы, и в зависимости от строения радикала в галогеналкане можно получить разные гомологи бензола:
Слайд 16Все рассмотренные выше реакции протекают по механизму электрофильного замещения SE.
Реакции
присоединения к аренам приводят к разрушению ароматической системы и требуют
больших затрат энергии, поэтому протекают только в жестких условиях.
Алкилирование алкенами. Эти реакции широко используются в промышленности для получения этилбензола и изопропилбензола (кумола). Алкилирование проводят в присутствии катализатора АlСl3. Механизм реакции сходен с механизмом предыдущей реакции:
Слайд 17 Гидрирование. Реакция присоединения водорода к аренам идет при нагревании и
высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd). Бензол
превращается в циклогексан, а гомологи бензола — в производные циклогексана:
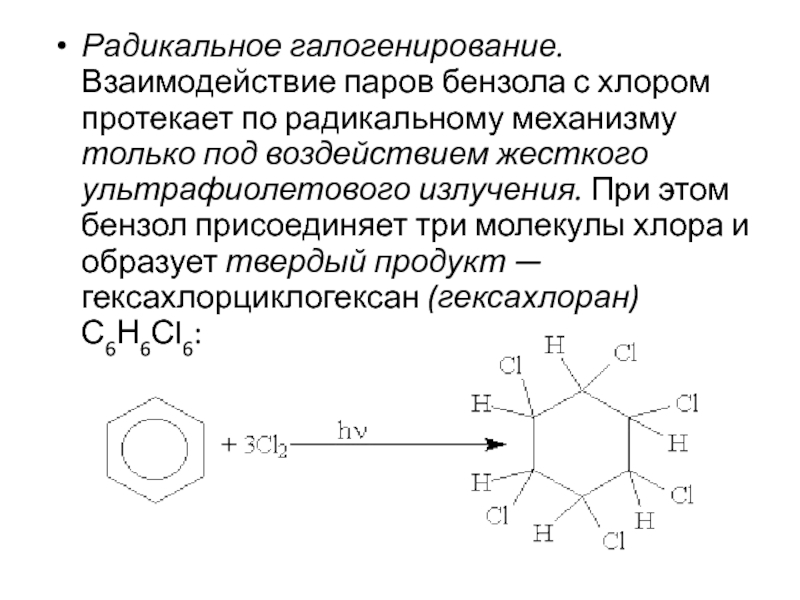
Слайд 18Радикальное галогенирование. Взаимодействие паров бензола с хлором протекает по радикальному
механизму только под воздействием жесткого ультрафиолетового излучения. При этом бензол
присоединяет три молекулы хлора и образует твердый продукт — гексахлорциклогексан (гексахлоран) С6Н6Сl6:
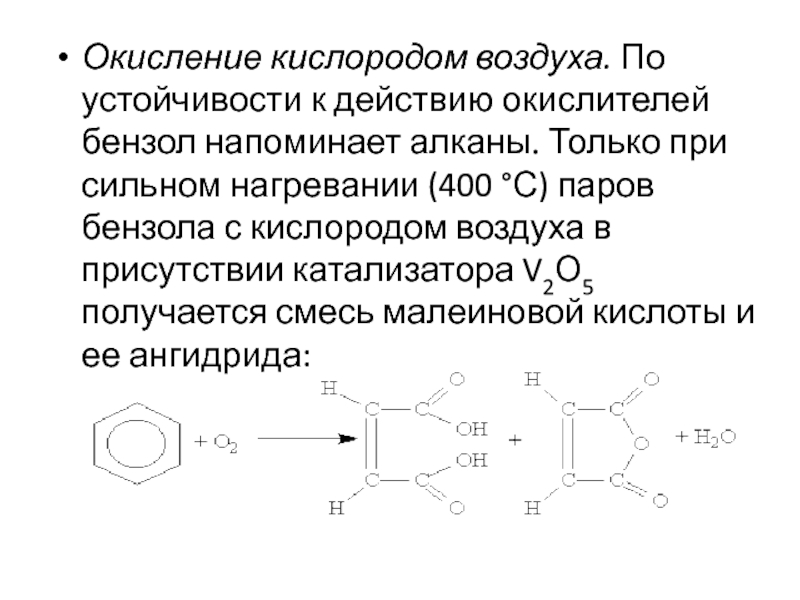
Слайд 19Окисление кислородом воздуха. По устойчивости к действию окислителей бензол напоминает
алканы. Только при сильном нагревании (400 °С) паров бензола с
кислородом воздуха в присутствии катализатора V2О5 получается смесь малеиновой кислоты и ее ангидрида:
Слайд 20Химические свойства гомологов бензола.
Гомологи бензола имеют целый ряд особых
химических свойств, связанных со взаимным влиянием алкильного радикала на бензольное
кольцо, и наоборот.