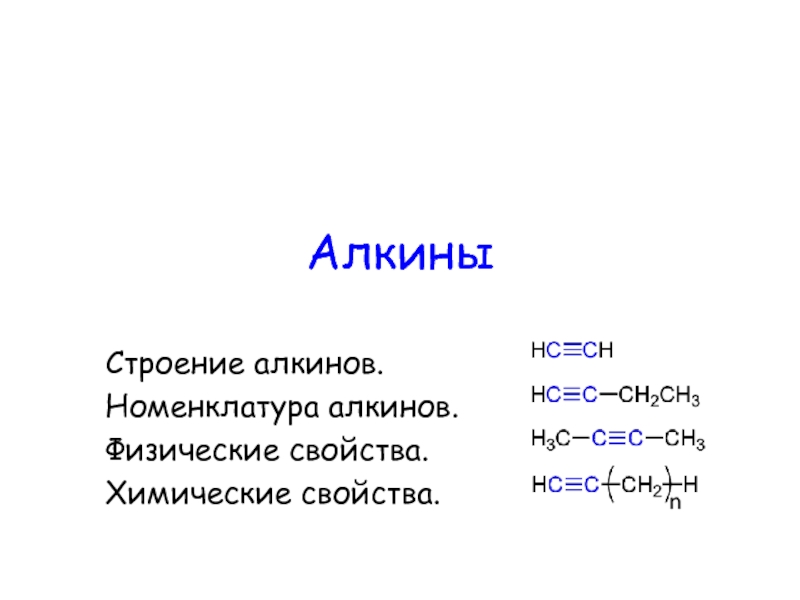
Джабиром ибн Хайяном (Гебер) в его труде «Ямщик мудрости», а
с ХV века это вещество добывалось для производственных целей.- Благодаря этому веществу русский учёный В.Ф. Петрушевский в 1866 году впервые получил динамит.
- Это вещество – прародитель большинства взрывчатых веществ (например, тротила, или тола).
- Это вещество является компонентом ракетного топлива, его использовали для двигателя первого в мире советского реактивного самолёта БИ – 1.
- Это вещество в смеси с соляной кислотой растворяет платину и золото, признанное «царём» металлов. Сама смесь, состоящая из 1-ого объёма этого вещества и 3-ёх объёмов соляной кислоты, называется «царской водкой».