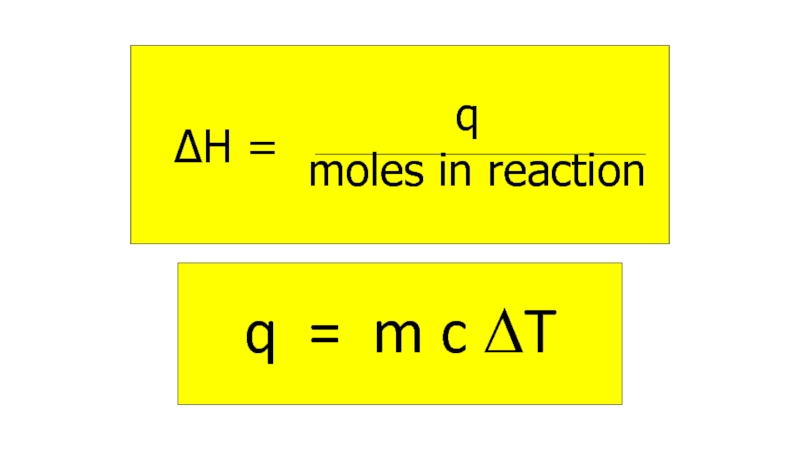Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Энергетика
Содержание
- 1. Энергетика
- 2. Қайсысы физикалық, қайсысы химиялық процесс? Physical – PChemical – C
- 3. RustingChemical
- 4. Eating a sweet Chemical
- 5. Crushing a canPhysical
- 6. Cooking an eggChemical
- 7. Breaking a bottlePhysical
- 8. Burning a candle Chemical
- 9. Boiling waterPhysical
- 10. Сабақтың мақсаты: Сабақтың оқу мақсаттары:Сабақтың мақсаттары:Энтальпия мен
- 11. Тілдік мақсаттар: Төмендегі терминдерді ағылшын тілінде қолдану.
- 12. Күтілетін нәтиже:Химиялық реакциялардың энергия өзгерісі арқылы жүретінін
- 13. Химиялық реакциядағы - энергетикаХимиялық процестер жүрген кезде
- 14. ТермодинамикаБірінші заңы
- 15. Энтальпия қысым тұрақты болған жағдайдағы (изобаралық
- 16. Энтальпия – қысым тұрақты болған жағдайдағы (изобаралық
- 17. ӘдісіҚажетті реактивтерді жинап, қорғаныш көзілдірігін кию;Пробиркаға 1
- 18. Бірнеше экзотермиялық және эндотермиялық реакцияларды білу керек!!!Экзотермиялық және эндотермиялық реакциялар
- 19. Экзотермиялық реакция кезінде жүйенің энтальпиясы азаяды.Эндотермиялық реакция кезінде жүйенің энтальпиясы артады.
- 20. Келесі реакциялардың қайсысы экзотермиялық, эндотермиялықExothermic – ExoEndothermic – Endo
- 21. Nuclear FissionExothermic
- 22. Cooking an eggEndothermic
- 23. Burning a candle Exothermic
- 24. RustingExothermic
- 25. PhotosynthesisEndothermic
- 26. Термохимиялық есептеулерге қолайлы болу үшін, барлық химиялық
- 27. H2O стандартты жағдайдағы күйі қандай?
- 28. Судың қатты және газ күйі- стандартты жағдайға сәйкес келмейді.
- 29. Стандартты жағдайда судың күйі H2O сұйық.
- 30. Неліктен стандартты? Энтальпияның өзгеруі жағдайға
- 31. Стандартты түзілу энтальпиясыАнықтамасы Жай заттардан
- 32. H Түзілу энтальпиясы H2O(l) H2(g) + 1/2 O2(g) →
- 33. H formationHf кез-келген элемент үшін стандартты жағдайда = 0 H2(г) H2(г) → H2(г) C(қ) C(қ) → C (қ)
- 34. Анықтамасы: Стандартты жағдайда 1 моль заттың толық
- 35. H combustion H2(g) H2(g) + 1/2 O2(g) → H2O(l) CH4(g) CH4(g)
- 36. Анықтамасы Стандартты жағдайда 1 моль
- 37. Анықтамасы Сұйытылған ерітіндегі иондардан судың
- 38. Анықтамасы Газтәрізді атомдарды түзу
- 39. Орташа мәні H-H 436
- 40. “Энтальпия өзгерісі оның жүру жолына тәуелді
- 41. «Энтальпия өзгерісі оның жүру жолына тәуелді
- 42. «Энтальпия өзгерісі оның жүру жолына тәуелді
- 43. “TYPE 1” CALCULATIONSH = [Sum Hf products]
- 44. “TYPE 1” CALCULATIONSH = [Sum Hf products]
- 45. “TYPE 2” CALCULATIONS1) Calculate the enthalpy of formation
- 46. “TYPE 2” CALCULATIONS2) Calculate the enthalpy change for
- 47. “TYPE 2” CALCULATIONS2) Calculate the enthalpy change for
- 48. 1) b) Calculate the enthalpy change for this
- 49. 1) c) Calculate the enthalpy change for this
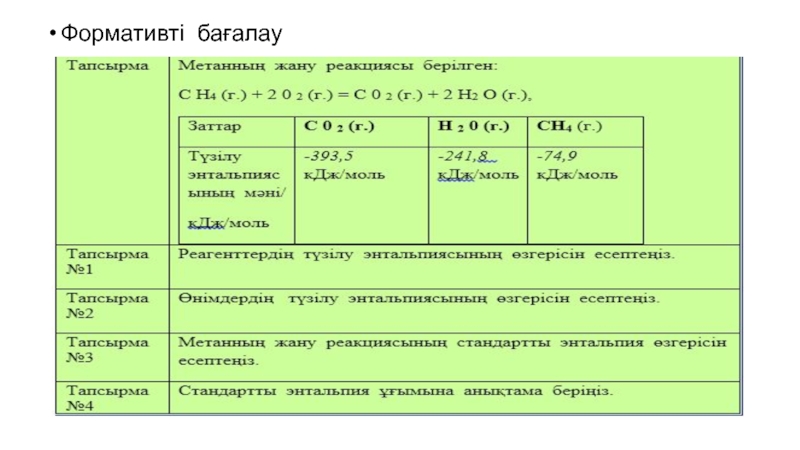
- 50. Байланыстың үзілуі мен түзілуі кезіндегі энергияның тасымалдануыЭкзотермиялық
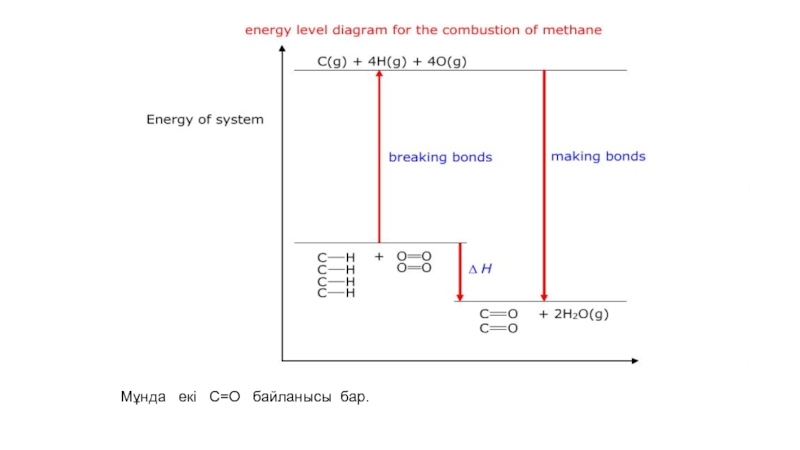
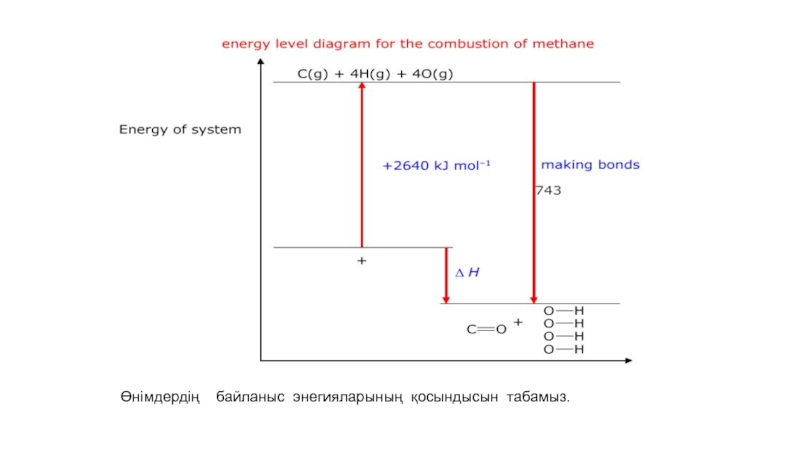
- 51. Мұнда екі C=O байланысы бар.
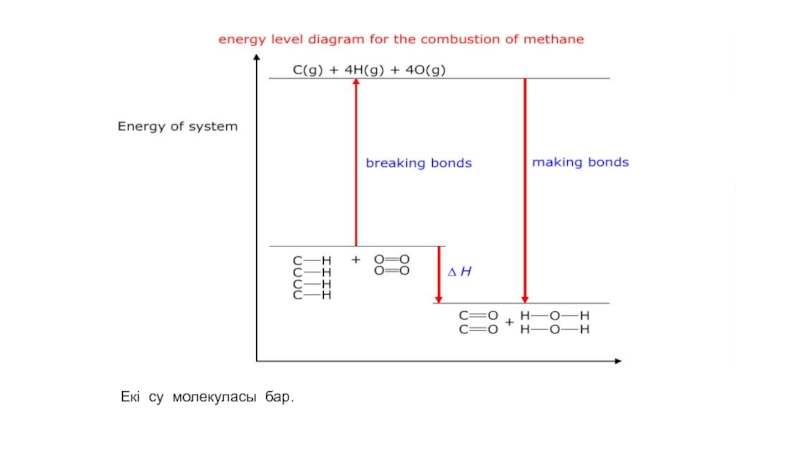
- 52. Екі су молекуласы бар.
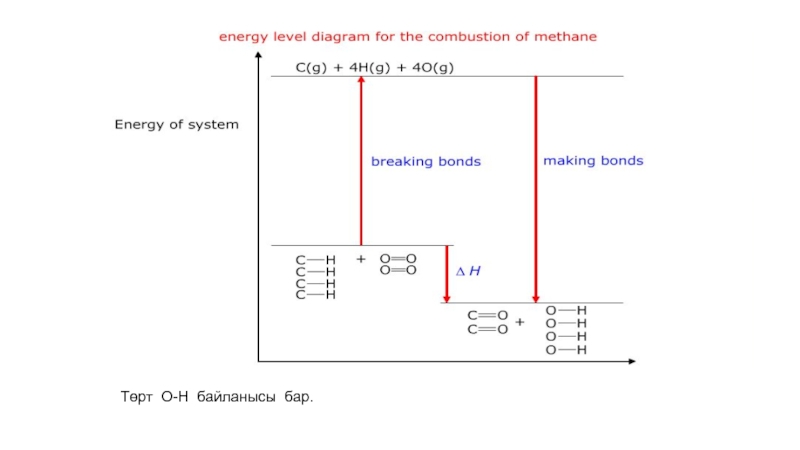
- 53. Төрт О-Н байланысы бар.
- 54. Өнімдердің байланыс энегияларының қосындысын табамыз.
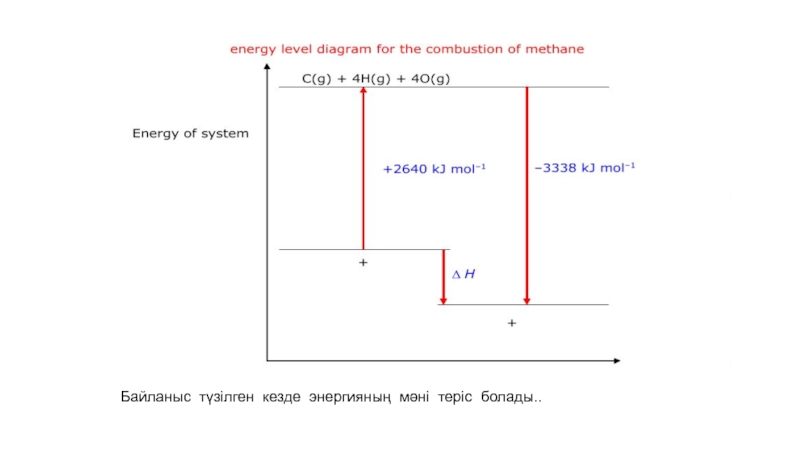
- 55. Байланыс түзілген кезде энергияның мәні теріс болады..
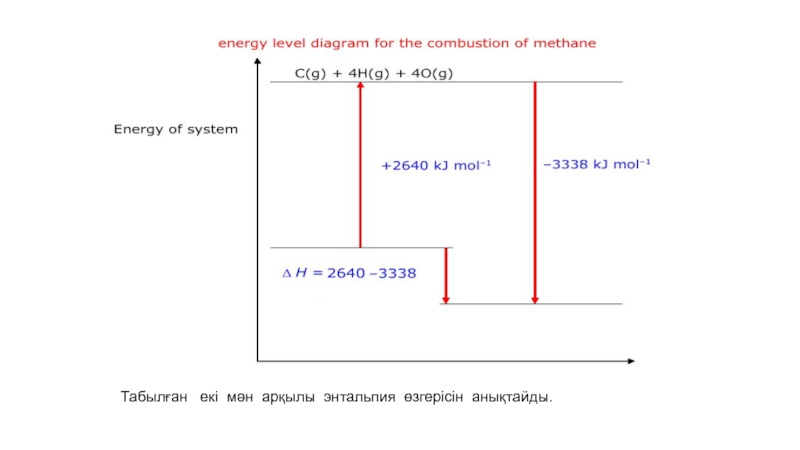
- 56. Табылған екі мән арқылы энтальпия өзгерісін анықтайды.
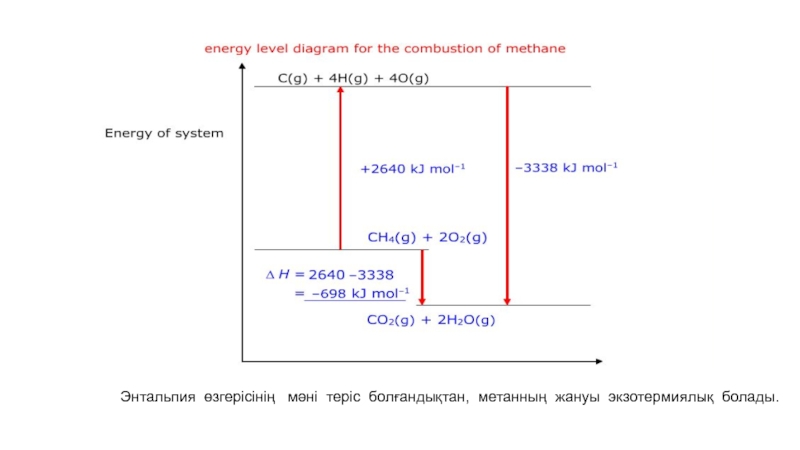
- 57. Энтальпия өзгерісінің мәні теріс болғандықтан, метанның жануы экзотермиялық болады.
- 58. CALORIMETRY
- 59. Калориметрия энтальпия өзгерісін практикалық анықтау
- 60. Слайд 60
- 61. 1 g of water Energy required =
- 62. 1 g of water Energy required =
- 63. 1 g of water Energy required =
- 64. 1 g of copper Energy required =
- 65. Energy required (q) =mass heated (m) x
- 66. Energy required (q) =specifc heat capacity (c)mass heated (m) x x temperature rise (∆T)
- 67. 2 moles of ethanol burned Energy given
- 68. 25 cm3 of 2.0 mol dm-3 азот
- 69. 50 cm3 of 1.0 mol dm-3 nitric
- 70. 100 cm3 of 0.20 mol dm-3 copper
- 71. 25 cm3 of 1.00 mol dm-3 copper
- 72. 50 cm3 of 0.10 mol dm-3 silver
- 73. Энтальпия өзгерісін практикада анықтауЭнтальпия өзгеруін (жылу эффект)
- 74. Практикалық жұмыс Калориметрия
- 75. Слайд 75
- 76. Практикалық жұмыс - КалориметрияМақсаты: калориметрдегі реакция кезіндегі
- 77. Практикалық жұмыс - КалориметрияӘдісі: Мырыш сульфатының 3
- 78. Практикалық жұмыс - КалориметрияТәжірибе мәліметтері: Ескерту: 10
- 79. График тұрғызу:Уақыт пен температураның тәуелділік графигі
- 80. Қателікті есептеу жолдары:1.Apparatus Errors Apparatus error for
- 81. 2. Experimental ErrorExperimental error = 100 x
- 82. Формативті бағалау
- 83. Формативті бағалау
- 84. Формативті бағалау
- 85. Формативті бағалау
- 86. Формативті бағалау
- 87. Формативті бағалау
- 88. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Шымкент қаласы физика - математика бағытындағы
Назарбаев Зияткерлік мектебі.
11.2В Энергетика
Энтальпия
өзгерісі
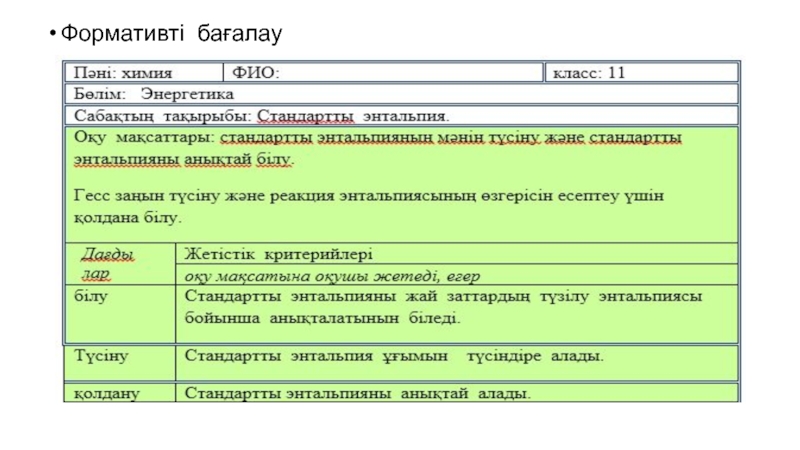
Слайд 10Сабақтың мақсаты:
Сабақтың оқу мақсаттары:
Сабақтың мақсаттары:
Энтальпия мен энтальпия өзгерісін түсіне
отырып, есептей алу;
Энтальпия өзгерісін калориметриялық тәсілмен анықтай алу;
Барлық оқушылар мынаны
жасай білулері керек: Энтальпияның өзгерісін түсінеді және энтальпия өзгерісінің стандартты жағдайда есептелетінін біледі; Көптеген оқушылар мынаны жасай алулары керек: Гесс заңы бойынша түзілу және жану энтальпиялары берілсе, реакцияның энтальпиясы өзгерісін есептей алады;
Кейбір оқушылар мынаны жасай алулары керек: Реакцияның энтальпия өзгерісін калориметриялық әдіспен практикада анықтаудың мәнін түсіндіре алады.
Слайд 12Күтілетін нәтиже:
Химиялық реакциялардың энергия өзгерісі арқылы жүретінін біледі.
Энтальпияның стандартты жағдайда
анықталатынын біледі және Гесс заңын қолданып оны есептей алады
Тәжірибе мәліметтері
арқылы энтальпия өзгерісін өлшеуге болатын калориметриялық әдістің мәнін түсіне отырып, практикада энтальпия өзгерісін анықтай алады.Слайд 13Химиялық реакциядағы - энергетика
Химиялық процестер жүрген кезде - бір зат
екінші затқа айналғанда - энергетикалық өзгерістер болады, яғни энергия
(
жылу) не сіңіріледі , не бөлінеді, себебі реакцияға түскен заттардағы байланыстар үзіліп , реакция нәтижесінде түзілген заттарда жаңа байланыстар түзіледі. Химиялық өзгерістер нәтижесінде атомдардың, иондардың, молекулалардың құрылысы өзгертіліп, құрылуымен қатар жылу, жарық, электр энергиясы бөлінеді, яғни химиялық энергия басқа энергия түріне айналады. Химиялық процестердің жылу эффектілерін термохимия оқытады. Термохимиялық теңдеулерде жылу эффектісі көрсетіледі. Реакция кезінде жылу бөлінсе , экзотермиялық (+) , жылу ( энергия) сіңірілсе – эндотермиялық () реакциялар деп аталады. Химиялық реакциялардың жылу эффектілерін калориметрде өлшейді. Слайд 14Термодинамика
Бірінші заңы Энергия жоғалып
кетпейді немесе жаңадан пайда
болмайды, энергия бір түрден екінші бір түрге ауысады.Энергияның барлық химиялық реакциялар энергияның өзгеруі арқылы жүреді, бірақ кейбірінің өзгерісі білінбеуі мүмкін
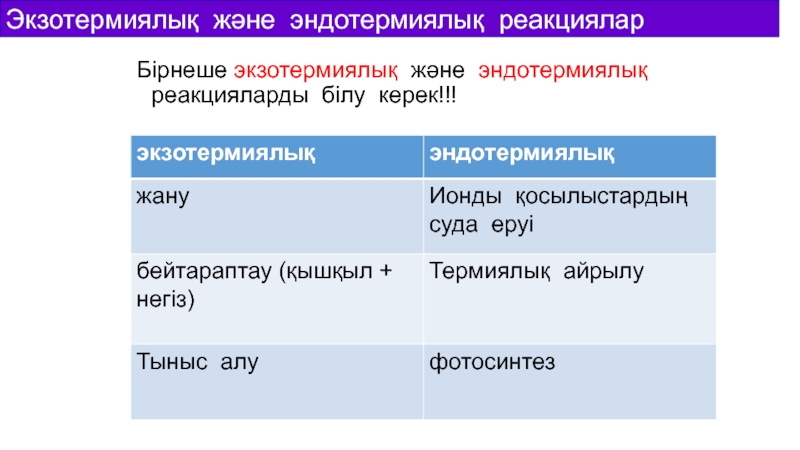
Экзотермиялық Энергия сыртқа беріледі.
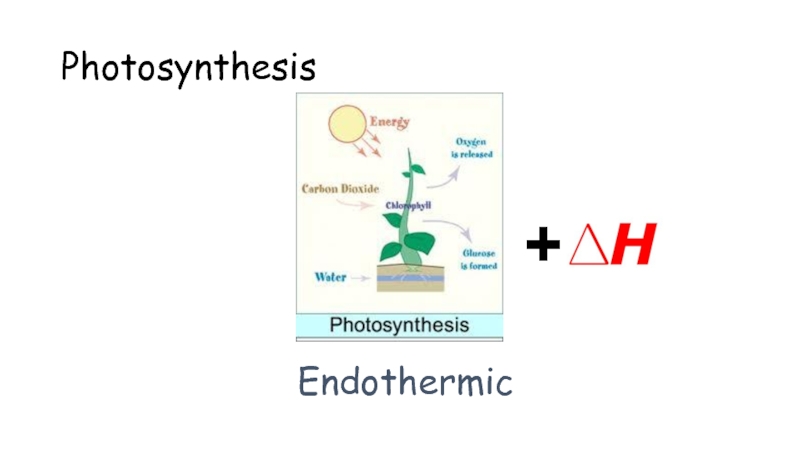
Эндотермиялық Энергия сіңіріледі.
Мысалы Экзотермиялық отынның жануы
тыныс алу (көмірсулардың тотығуы)
Эндотермиялық фотосинтез
кальций карбонатының термиялық
айрылуы
Слайд 15Энтальпия қысым тұрақты болған жағдайдағы (изобаралық процесс
кезіндегі) жылу эффектісі.Алайда, энтальпияның абсолют мәнін өлшемейді, тек өзгерісін
анықтайды (ΔН).ΔН = ΣΔН0өнім. - ΣΔН0реаг.
реагенттердің энтальпиясы > өнімдердің
DH = - мәнді
Экзотермиялық жылу сыртқа беріледі
Tермодинамика – Энтальпия өзгерісі
Слайд 16Энтальпия – қысым тұрақты болған жағдайдағы (изобаралық процесс кезіндегі)
жылу эффектісі.Алайда, энтальпияның абсолют мәнін өлшемейді, тек өзгерісін анықтайды (ΔН).
ΔН
= ΣΔН0өнім. - ΣΔН0реаг. ENTHALPY
REACTION CO-ORDINATE
Энтальпия реагенттер > өнімдер Энтальпия реагенттер < өнімдер
DH = - мәнді DH = + мәнді
Экзотермиялық Жылу бөледі Эндотермиялық Жылу сіңіреді
Tермодинамика – Энтальпия өзгерісі
Слайд 17Әдісі
Қажетті реактивтерді жинап, қорғаныш көзілдірігін кию;
Пробиркаға 1 реагентті құйып- температурасын
өлшеңіз;
Үстіне 2 реагентті құйып температура өзгерісін өлшеңіз;
Реакцияның экзотермиялық немесе
эндотермиялық екенін белгілеңіз.Эксперимент
Слайд 18Бірнеше экзотермиялық және эндотермиялық реакцияларды білу керек!!!
Экзотермиялық және эндотермиялық реакциялар
Слайд 19Экзотермиялық реакция кезінде жүйенің энтальпиясы азаяды.
Эндотермиялық реакция кезінде жүйенің энтальпиясы
артады.
Слайд 26Термохимиялық есептеулерге қолайлы болу үшін, барлық химиялық қосылыстардың түзілу энтальпияларын
бірдей жағдайға келтіреді. Температура 2980К, қысым 1 атм жағдайда тұрақты
болатын химиялық қосылыстардың түзілу энтальпияларын олардың стандартты түзілу энтальпиясы деп аталады және оларды ΔН0298 таңбасымен белгілейді. Стандартты жағдайда тұрақты болатын жай заттардың түзілу энтальпиялары (мысалы: О2 (газ), N2 (газ), Br2(сұйық) т.б.) нольге тең деп қабылданған.Стандартты түзілу энтальпиясы
Слайд 30Неліктен стандартты? Энтальпияның өзгеруі жағдайға тәуелді болады. Заттардың
мұндай жағдайы стандартты деп аталады.
Қысым:
100 kPa (1 атмосфера)Температураның жағдайы әдетте 298K (25°C)
• қалыпты лабораториялық жағдайда заттың күйін негізге алу керек.
• Заттардың әрқайсысының стандартты жағдайдағы күйін [(г), (с) or (қ) ] белгілеу керек.
• кез келген ерітінді концентрациясы 1 моль дм-3
• егер стандартты жағдай қолданылса DH белгіленуін өзгереді.
Энтальпия өзгерісі Стандартты энтальпия өзгерісі
( 298K)
Стандартты энтальпияның өзгерісі
Слайд 31Стандартты түзілу энтальпиясы
Анықтамасы Жай заттардан стандартты жағдайда химиялық
қосылыстың стандартты жағдайдағы 1 молі түзілгенде бөлінетін немесе сіңіретін жылудың
мөлшерін сол заттың түзілу энтальпиясы дейді.Белгіленуі DH°f
Мәні Көбінесе экзотермиялық
Мысалы(s) C(graphite) + O2(g) ———> CO2(g)
H2(g) + ½O2(g) ———> H2O(l)
2C(graphite) + ½O2(g) + 3H2(g) ———> C2H5OH(l)
Ескерту реакция нәтижесінде 1 моль заттың түзілуіне қарай реакцияны
теңестіреміз. Стандартты жағдайдағы элементтердің түзілу энтальпиясы нольге тең.Көміртегі графит аллотропиясы түрінде алынады.
Слайд 32H Түзілу энтальпиясы
H2O(l)
H2(g) + 1/2 O2(g) → H2O(l)
CH4(g)
C(s) + 2
H2(g) → CH4(g)
NH3(g)
1/2 N2(g) + 3/2 H2(g) → NH3(g)
C2H5OH(l)
2 C(s)
+ 3 H2(g) + 1/2 O2(g) → C2H5OH(l)CH3Br(l)
C(s) + 3/2 H2(g) + 1/2 Br2(l) → CH3Br(l)
Na2O(s)
2 Na(s) + 1/2 O2(g) → Na2O(s)
Анықтамасы Жай заттардан стандартты жағдайда химиялық қосылыстың стандартты жағдайдағы 1 молі түзілгенде бөлінетін немесе сіңіретін жылудың мөлшерін сол заттың түзілу энтальпиясы дейді.
Слайд 33H formation
Hf кез-келген элемент үшін стандартты жағдайда = 0
H2(г)
H2(г)
→ H2(г)
C(қ)
C(қ) → C (қ)
Слайд 34Анықтамасы: Стандартты жағдайда 1 моль заттың толық жануы.Барлық реагенттер мен
өнімдер стандартты жағдайда
Белгіленуі DH°c
Values
Әрқашан экзотермиялықМысалдар C(graphite) + O2(g) ———> CO2(g)
H2(g) + ½O2(g) ———> H2O(l)
C2H5OH(l) + 3O2(g) ———> 2CO2(g) + 3H2O(l)
Ескерту Әруақытта бір моль заттың жануын реакцияны теңестіргенде есте сақтау керек.
СТАНДАРТТЫ ЖАНУ ЭНТАЛЬПИЯСЫ
Слайд 35H combustion
H2(g)
H2(g) + 1/2 O2(g) → H2O(l)
CH4(g)
CH4(g) + 2 O2(g)
→ CO2(g) + 2 H2O(l)
C2H6(g)
C2H6(g) + 7/2 O2(g) → 2
CO2(g) + 3 H2O(l)C2H5OH(l)
C2H5OH(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l)
C6H14(l)
C6H14(l) + 91/2 O2(g) → 6 CO2(g) + 7 H2O(l)
Na(s)
Na(s) + 1/4 O2(g) → 1/2 Na2O(s)
Анықтамасы: Стандартты жағдайда 1 моль заттың толық жануы.Барлық реагенттер мен өнімдер стандартты жағдайда
Слайд 36Анықтамасы Стандартты жағдайда 1 моль газ күйіндегі атомдардың
элемент түзу кезіндегі энтальпияның өзгерісі
Белгіленуі DH°at
Мәні
Әрқашан эндотермиялық – атомдарды бөлу үшін энергия жұмсаладыМысалы C(graphite) ———> C(g)
СТАНДАРТТЫ АТОМДАНУ ЭНТАЛЬПИЯСЫ
Слайд 37Анықтамасы Сұйытылған ерітіндегі иондардан судың 1 молі түзілгенде
энтальпияның өзгерісі
Мәні Экзотермиялық
Теңдеуі H+(aq)
+ OH¯(aq) ———> H2O(l)Ескерту күшті қышқыл мен күшті негіз реакциясында энтальпия өзгерісі -57kJ mol-1
БЕЙТАРАПТАНУ ЭНТАЛЬПИЯСЫ
Слайд 38Анықтамасы Газтәрізді атомдарды түзу үшін 1 моль
газдағы байланысты үзуге жұмсалатын энергия
Мәні Эндотермиялық -
кез-келген химиялық байланысты үзу үшін энергия керек.Мысалы Cl2(g) ———> 2Cl(g) O-H(g) ———> O(g) + H(g)
Ескерту • байланыстың күші қоршаған ортаға да байланысты, оның мәні
• байланысты түзу экзотермиялық болса, керісінше байланысты үзу эндотермиялық
• екі атомды газдар үшін, байланыс энтальпиясы = 2 x атомдану энтальпиясы
• аз байланыс энтальпиясы = әлсіз байланыс = үзу оңай
БАЙЛАНЫСТЫҢ ДИССОЦИАЦИЯЛАНУ ЭНТАЛЬПИЯСЫ
Слайд 39
Орташа мәні H-H 436 H-F 562
N-N 163
C-C
346 H-Cl 431 N=N 409C=C 611 H-Br 366 NN 944
CC 837 H-I 299 P-P 172
C-O 360 H-N 388 F-F 158
C=O 743 H-O 463 Cl-Cl 242
C-H 413 H-S 338 Br-Br 193
C-N 305 H-Si 318 I-I 151
C-F 484 P-H 322 S-S 264
C-Cl 338 O-O 146 Si-Si 176
Орташа мәндер берілген себебі, нақты мәндер молекула кездесетін ортаға, тәуелді.
Өлшем бірлігі = kДж мol-1
БАЙЛАНЫСТЫҢ ДИССОЦИАЦИЯЛАНУ ЭНТАЛЬПИЯСЫ
Слайд 40“Энтальпия өзгерісі оның жүру жолына тәуелді емес”
Қалай
А дан В өтудегі энтальпия өзгерісін А дан Х-ке
, Х-тен Y - ке жәнеY тен В-ға өту энтальпияларын
қосу арқылы табуға болады.
DHr = DH1 + DH2 + DH3
ГЕСС ЗАҢЫ
Слайд 41«Энтальпия өзгерісі оның жүру жолына тәуелді емес»
Қалай
А дан В өтудегі энтальпия өзгерісін
А дан Х-ке , Х-тен Y - ке және Y тен В-ға өту энтальпияларын
қосу арқылы табуға болады.
Егер кері бағыттағы реакция болатын болса,
онда энтальпия өзгерісін азайту керек.
.
e.g. DH2 = - DH1 + DHr - DH3
реакцияның жүру бағытына қарай DH1 және DH3 мәндері азайтылды.
ГЕСС ЗАҢЫ
Слайд 42«Энтальпия өзгерісі оның жүру жолына тәуелді емес»
Қолданылуы Гесс заңын қолдану
энтальпия өзгерісімен қатар...
Тор энтальпиясы сияқты өлшеуге
келмейтін өзгерістерді есептеугеБайланыс энтальпиясы бойынша реакцияның энтальпия өзгерісін есептеуде
Жану энтальпиясы арқылы DH°c энтальпия өзгерісін есептеуде
Түзілу энтальпиясы арқылы DH°f энтальпия өзгерісін есептеуде
ГЕСС ЗАҢЫ
Слайд 43“TYPE 1” CALCULATIONS
H = [Sum Hf products] – [Sum Hf
reactants]
When you know Hf of all reactants & products.
1a
ZnCO3(s) → ZnO(s) + CO2(g)
H = [-348 - 393] – [-812]
= + 71 kJ mol-1
Слайд 44“TYPE 1” CALCULATIONS
H = [Sum Hf products] – [Sum Hf
reactants]
When you know Hf of all reactants & products.
1b
2 CO (g) + O2(g) → 2 CO2(g)
H = [2(-393)] – [2(-111) + 0]
= – 564 kJ mol-1
Слайд 45“TYPE 2” CALCULATIONS
1) Calculate the enthalpy of formation of ethanol (C2H5OH)
given the following enthalpies of combustion.
Hc: C(s) -393;
H2(g) -286; C2H5OH(l) -1371 kJ mol-1
H = [Sum Hc reactants] – [Sum Hc products]
H = [2(-393) + 3(-286)] – [-1371]
= -273 kJ mol-1
2 C(s) + 3 H2(g) + ½ O2(g) C2H5OH(l)
Слайд 46“TYPE 2” CALCULATIONS
2) Calculate the enthalpy change for this reaction given
the following enthalpies of combustion.
C(s) + 2 H2(g) CH4(g)Hc: C(s) -393; H2(g) -286; CH4(g) -890 kJ mol-1
H = [Sum Hc reactants] – [Sum Hc products]
H = [-393 + 2(-286)] – [-890]
= -75 kJ mol-1
Слайд 47“TYPE 2” CALCULATIONS
2) Calculate the enthalpy change for this reaction given
the following enthalpies of combustion.
C(s) + 2 H2(g) CH4(g)Hc: C(s) -393; H2(g) -286; CH4(g) -890 kJ mol-1
H = [Sum Hc reactants] – [Sum Hc products]
H = [-393 + 2(-286)] – [-890]
= -75 kJ mol-1
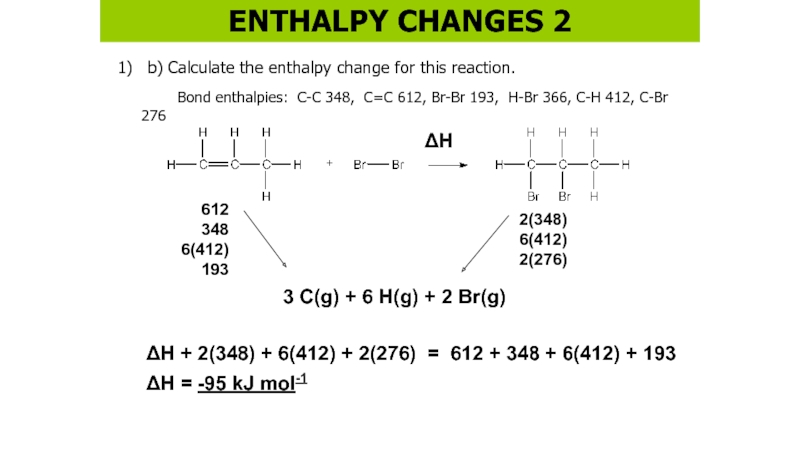
Слайд 481) b) Calculate the enthalpy change for this reaction.
Bond enthalpies:
C-C 348, C=C 612, Br-Br 193, H-Br 366, C-H 412,
C-Br 2763 C(g) + 6 H(g) + 2 Br(g)
H
612
348
6(412)
193
H + 2(348) + 6(412) + 2(276) = 612 + 348 + 6(412) + 193
H = -95 kJ mol-1
2(348)
6(412)
2(276)
ENTHALPY CHANGES 2
Слайд 491) c) Calculate the enthalpy change for this reaction.
Bond enthalpies:
C=C 612, C-H 412, O=O 496, C=O 743, O-H 463
2
C(g) + 4 H(g) + 6 O(g)H
612
4(412)
3(496)
H + 4(743) + 4(463) = 612 + 4(412) + 3(496)
H = -1076 kJ mol-1
4(743)
4(463)
ENTHALPY CHANGES 2
Слайд 50Байланыстың үзілуі мен түзілуі кезіндегі энергияның тасымалдануы
Экзотермиялық реакция кезінде энергия
сыртқа бөлінеді.
Эндотермиялық реакцияда энергия ішке беріледі.
Химиялық реакция кезінде энергия
өзгерісі орын алады,Өйткені химиялық байланыс үзілуі мен түзілуі кезінде
энергия үнемі тасымалданады.
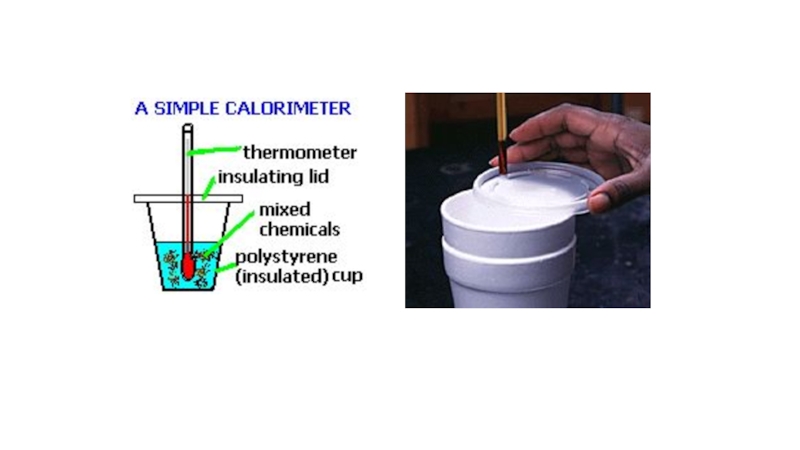
Слайд 59Калориметрия энтальпия өзгерісін практикалық анықтау
болатын әдіс
Әдетте судың қызуы мен сууына байланысты
өлшенеді
судың реакцияда қызуы экзотермиялық
судың реакцияда салқындауы эндотермиялық
болады.
Есептеу заттың температурасын өзгертуге кеткен
энергияны есептеуге болады q = m x c x DT
мұндағы q = жылу энергиясы кДж
m= масса kг
c= меншікті жылу сыйымдылығы kДж K -1 kг-1
[ су 4.18 ]
DT= температура өзгерісі K
Энтальпия өзгерісін өлшеу.
Слайд 611 g of water
Energy required =
4.18 J
1 ºC hotter
= 8.36 J
1 g of water
Energy
required =
2 x 4.18 J
2 ºC hotter
Слайд 621 g of water
Energy required =
4.18 J
1 ºC hotter
= 20.9 J
5 g of water
Energy
required =
5 x 4.18 J
1 ºC hotter
Слайд 631 g of water
Energy required =
4.18 J
1 ºC hotter
= 125.4 J
3 g of water
Energy
required =
3 x 10 x 4.18
10 ºC hotter
Слайд 641 g of copper
Energy required =
0.39 J
1 ºC hotter
= 19.5 J
10 g of copper
Energy
required =
10 x 5 x 0.39
5 ºC hotter
Слайд 65Energy required (q) =
mass heated (m)
x
energy needed to
make 1 g of substance 1ºC hotter
x
temperature rise (∆T)
Слайд 672 moles of ethanol burned
Energy given out =
2734 kJ
Energy given out by 1 mole =
2734 kJ
2
= 1367 kJ
∆H =
–1367 kJ mol-1
Слайд 6825 cm3 of 2.0 mol dm-3 азот қышқылына 25 cm3
of 2.0 mol dm-3 калий гидроксиді ерітіндісі қосылды. Температура
13.7C-ге өсті. Бейтараптану реакциясының энтальпия өзгерісін есепте. Ерітіндінің тығыздығы 1.00 g cm-3, ерітіндінің меншікті жылу сиымдылығы 4.18 Дж г-1 K-1.q = mc∆T
m = 50
q = 50 x 4.18 x 13.7 = 2863 J
∆H = q /n
n HNO3 = с x V
∆H = –2.863 / 0.050
∆T = 13.7
c = 4.18
= -57.26 kДж мoль-1
= 2.0 x 25/1000 = 0.050
n KOH = c x V
= 2.0 x 25/1000 = 0.050
HNO3 + KOH → NaNO3 + H2O
Слайд 69 50 cm3 of 1.0 mol dm-3 nitric acid was added
to 20 cm3 of 1.0 mol dm-3 barium hydroxide solution.
The temperature rose by 7.9C. Calculate the enthalpy of neutralisation for this reaction (per mole of nitric acid reacting). Assume that the density of the solution is 1.00 g cm-3, the specific heat capacity of the solution is 4.18 J g-1 K-1.q = mc∆T
m = 70
q = 70 x 4.18 x 7.9 = 2312 J
∆H = q / mol
Mol HNO3 = conc x vol
∆H = –2.312 / 0.020
∆T = 7.9
c = 4.18
= -115,6 kJ mol-1
= 1.0 x 50/1000 = 0.050
Mol Ba(OH)2 = conc x vol
= 1.0 x 20/1000 = 0.020
2 HNO3 + Ba(OH)2 → Ba(NO3)2 + 2 H2O
XS
Слайд 70 100 cm3 of 0.20 mol dm-3 copper sulphate solution was
put in a calorimeter and 2.0 g of magnesium powder
added. The temperature of the solution rose by 25.1C. Work out which reagent was in excess and then calculate the enthalpy change for the reaction. Assume that the density of the solution is 1.00 g cm-3, the specific heat capacity of the solution is 4.18 J g-1 K-1. Ignore the heat capacity of the metals.q = mc∆T
m = 100
q = 100 x 4.18 x 25.1 = 10490 J
∆H = q / mol
Mol CuSO4 = conc x vol
∆H = –10.49 / 0.020
∆T = 25.1
c = 4.18
= -525 kJ mol-1
= 0.20 x 100/1000 = 0.020
Mol Mg = mass / Mr
= 2.0 / 24.3 = 0.0823
CuSO4 + Mg → MgSO4 + Cu
XS
Слайд 71 25 cm3 of 1.00 mol dm-3 copper sulphate solution was
put in a calorimeter and 6.0 g of zinc powder
added. The temperature of the solution rose by 50.6C. Work out which reagent was in excess and then calculate the enthalpy change for the reaction. Assume that the density of the solution is 1.00 g cm-3, the specific heat capacity of the solution is 4.18 J g-1 K-1. Ignore the heat capacity of the metals.q = mc∆T
m = 25
q = 25 x 4.18 x 50.6 = 5288 J
∆H = q / mol
Mol CuSO4 = conc x vol
∆H = –5.288 / 0.025
∆T = 50.6
c = 4.18
= -212 kJ mol-1 (3 sig fig)
= 1.0 x 25/1000 = 0.025
Mol Zn = mass / Mr
= 6.0 / 65.4 = 0.0917
CuSO4 + Zn → ZnSO4 + Cu
XS
Слайд 72 50 cm3 of 0.10 mol dm-3 silver nitrate solution was
put in a calorimeter and 0.2 g of zinc powder
added. The temperature of the solution rose by 4.3C. Work out which reagent was in excess and then calculate the enthalpy change for the reaction (per mole of zinc that reacts). Assume that the density of the solution is 1.00 g cm-3, the specific heat capacity of the solution is 4.18 J g-1 K-1. Ignore the heat capacity of the metals.q = mc∆T
m = 50
q = 50 x 4.18 x 4.3 = 898.7 J
∆H = q / mol
Mol AgNO3 = conc x vol
∆H = –0.8987 / 0.0025
∆T = 4.3
c = 4.18
= -359 kJ mol-1
= 0.1 x 50/1000 = 0.005
Mol Zn = mass / Mr
= 0.2 / 65.4 = 0.00306
2 AgNO3 + Zn → ZnNO3 + 2 Ag
XS
Слайд 73Энтальпия өзгерісін практикада анықтау
Энтальпия өзгеруін (жылу эффект) лабораторияда оңай есептеуге
болады. Мұны көбіне реакция шекарасын қоршап жасайды: бұл кезде энергия
алмасу жүзеге асады. Егер реакция экзотермиялық болса, онда су қызады, ал егер эндотермиялық болса, онда суиды. Егер судың температура өзгеруін өлшесе және су массасы мен оның меншікті жылу сыйымдылығы белгілі болса, бұл жағдайда химиялық реакция кезінде жұтқан немесе бөліп шығарған энергия мөлшерін табуға болады.Мысал ретінде мырыш пен мыс сульфаты арасындағы орын басу реакциясын алуға болады.Слайд 76Практикалық жұмыс - Калориметрия
Мақсаты: калориметрдегі реакция кезіндегі температураның өзгерісі арқылы
энтальпия өзгерісін өлшеу.
Қажетті құрал-жабдықтар:
3г мырыш ұнтағы, мыс сульфатының 0,500моль дм-3
, калориметр,Spark универсал құралы, магнитті араластырғыш,милиметровка қағаз.ҚТЕ
Слайд 77Практикалық жұмыс - Калориметрия
Әдісі:
Мырыш сульфатының 3 грамын өлшеп алыңыз;
Пластик
стаканды тазалап полистиролды табақшаға орналастырыңыз;
Пипеткамен 25 мл 0,500 моль/ дм
3 мыс сульфаты ерітіндісін өлшеп алып, пластик стаканға құйыңыз;Полистиролды табақшаның қақпағын жауып,температура датчигін саңылауына салып, магнитті араластырғышқа орналастырыңыз;
Әрбір 30 секунд сайын температура көрсеткішін жазып отыру;
Тура 3 минуттан кейін мырыш ұнтағын саңылаудағы сүзгіш арқылы салыңыз.
Температура өзгерісін әрбір 30 секунд сайын жазып, осылайша 10 минут бақылау керек.
Слайд 78Практикалық жұмыс - Калориметрия
Тәжірибе мәліметтері:
Ескерту: 10 минут бойында температура
өзгерісін бақылайды.Мұнда кестеде тек 4,5 минутқа құрылған.
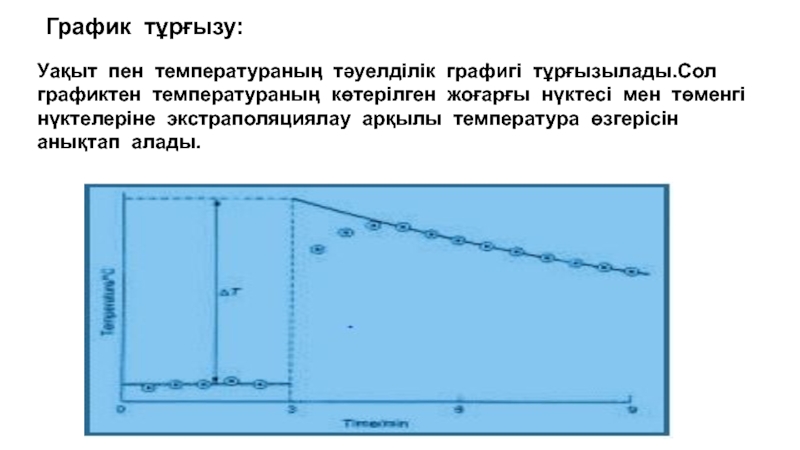
Слайд 79 График тұрғызу:
Уақыт пен температураның тәуелділік графигі тұрғызылады.Сол графиктен температураның
көтерілген жоғарғы нүктесі мен төменгі нүктелеріне экстраполяциялау арқылы температура өзгерісін
анықтап алады.Слайд 80Қателікті есептеу жолдары:
1.Apparatus Errors
Apparatus error for each piece of
equipment = 100 x margin of error
quantity measured For example, imagine a pupil doing an experiment where she measured out 1.245 g of a base, make it up to 250 cm3 of solution in a volumetric flask, pipetted 25 cm3 of that solution into a conical flask, and then found that it reacted with 23.30 cm3 of acid in a titration using a burette.
Balance (± 0.001 g) 100 x (0.001/1.245) = 0.08%
Pipette (± 0.1 cm3 ) 100 x (0.1/25) = 0.40%
Volumetric flask (± 0.1 cm3) 100 x (0.1/250) = 0.04%
Burette (± 0.15 cm3) 100 x (0.15/23.30) = 0.64%
Total apparatus error = 1.16% (uncertainty)
Слайд 812. Experimental Error
Experimental error = 100 x (real answer –
experiment answer)
real answerIf experimental error is smaller than apparatus error, then you have an accurate result. However, if experimental error is larger than apparatus error, then the result is inaccurate.
For example, imagine in the experiment above that the acid concentration was being measured and was found to be 0.0995 moldm-3 compared to the real value of 0.101 mol dm-3
.
Experimental error = 100 x (0.101 – 0.0995) = 1.49%
0.101
The experimental error (1.49%) is greater than the apparatus error (1.16%) meaning that the results are inaccurate.








































![Энергетика “TYPE 1” CALCULATIONSH = [Sum Hf products] – [Sum Hf reactants] When “TYPE 1” CALCULATIONSH = [Sum Hf products] – [Sum Hf reactants] When you know Hf of all reactants](/img/thumbs/8dd75bbfc7ff751602b2a26396581915-800x.jpg)
![Энергетика “TYPE 1” CALCULATIONSH = [Sum Hf products] – [Sum Hf reactants] When “TYPE 1” CALCULATIONSH = [Sum Hf products] – [Sum Hf reactants] When you know Hf of all reactants](/img/thumbs/91ee5dd4bce4553d4e8481b94c9656c7-800x.jpg)