Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Галогены
Содержание
- 1. Галогены
- 2. Галогены – элементы VIIА – группы. Галогены
- 3. Строение и свойства атомов.F )2 )7Cl )2
- 4. Строение и свойства атомов.Галогены: фтор F, хлор
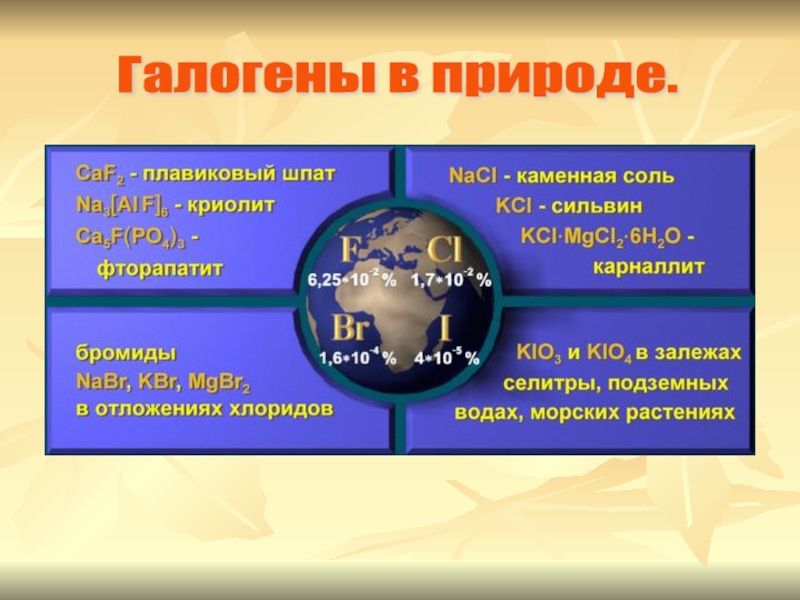
- 5. Галогены в природе.
- 6. Галогены – простые вещества. Все галогены существуют
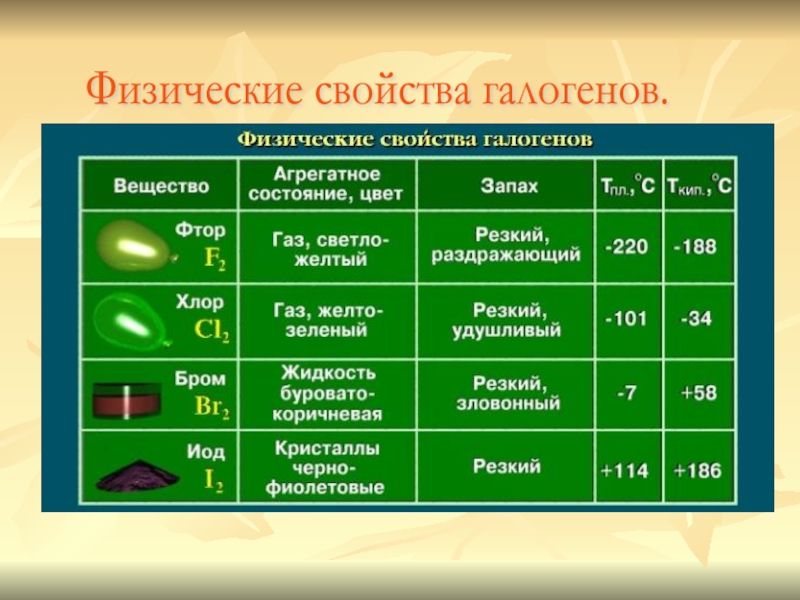
- 7. Физические свойства галогенов.
- 8. Химические свойства галогенов.Взаимодействие с металлами.Zn0 + F20→
- 9. Открытие галогенов.Фтор в свободном виде получил впервые
- 10. Карл Вильгельм Шееле (1742 - 1786)Шведский
- 11. Выводы: При движении по группе сверху вниз:Увеличивается
- 12. Литература http://ru.wikipedia.org/wiki/http://ru.wikipedia.org/wiki/Галоидhttp://www.xumuk.ru/encyklopedia/909.htmlhttp://dic.academic.ru/dic.nsf/enc_colier/483/Учебник «Химия 9класс», О.С.Габриелян, Дрофа, Москва.
- 13. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2
Галогены – элементы VIIА – группы. Галогены – типичные неметаллы.
Общее название подгруппы «галогены», т.е. «рождающие соли».
Галогены.
Слайд 3
Строение и свойства атомов.
F )2 )7
Cl )2 )8 )7
Br )2
) 8)18 )7
I )2 )8 )18 )18 )7
At )2 )8
)18 ) 32) 18)7Общая формула – ns2np5
Слайд 4Строение и свойства атомов.
Галогены: фтор F, хлор Cl, бром Br,
йод I, астат At (редко встречающийся в природе) – типичные
неметаллы. Их атомы содержат на внешнем энергетическом уровне семь электронов, и им недостает лишь одного электрона, чтобы завершить его. Атомы этих элементов при взаимодействии с металлами принимают электрон от атомов металлов. При этом возникает ионная связь и образуются соли.Галогены – очень сильные окислители. Фтор в химических реакциях проявляет только окислительные свойства, и для него характерна степень окисления -1. Остальные галогены могут проявлять и восстановительные свойства при взаимодействии с более электроотрицательными элементами – фтором, кислородом, азотом, при этом степени их окисления могут принимать значения +1, +3, +5, +7. восстановительные свойства галогенов усиливаются от хлора к йоду, что связано с ростом радиусов их атомов: атомы хлора примерно вдвое меньше, чем у йода.
Слайд 6Галогены – простые вещества.
Все галогены существуют в свободном состоянии
в виде двухатомных молекул с ковалентной неполярной химической связью между
атомами. В твердом состоянии F2, Cl2, Br2, I2 имеют молекулярные кристаллические решетки, что и подтверждается их физическими свойствами.Слайд 8Химические свойства галогенов.
Взаимодействие с металлами.
Zn0 + F20→ Zn+2F2-1
Взаимодействие с водородом.
H2
+ Г2 →2НГ
Взаимодействие с растворами солей.
Cl2 + 2NaBr→ 2NaCl +
Br2Слайд 9Открытие галогенов.
Фтор в свободном виде получил впервые в 1866 г.
Французский химик Анри Муассан, который был удостоен Нобелевской премии. Свое
название элемент получил от греч. фторос – разрушающий. Хлор открыт химиком К. Шееле в 1774 г. Элемент получил название за свой цвет ( от греч. хлорос – желто - зеленый).
Бром открыт в 1826 г. Французским химиком А. Баларом. Элемент назван так за свой запах (греч. бромос – зловонный).
Йод получен в 1811 г. французским ученым Б. Куртуа, а название получил за цвет своих паров (греч. иодэс – фиолетовый).