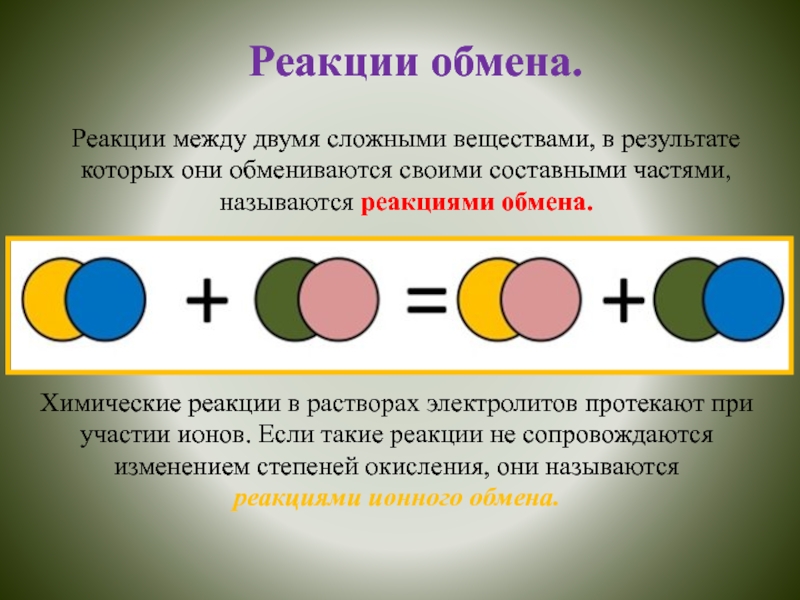
обмениваются своими составными частями, называются реакциями обмена.
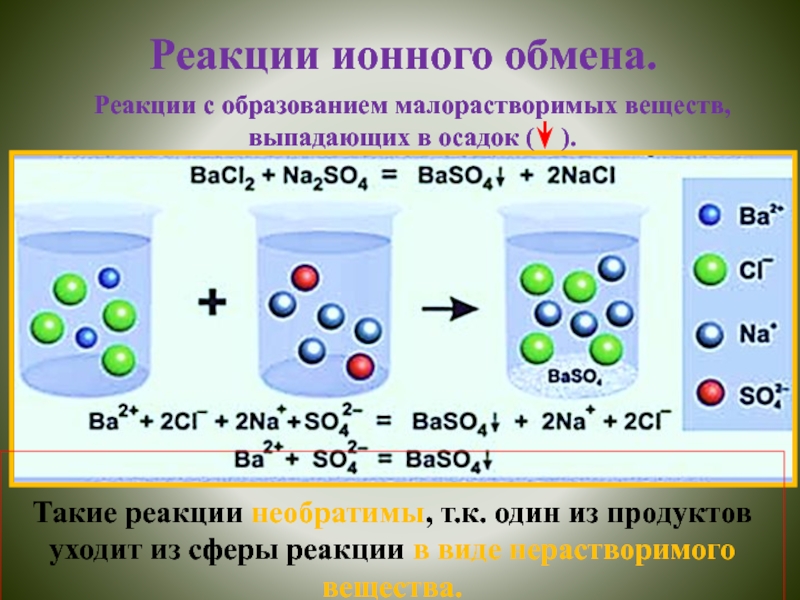
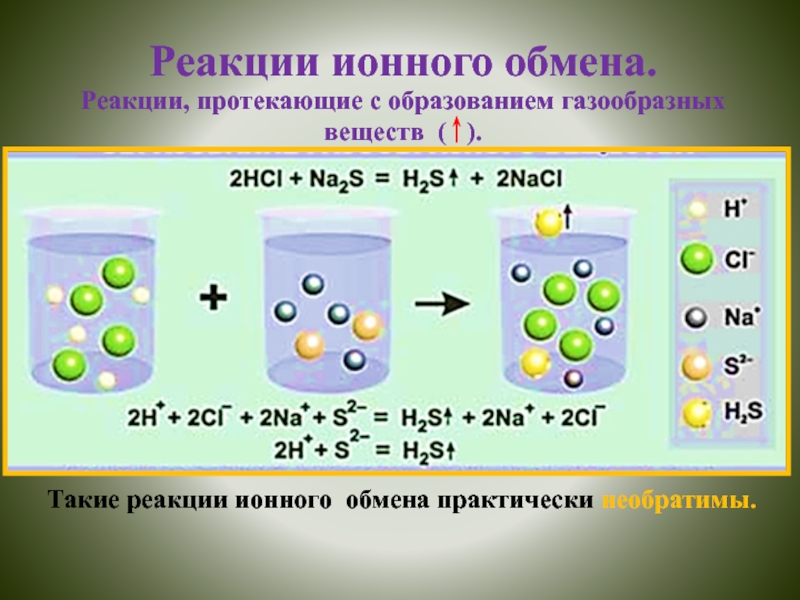
Химические реакции в растворах
электролитов протекают при участии ионов. Если такие реакции не сопровождаются изменением степеней окисления, они называются реакциями ионного обмена.