Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая связь 11 класс ионная связь
Содержание
- 1. Химическая связь 11 класс ионная связь
- 2. ХИМИЧЕСКАЯ СВЯЗЬ - сила, связывающая атомы в молекулы или другие частицы.
- 3. ХИМИЧЕСКАЯ СВЯЗЬ - - совокупность электростатических сил притяжения, связывающих атомы друг с другом в химическом соединении.
- 4. КлассификацияХимическая связьвнутримолекулярнаямежмолекулярнаяионнаяковалентнаяметаллическаяводородная
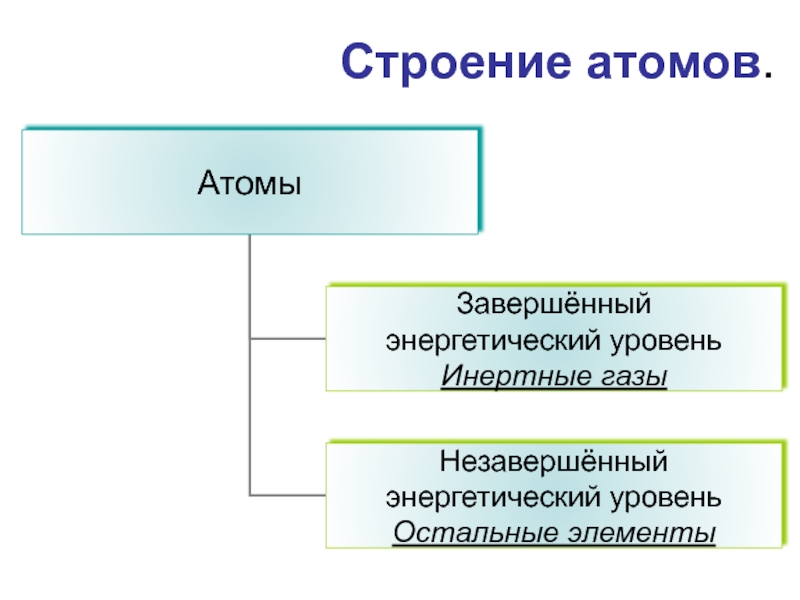
- 5. Строение атомов.
- 6. Причины образования химической связи:Понижение внутренней энергииОбразование устойчивой системы
- 7. Ионная связь -связь, образующаяся между ионами противоположного знака в результате электростатического притяжения.
- 8. Ионы - это частицы, в которые превращаются
- 9. Электроотрицательность (ЭО)- это способность атома смещать к себе общую электронную паруОЭО Li = 1Электроотрицательность (ЭО)
- 10. Ионная связь образуется между типичными Ме и НеМΔ ОЭО элементов ≥ 1,7
- 11. Ионные соединения1. Бинарные соединения типичных металлов и
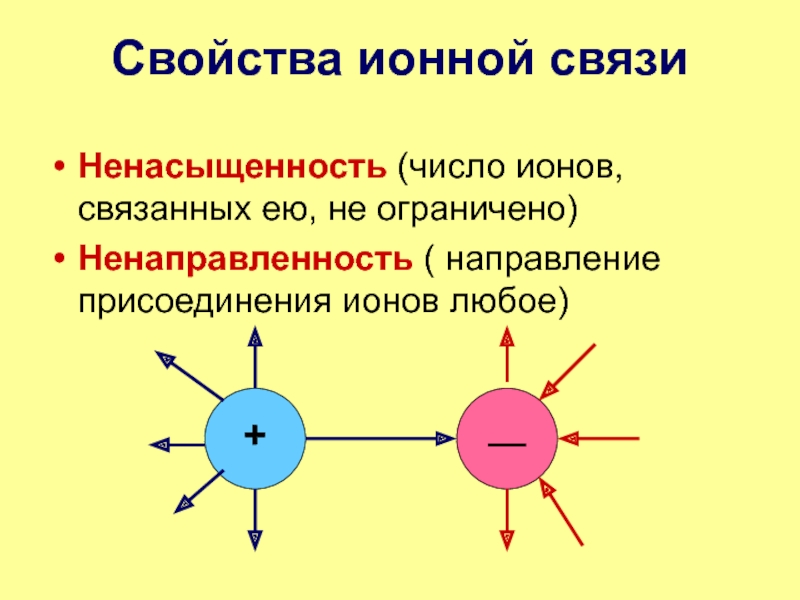
- 12. Свойства ионной связи Ненасыщенность (число ионов, связанных ею, не ограничено)Ненаправленность ( направление присоединения ионов любое)
- 13. Сульфат никеляИонные соединения.
- 14. Медный купорос
- 15. Природный кристалл каменной соли
- 16. Кристаллические тела – характеризуются пространственной
- 17. Ионной кристаллической решёткой называется решётка, в узлах которой расположены ионы, соединённые между собой ионной связью.
- 18. Свойства ионных соединенийТвердыеНелетучиеВысокие температуры плавления и кипенияХрупкие
- 19. Домашнее задание.Габриелян Химия 11 базовый уровень:§
- 20. Скачать презентанцию
ХИМИЧЕСКАЯ СВЯЗЬ - сила, связывающая атомы в молекулы или другие частицы.
Слайды и текст этой презентации
Слайд 1Химическая связь 11 класс
ионная связь
РАБОТА ВЫПОЛНЕНА
учителем химии средней школы №118
Выборгского района Санкт - Петербурга
Слайд 3ХИМИЧЕСКАЯ СВЯЗЬ -
- совокупность электростатических сил притяжения, связывающих атомы
друг с другом в химическом соединении.
Слайд 4Классификация
Химическая связь
внутримолекулярная
межмолекулярная
ионная
ковалентная
металлическая
водородная
Слайд 6Причины образования химической связи:
Понижение внутренней энергии
Образование устойчивой системы
Слайд 7Ионная связь
-связь, образующаяся между ионами противоположного знака в результате
электростатического притяжения.
Слайд 8Ионы - это частицы, в которые превращаются атомы, отдавая или
принимая электроны.
Общая электронная пара полностью переходит к более электроотрицательному
атому. А+В → А+В-
Анион – отрицательный ион (принимает электроны)
Катион – положительный ион (отдает электроны)
Слайд 9Электроотрицательность (ЭО)- это способность атома смещать к себе общую электронную
пару
ОЭО Li = 1
Электроотрицательность (ЭО)
Слайд 11Ионные соединения
1. Бинарные соединения типичных металлов и неметаллов;
2. Соли кислородсодержащих
кислот;
3. Щёлочи;
4.Соли аммония NH4Cl, (NH4)2SO4 др.;
5. Соли аминов [СН3NH3]+Cl- и
др. NaOH NaCl KOH
Слайд 12Свойства ионной связи
Ненасыщенность (число ионов, связанных ею, не ограничено)
Ненаправленность
( направление присоединения ионов любое)
Слайд 16 Кристаллические тела – характеризуются пространственной периодичностью в расположении
равновесных положений атомов или молекул, при чем эта периодичность выполняется
как для малых, так и на больших расстояниях.В кристаллических телах реализуется как дальний, так и ближний порядок.