Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гидролиз солей урок химии (11 класс)
Содержание
- 1. Гидролиз солей урок химии (11 класс)
- 2. Электролитическая диссоциация (С. Аррениус, 1887 г.) -процесс
- 3. Сила кислот (по степени диссоциации)
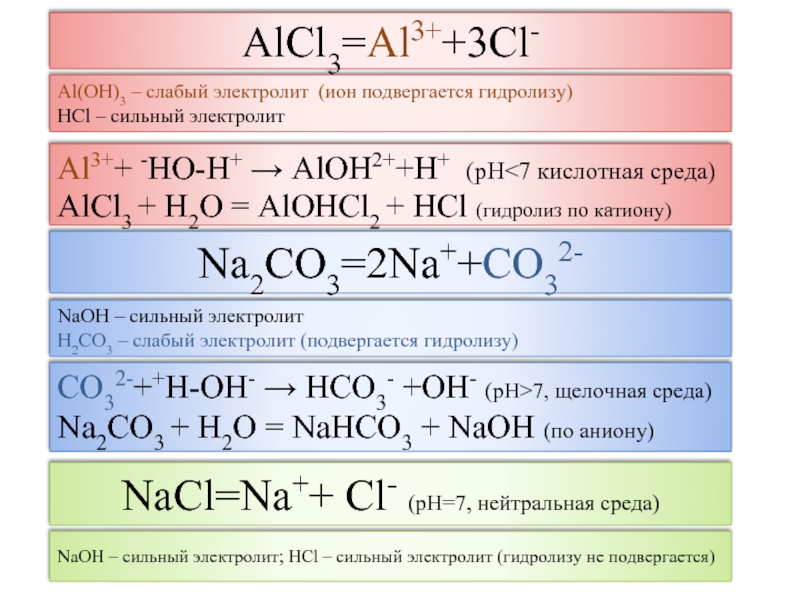
- 4. AlCl3=Al3++3Cl-Al3++ -HO-H+ → AlOH2++H+ (рН7, щелочная среда)
- 5. Алгоритм составления ионного и молекулярного уравнения гидролиза
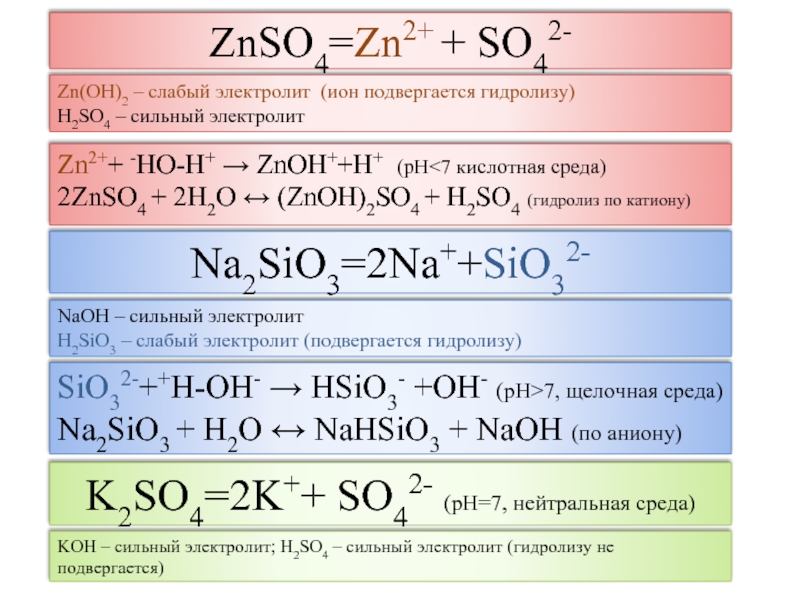
- 6. ZnSO4=Zn2+ + SO42-Zn2++ -HO-H+ → ZnOH++H+ (рН7,
- 7. Что происходит в водных растворах с солями,
- 8. Взаимодействие хлорида железа (+3) с карбонатом натрия
- 9. Взаимодействие хлорида железа (+3) с карбонатом натрия2FeCl3
- 10. Значение гидролизаС древности – зола – моющее
- 11. Выводы:Гидролиз – процесс взаимодействия ионов соли с
- 12. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Электролитическая диссоциация (С. Аррениус, 1887 г.) -
процесс распада электролита в
водном растворе (или расплаве) на ионы
Электролиты (М. Фарадей, первая половина
XIX в.) - вещества, растворы или расплавы которых проводят электрический ток
Степень диссоциации (α) -
отношение концентрации распавшихся при диссоциации ионов к общей
концентрации вещества (выражают в %)
Соли (с точки зрения ТЭД) -
электролиты, при диссоциации которых образуются катионы металла и
анионы кислотного остатка
рН раствора -
отрицательный десятичный логарифм концентрации ионов водорода
рН = - lg[H+]
рН < 7 – кислая среда; рН = 7 – нейтральная среда; рН > 7 – щелочная среда
Слайд 3Сила кислот (по степени диссоциации)
HCl
H2SO4 → HNO3 → H2SO3 → H2CO3
→ CH3COOH → H2S → H2SiO3H3PO4
Сила оснований (по степени диссоциации)
NaOH NH4OH Ca(OH)2
→ LiOH → → → Zn(OH)2 → Al(OH)3
KOH Ba(OH)2 Mg(OH)2
Сила солей (по степени диссоциации)
определяется по таблице растворимости, чем меньше растворимость,
тем меньше степень диссоциации.
Чем правее, тем слабее !!!
Слайд 4AlCl3=Al3++3Cl-
Al3++ -HO-H+ → AlOH2++H+ (рН
AlOHCl2 + HCl (гидролиз по катиону)
Al(OH)3 – слабый электролит (ион
подвергается гидролизу)HCl – сильный электролит
Na2CO3=2Na++CO32-
NaOH – сильный электролит
H2CO3 – слабый электролит (подвергается гидролизу)
CO32-++H-OH- → HCO3- +OH- (рН>7, щелочная среда)
Na2CO3 + H2O = NaHCO3 + NaOH (по аниону)
NaCl=Na++ Cl- (рН=7, нейтральная среда)
NaOH – сильный электролит; HCl – сильный электролит (гидролизу не подвергается)
Слайд 5Алгоритм составления ионного и молекулярного уравнения гидролиза соли
1. Составляем уравнение
электролитической диссоциации соли.
2. Определяем силу основания и кислоты, образующих соль.
3.
Выбираем ион слабого электролита.4. Составляем уравнение гидролиза выбранного иона
5. Определяем характер среды (рН < 7 или рН > 7)
6. По ионному уравнению составляем молекулярное.
Слайд 6ZnSO4=Zn2+ + SO42-
Zn2++ -HO-H+ → ZnOH++H+ (рН
2H2O ↔ (ZnOH)2SO4 + H2SO4 (гидролиз по катиону)
Zn(OH)2 – слабый
электролит (ион подвергается гидролизу)H2SO4 – сильный электролит
Na2SiO3=2Na++SiO32-
NaOH – сильный электролит
H2SiO3 – слабый электролит (подвергается гидролизу)
SiO32-++H-OH- → HSiO3- +OH- (рН>7, щелочная среда)
Na2SiO3 + H2O ↔ NaHSiO3 + NaOH (по аниону)
K2SO4=2K++ SO42- (рН=7, нейтральная среда)
KOH – сильный электролит; H2SO4 – сильный электролит (гидролизу не подвергается)
Слайд 7Что происходит в водных растворах с солями, образованными и слабыми
основаниями и слабыми кислотами?
Они подвергаются гидролизу и по катиону
и по анионуРеакция растворов может быть и нейтральной и слабокислотной и слабощелочной (это зависит от «силы» кислоты и основания, образующими соль)
Некоторые соли подвергаются необратимому гидролизу, например сульфид алюминия:
Al2S3 + 6 H2O = 2 Al(OH)3↓ + 3 H2S↑
Слайд 9Взаимодействие хлорида железа (+3) с карбонатом натрия
2FeCl3 + 3Na2CO3 =
Fe2(CO3)3 + 6NaCl
Не правильно, продукт реакции Fe2(CO3)3 не существует!
FeCl3 +
Na2CO3 + H2O → Fe(OH)3↓ + CO2 + NaCl2FeCl3 + 3Na2CO3 + 3H2O = 2Fe(OH)3 ↓ + 3CO2 ↑ + 6NaCl
Подберём коэффициенты
Слайд 10Значение гидролиза
С древности – зола – моющее средство (в состав
входит поташ – карбонат калия K2CO3, который гидролизуется по аниону
и образует щелочную среду, что обусловливает его мылкость)Мыло- натриевые и калиевые соли высших карбоновых кислот (стеарат натрия C17H35COONa, также гидролизуется по аниону – щелочная среда)
Стиральные порошки – добавляют фосфаты и карбонаты для усиления щелочной среды
Кислотные почвы известкуют (Са(ОН)2 или СаСО3), а в щелочные добавляют удобрение – сульфат аммония (NH4)2SO4
В слюне содержатся гидрофосфат-ионы, поэтому в полости рта слабокислотная среда
В составе крови содержатся соли – гидрокарбонат и гидрофосфат натрия, которые поддерживают определённую реакцию среды.
Слайд 11Выводы:
Гидролиз – процесс взаимодействия ионов соли с ионами воды с
изменением рН среды.
Обязательное условие гидролиза – образование слабого электролита
Характер
среды раствора соли зависит от иона, который подвергается гидролизу (по катиону или по аниону)В результате урока мы умеем:
Определять характер среды раствора соли и объяснять результаты с помощью ионного и молекулярного уравнения гидролиза
Делать логические выводы из наблюдений
Более глубоко характеризовать свойства солей как электролитов
В повседневной жизни использовать полученные знания по этой теме