Слайд 1
БИООРГАНИЧЕСКАЯ ХИМИЯ
Лекция 4
Карбоновые кислоты
План
1. Классификация.
2. Химические свойства.
3. Салициловая кислота,
фарм. препараты на её
основе.
Лектор: доктор биологических наук, профессор, зав.
кафедрой химии Ирина Петровна Степанова
ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
КАФЕДРА ХИМИИ
http://prezentacija.biz/
Слайд 2Карбоновые кислоты
Карбоновые кислоты – это органические вещества, содержащие в своем
составе карбоксильную группу (- COOH).
Слайд 3Классификация карбоновых кислот
I. По числу карбоксильных групп различают:
монокарбоновые – содержат
одну карбоксильную группу.
Пример: гомологический ряд предельных одноосновных кислот
CnH2n + 1COOH,
n = 0, 1, 2, 3, 4 …
HCOOH муравьиная (метановая) кислота (соли – формиаты)
Слайд 4Классификация карбоновых кислот
H3C – COOH уксусная (этановая) кислота
(соли – ацетаты)
H3C – CH2 – COOH пропионовая (пропановая)
кислота
(соли – пропионаты)
Слайд 5Классификация карбоновых кислот
H3C – CH2 – CH2 – COOH масляная
(бутановая) кислота (соли – бутираты)
H3C – CH2 – CH2 –
CH2 – COOH валериановая
(пентановая кислота) кислота (соли –
валераты)
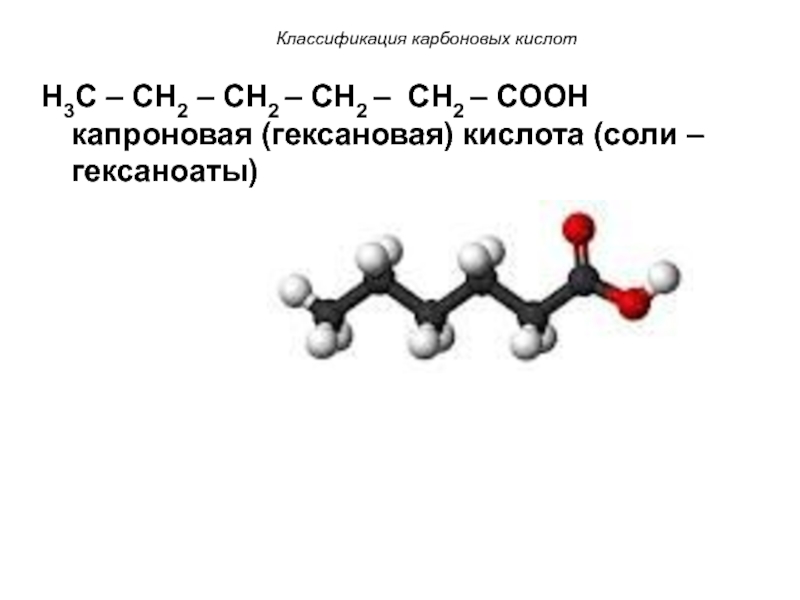
Слайд 6Классификация карбоновых кислот
H3C – CH2 – CH2 – CH2 –
CH2 – COOH капроновая (гексановая) кислота (соли – гексаноаты)
Слайд 7Классификация карбоновых кислот
b) поликарбоновые – содержат в своем составе две
и более карбоксильные группы.
Пример: гомологический ряд предельных дикарбоновых кислот
HOOC –
CnH2n – COOH, n = 0, 1, 2, 3, 4 …
HOOC – COOH щавелевая (этандиовая) кислота (соли – оксалаты),
HOOC – CH2 – COOH малоновая (пропандиовая) кислота (соли – малонаты),
HOOC – CH2 – CH2 – COOH янтарная (бутандиовая) кислота (соли – сукцинаты),
HOOC – CH2 – CH2 – CH2 – COOH глутаровая (пентандиовая) кислота (соли – глутараты).
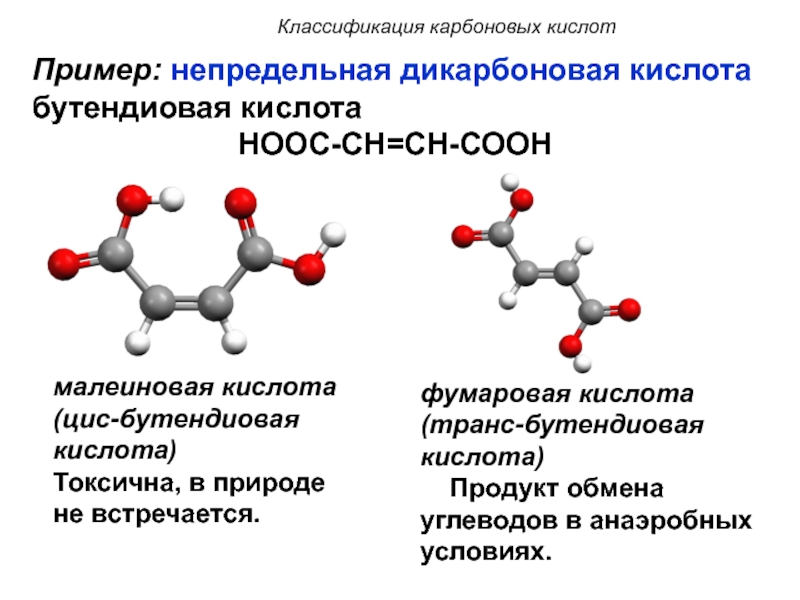
Слайд 8малеиновая кислота
(цис-бутендиовая кислота)
Токсична, в природе не встречается.
фумаровая кислота
(транс-бутендиовая кислота)
Продукт обмена углеводов в анаэробных условиях.
Пример: непредельная дикарбоновая
кислота
бутендиовая кислота
НООС-СН=СН-СООН
Классификация карбоновых кислот
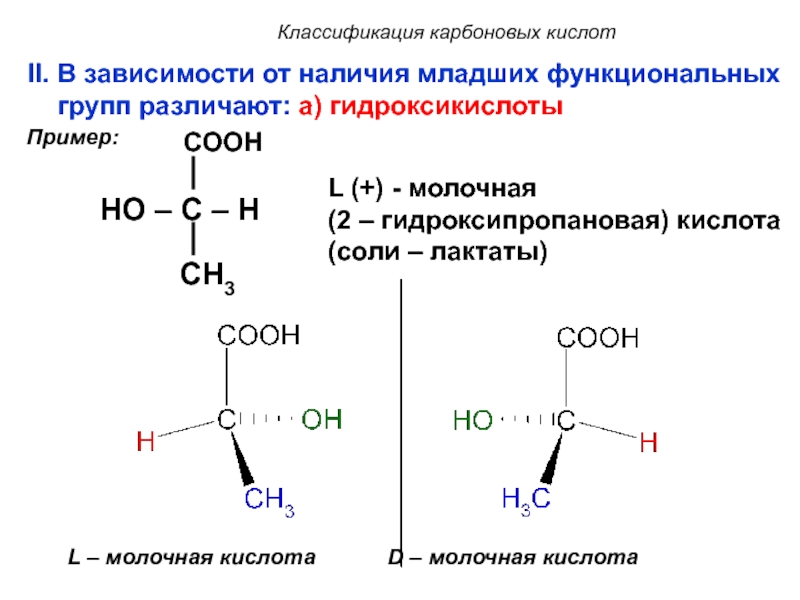
Слайд 9Классификация карбоновых кислот
II. В зависимости от наличия младших функциональных групп
различают: a) гидроксикислоты
COOH
HO – C – H
CH3
L (+) - молочная (2 – гидроксипропановая) кислота (соли – лактаты)
Пример:
L – молочная кислота D – молочная кислота
Слайд 10Классификация карбоновых кислот
COOH
HO – C – H
CH2
COOH
L (-) –яблочная кислота
(2- гидроксибутандиовая) кислота (соли – малаты)
Слайд 11Классификация карбоновых кислот
COOH
CH2
H – C – OH
CH3
D(+) –
β-гидроксимасляная
(2-гидроксибутановая) кислота,
соли – β-гидроксибутираты
COOH
HO – C – CH2 – COOH
СH2 – COOH
лимонная (2-гидроксипропан-
1,2,3-трикарбоновая) кислота, соли – цитраты
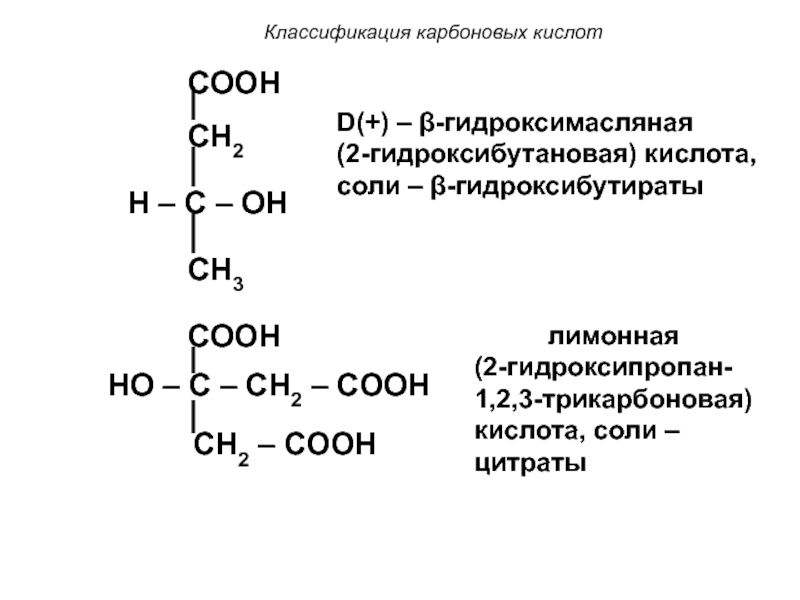
Слайд 12Классификация карбоновых кислот
Гидроксикислоты являются, как правило, твёрдыми
телами. Рацемическая молочная кислота может быть жидкой (т. пл. 18оС).
Запахом гидроксикислоты почти не обладают.
Гидроксикислоты имеют очень большое значение в биологической химии; их можно встретить во многих очень важных метаболических путях – цикле Кребса, гликолизе, пентозофосфатном цикле, b-окислении жирных кислот, биосинтезе жирных кислот и т.д.
Слайд 13Классификация карбоновых кислот
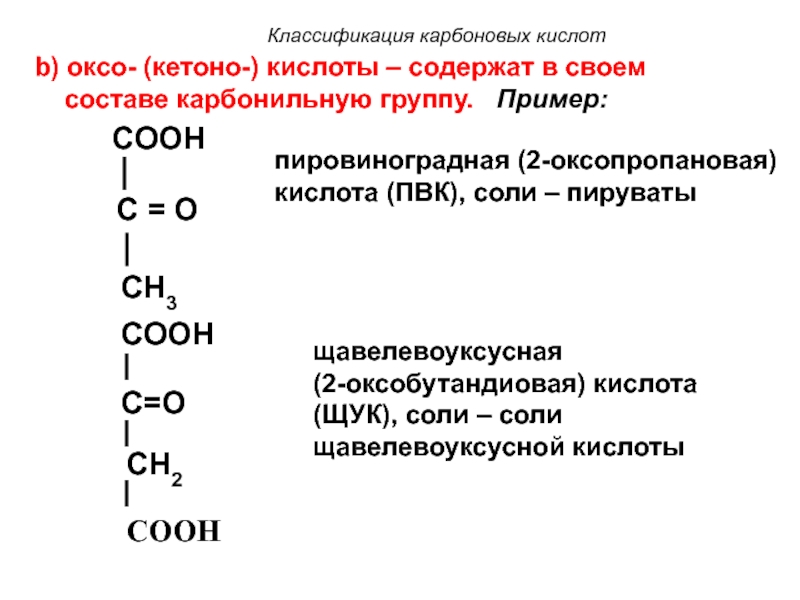
b) оксо- (кетоно-) кислоты – содержат в своем
составе карбонильную группу. Пример:
COOH
C = O
CH3
пировиноградная (2-оксопропановая) кислота (ПВК), соли – пируваты
COOH
C=O
CH2
COOH
щавелевоуксусная (2-оксобутандиовая) кислота
(ЩУК), соли – соли щавелевоуксусной кислоты
Слайд 14Классификация карбоновых кислот
COOH
CH2
C =
O
CH3
ацетоуксусная (3-оксобутановая) кислота,
cоли – соли ацетоуксусной кислоты
Слайд 15Классификация карбоновых кислот
III. Особую группу составляют высшие (жирные)
карбоновые кислоты (ВЖК); входят в состав липидов.
Различают ВЖК:
предельные.
Пример: C15H31COOH –
пальмитиновая кислота,
C17H35COOH – стеариновая кислота,
C23H47COOH – лигноцириновая кислота,
C23H46 (OH)COOH – цереброновая кислота;
Слайд 16b) непредельные.
Пример: C17H33COOH – олеиновая кислота (одна двойная связь),
C17H31COOH
– линолевая кислота (две двойных связи),
C17H29COOH – линоленовая кислота (три
двойных связи),
C23H45COOH – нервоновая кислота (одна двойная связь).
Классификация карбоновых кислот
Слайд 17a-метилмасляная кислота
2-метилбутановая кислота
Номенклатура карбоновых кислот
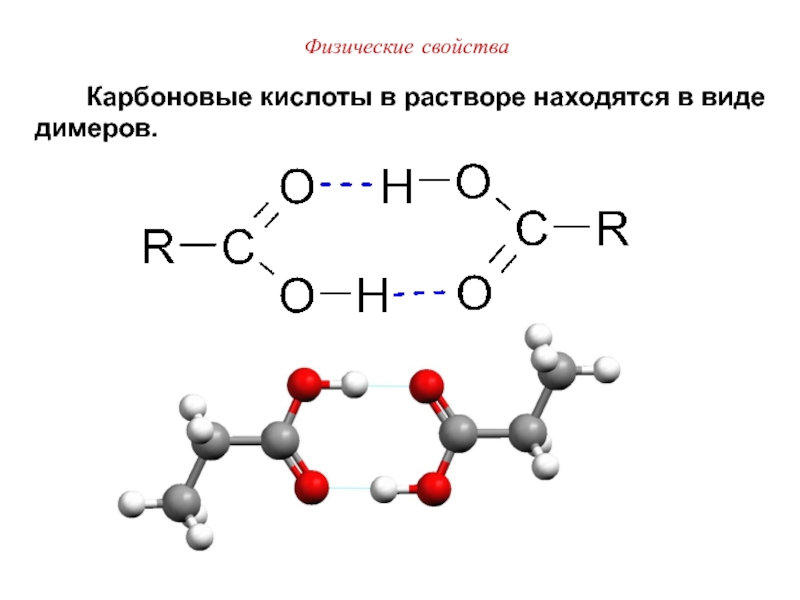
Слайд 18Физические свойства
Карбоновые кислоты в растворе находятся
в виде димеров.
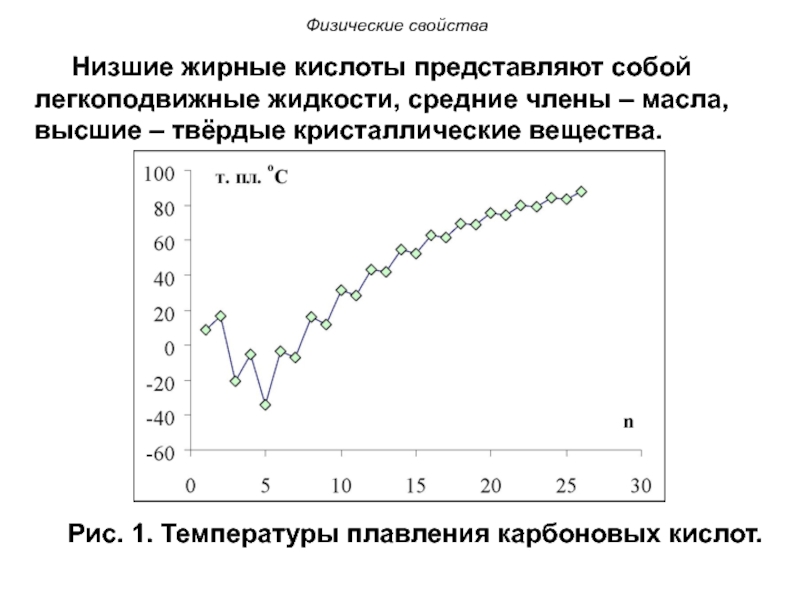
Слайд 19Физические свойства
Низшие жирные кислоты представляют собой легкоподвижные
жидкости, средние члены – масла, высшие – твёрдые кристаллические вещества.
Рис.
1. Температуры плавления карбоновых кислот.
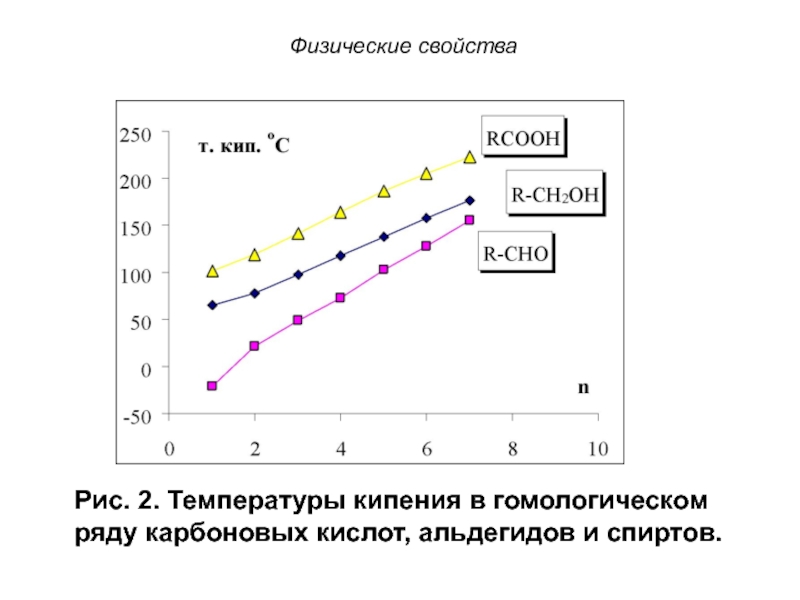
Слайд 20Физические свойства
Рис. 2. Температуры кипения в гомологическом ряду карбоновых кислот,
альдегидов и спиртов.
Слайд 21Физические свойства
Первые члены гомологического ряда карбоновых кислот
обладают резким запахом, средние – прогорклым, неприятным, например, масляная кислота
пахнет потом, высшие карбоновые кислоты вследствие нелетучести лишены запаха.
Карбоновые кислоты, как правило, не ядовиты, однако приём внутрь концентрированных растворов (например, уксусной эссенции) вызывает тяжёлые ожоги. Нежелательно попадание этих растворов на кожу и тем более внутрь.
Слайд 22Строение карбоксильной группы
Оδ-
Сδ+
Оδ- Нδ+
..
Карбоксильная группа представляет собой плоскую p-π –сопряженную систему за счет взаимодействия pz–АО кислорода гидрокси-группы с π-связью карбонильной группы. Это приводит к повышению кислотных свойств карбоновых кислот по сравнению со спиртами.
Слайд 23 В карбоновых кислотах частичный положительный заряд на
атоме углерода меньше, чем в альдегидах и кетонах, поэтому для
карбоновых кислот менее характерны реакции нуклеофильного присоединения (AN) по сравнению с альдегидами и кетонами.
Строение карбоксильной группы
Слайд 24Строение карбоксильной группы
В карбоновых кислотах выделяют следующие
реакционные центры:
Oδ- 1
R CH Cδ+
H OH
4 2 3
1 – основный, нуклеофильный центр,
2 – электрофильный центр,
3 – «OH» - кислотный центр,
4 – «CH» - кислотный центр.
α
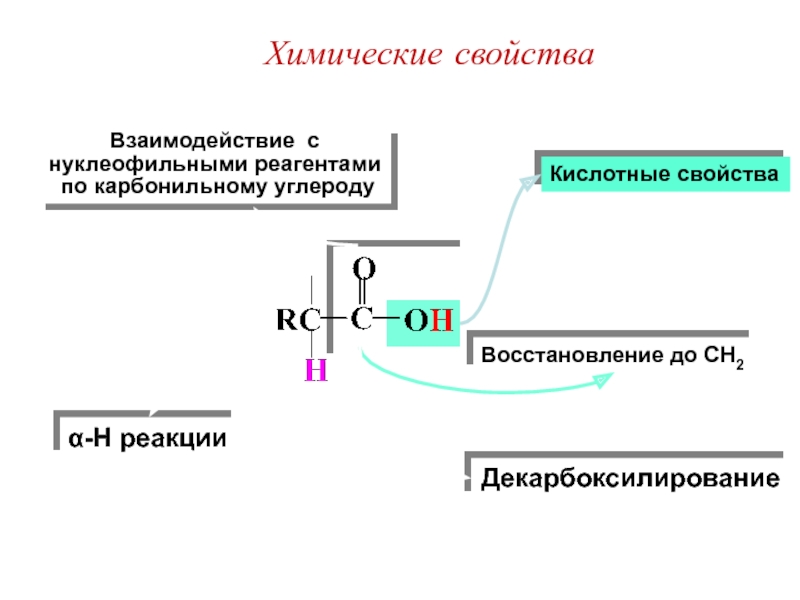
Слайд 25Кислотные свойства
Взаимодействие с
нуклеофильными реагентами
по карбонильному углероду
Восстановление до CH2
Декарбоксилирование
α-H реакции
Химические
свойства
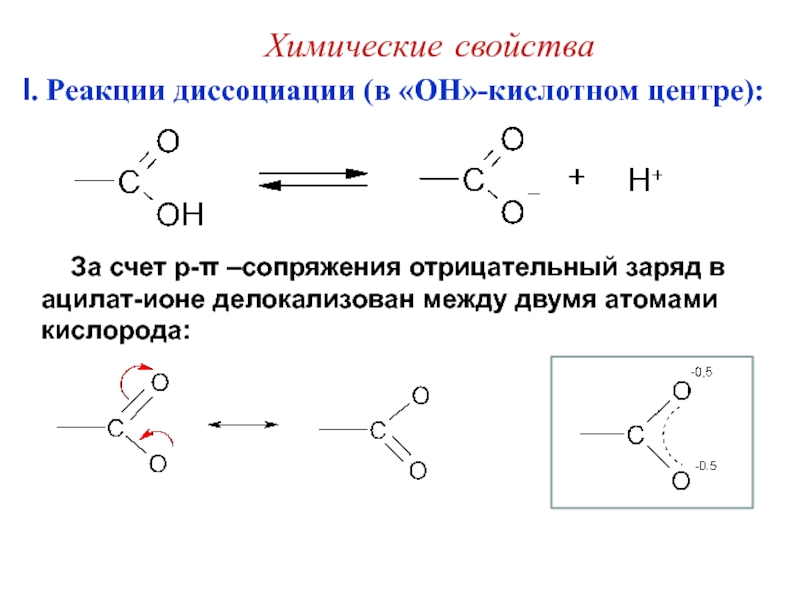
Слайд 26I. Реакции диссоциации (в «OH»-кислотном центре):
За счет p-π
–сопряжения отрицательный заряд в ацилат-ионе делокализован между двумя атомами кислорода:
Химические
свойства
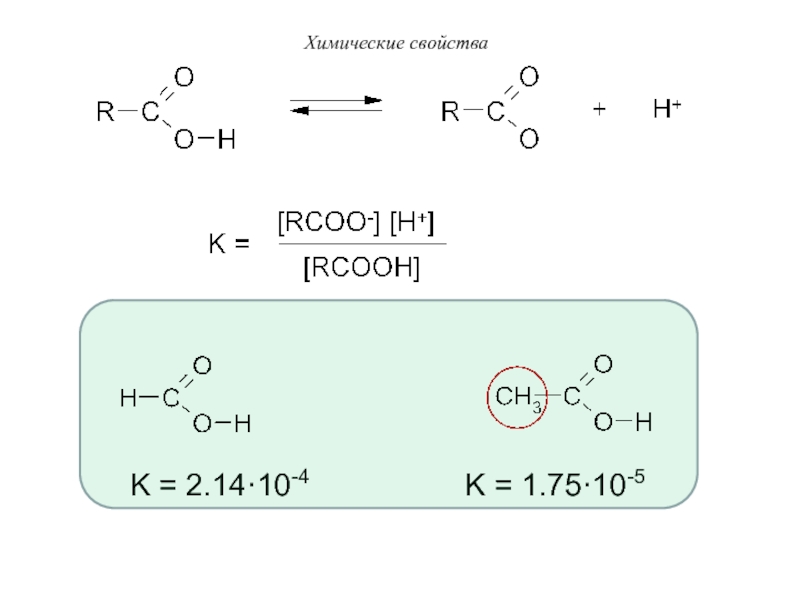
K = 1.75·10-5
Химические свойства
Слайд 28Химические свойства
II. Образование солей:
а) С активными металлами:
2 CH3COOH + Mg
→ (CH3COO)2Mg + H2
б) С основными оксидами:
2 CH3COOH + CaO
→ (CH3COO)2Ca + H2O
в) Со щелочами (реакция нейтрализации):
CH3COOH + NaOH → CH3COONa + H2O
г) С солями более слабых кислот:
CH3COOH + NaHCO3 → CH3COONa + CO2 ↑+ H2O
2 CH3COOH + Na2CO3 → 2 CH3COONa + CO2 ↑+ H2O
Эти реакции используются как качественные на карбоксильную группу (по выделению пузырьков CO2).
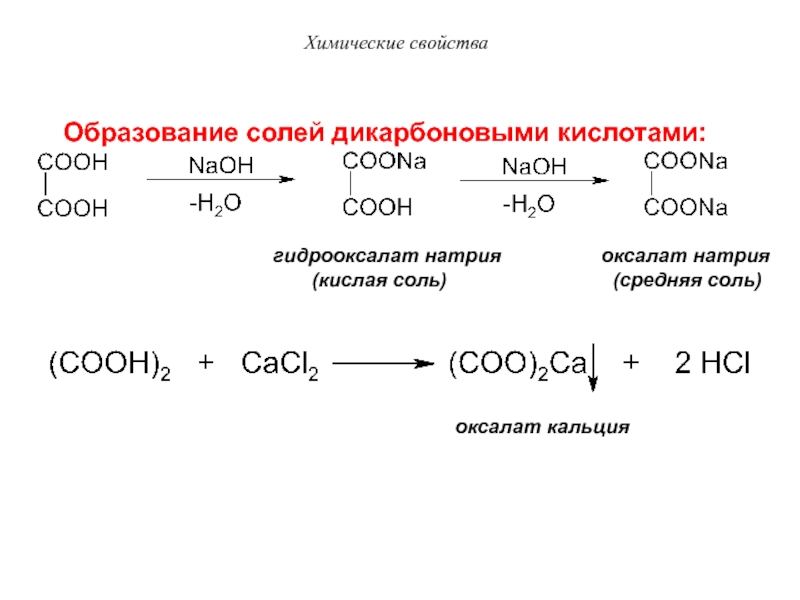
Слайд 29
Образование солей дикарбоновыми кислотами:
гидрооксалат натрия
оксалат натрия
(кислая
соль) (средняя соль)
оксалат кальция
Химические свойства
Слайд 30Около 80% почечных камней образуется из оксалата кальция.
Химические свойства
Слайд 31Химические свойства
молочная кислота
лактат кальция
Образование солей гидроксикислотами:
Лактат кальция используется в медицине как кальциевый препарат.
Слайд 32Химические свойства
III. Реакции галогенирования (в СН - кислотном центре):
CH3
CH2 COOH + Br2 CH3 CH
COOH + HBr
Br
пропионовая кислота α- бромпропионовая кислота
Слайд 33Химические свойства
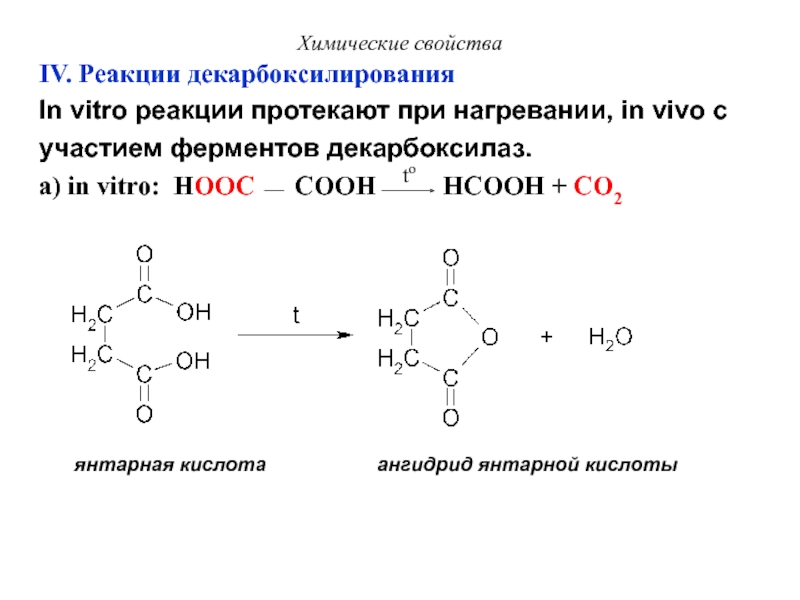
IV. Реакции декарбоксилирования
In vitro реакции протекают при нагревании, in
vivo с
участием ферментов декарбоксилаз.
а) in vitro: HOOC
COOH HCOOH + CO2
to
янтарная кислота ангидрид янтарной кислоты
Слайд 34Химические свойства
COOH
COOH
CH2 CH2
CH2 CH2
CH2 CH3
COOH
глутаровая кислота масляная кислота
F
-CO2
б) in vivo:
Слайд 35Химические свойства
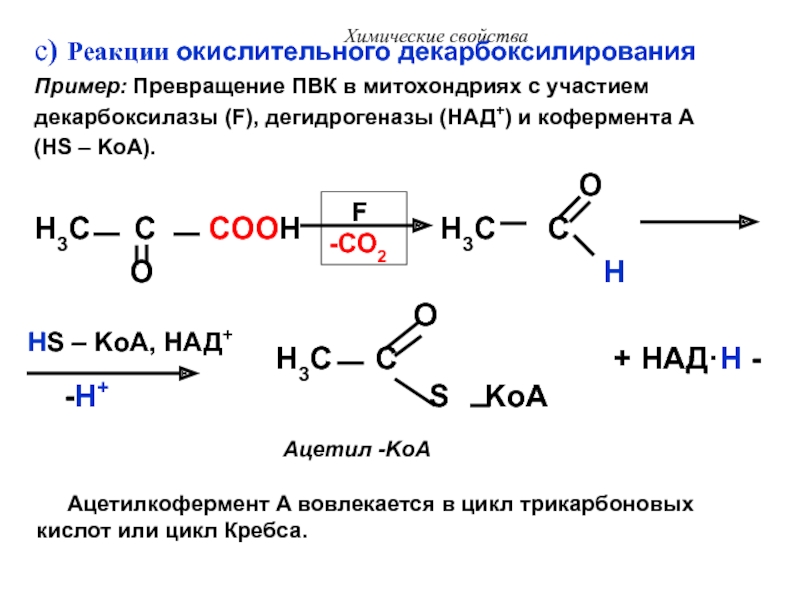
c) Реакции окислительного декарбоксилирования
Пример: Превращение ПВК в митохондриях с
участием
декарбоксилазы (F), дегидрогеназы (НАД+) и кофермента А
(HS – KoA).
O
H3C C COOH H3C C
O H
O
H3C C + НАД·H - -H+ S KoA
F
-CO2
HS – KoA, НАД+
Ацетил -KoA
Ацетилкофермент A вовлекается в цикл трикарбоновых кислот или цикл Кребса.
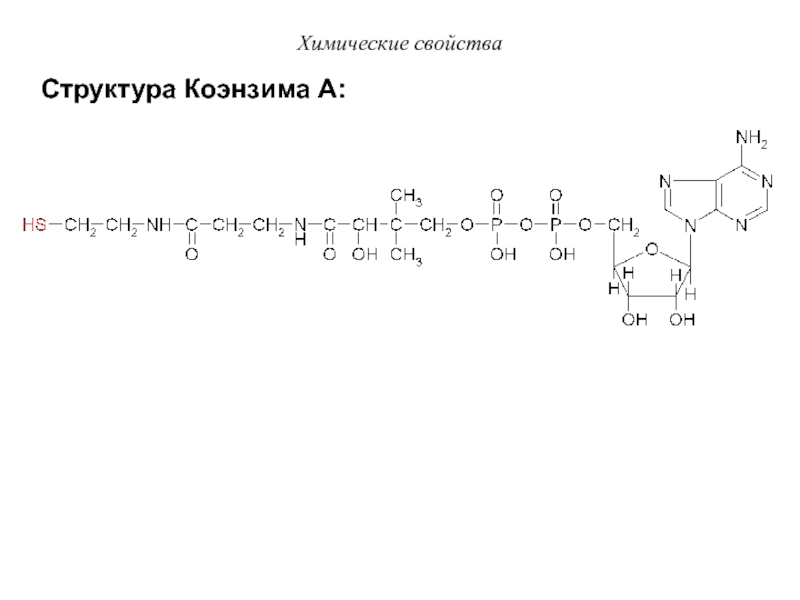
Слайд 36Структура Коэнзима А:
Химические свойства
Слайд 37Химические свойства
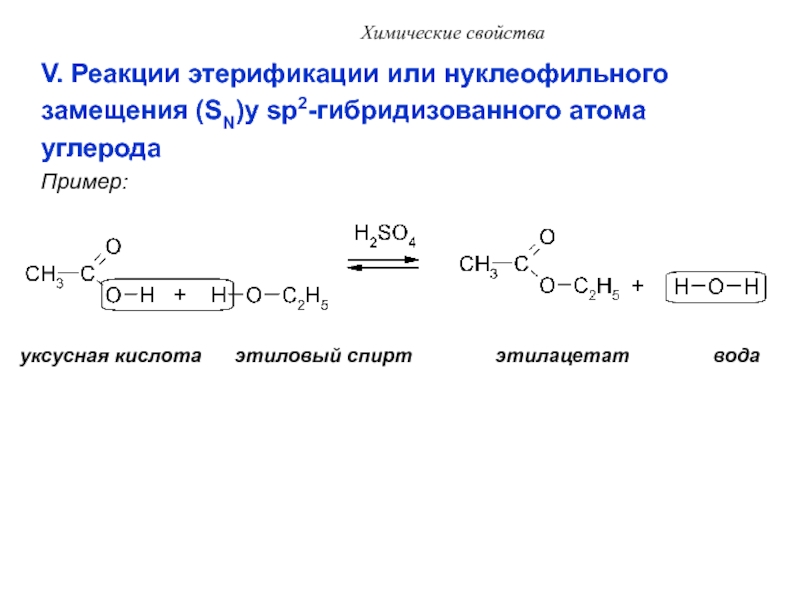
V. Реакции этерификации или нуклеофильного
замещения (SN)у sp2-гибридизованного атома
углерода
Пример:
уксусная кислота этиловый спирт этилацетат вода
Слайд 38Химические свойства
VI. Межмолекулярная дегидратация с образованием ангидридов (при пропускании паров
кислот над водоотнимающими средствами P2O5, H2SO4конц:
“Ангидрид” (an
– отрицающая частица, греч. udor – вода) означает “лишённый воды”.
Слайд 39Химические свойства
VII. Окисление карбоновых кислот
В организме карбоновые кислоты окисляются в основном за счёт т.н.
b-окисления. Кроме того in vivo встречается также α- и w-окисление.
In vitro некоторые аналогичные реакции b-окисления можно осуществить с помощью 3% перекиси водорода.
Слайд 40Химические свойства
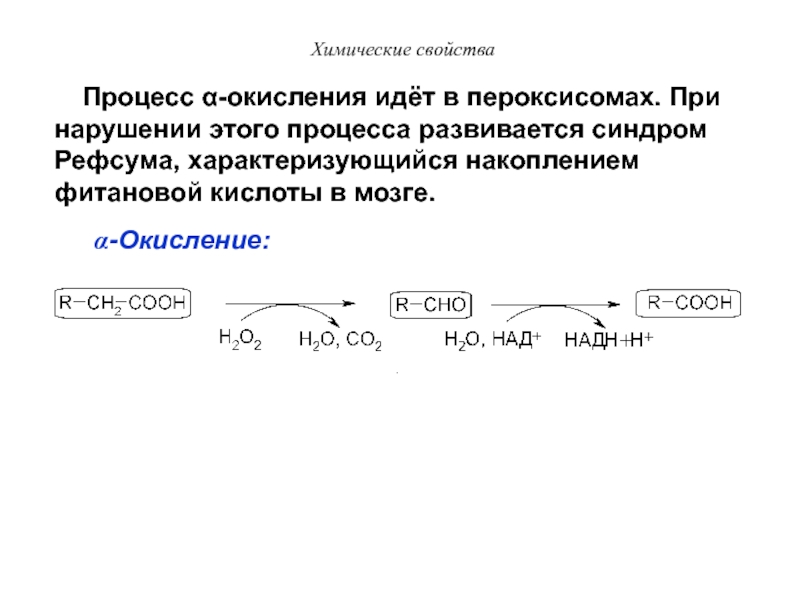
Процесс α-окисления идёт в пероксисомах. При
нарушении этого процесса развивается синдром Рефсума, характеризующийся накоплением фитановой кислоты
в мозге.
a-Окисление:
Слайд 41Химические свойства
Окисление дикарбоновых кислот in vivo:
янтарная кислота
фумаровая кислота
Слайд 42Химические свойства
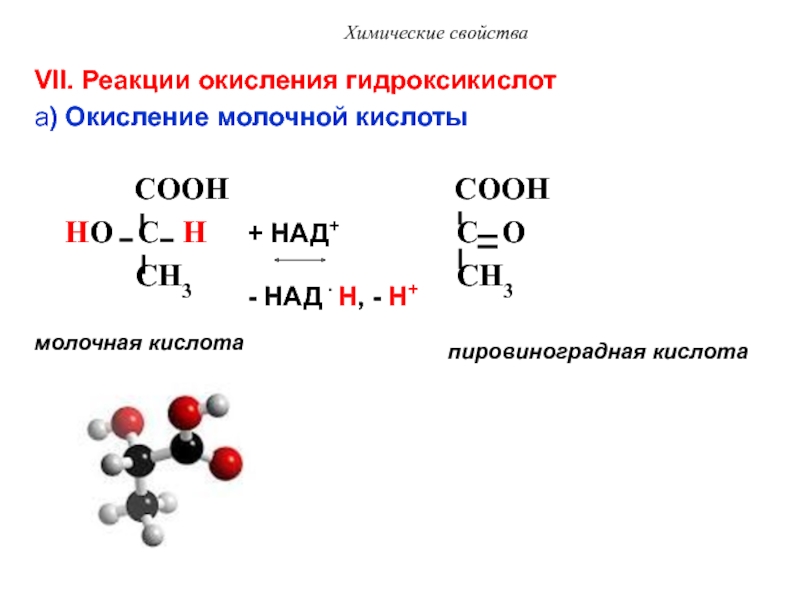
VII. Реакции окисления гидроксикислот
a) Окисление молочной кислоты
COOH
COOH
HO C H C O
CH3 CH3
молочная кислота
+ НАД+
- НАД · H, - H+
пировиноградная кислота
Слайд 43Химические свойства
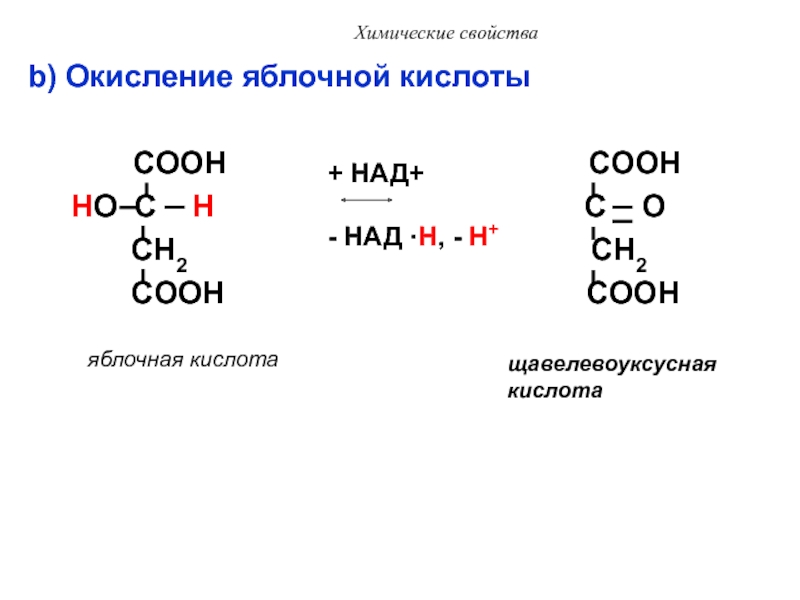
b) Окисление яблочной кислоты
COOH
COOH
HO C H C O
CH2 CH2
COOH COOH
яблочная кислота
+ НАД+
- НАД ·H, - H+
щавелевоуксусная
кислота
Слайд 44Химические свойства
с) Окисление β-гидроксимасляной кислоты
COOH
COOH
CH2 CH2
H C OH C O
CH3 CH3
+ НАД+
- НАД ·H, - H+
β –гидрокимасляная
кислота
ацетоуксусная кислота
Слайд 45Химические свойства
H3C C CH2 COOH + H2O
2 H3C
COOH
O
В норме ацетоуксусная кислота подвергается гидролитическому расщеплению с образованием двух молекул уксусной кислоты.
уксусная кислота
Уксусная кислота, вовлекаясь в обменные процессы, окисляется до конечных продуктов CO2 и H2O. При патологии (сахарном диабете) идет декарбоксилирование уксусной кислоты.
H3C C CH2 COOH H3C C CH3 + CO2
O O
ацетон
В крови больных накапливаются кетоновые тела: β-гидрокимасляная кислота, ацетоуксусная кислота, ацетон.
F
Слайд 46Химические свойства
Специфические свойства винной кислоты – образование хелатных комплексов с
ионами металлов.
L-винная кислота D-винная кислота
мезовинная кислота
Слайд 47Салициловая кислота, фарм. препараты на её основе
Салициловая кислота:
(о-гидроксибензойная кислота)
Обладает большей кислотностью, чем бензойная кислота, а
также мета- и пара- изомеры. Это объясняется стабилизацией аниона за счет образования внутримолекулярной водородной связи:
δ+
Салициловая кислота, фарм. препараты на её основе
Слайд 48Салициловая кислота, фарм. препараты на её основе
Салициловая
кислота применяется в медицине в виде спиртовых растворов и мазей
как антисептическое лекарственное средство.
Слайд 49Метилсалицилат:
Используется как противовоспалительное, анальгетическое средство наружно (в виде мазей).
Салициловая
кислота, фарм. препараты на её основе
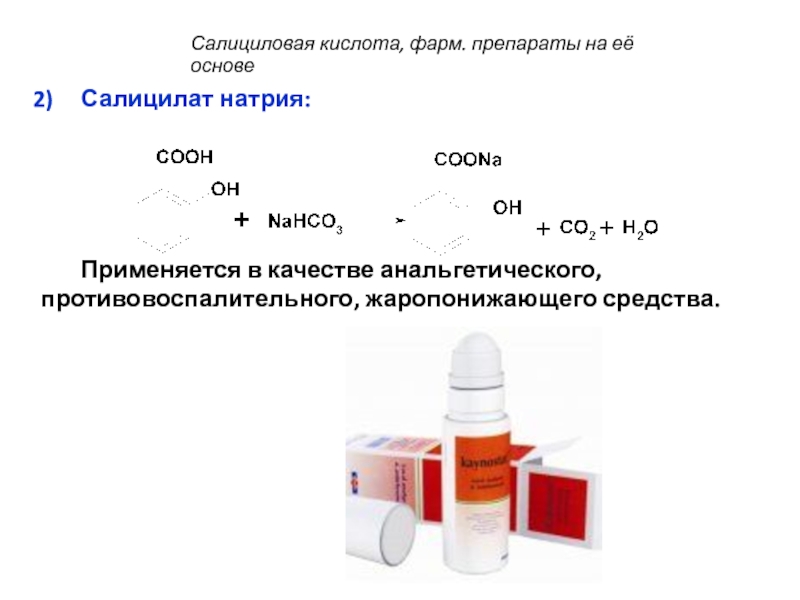
Слайд 50Салицилат натрия:
Применяется в качестве анальгетического, противовоспалительного, жаропонижающего средства.
Салициловая кислота,
фарм. препараты на её основе
Слайд 51Фенилсалицилат:
салицилат
хлорангидрид фенилсалицилат
натрия салициловой кислоты
Фенилсалицилат входит
в состав фарм. препаратов.
Салициловая кислота, фарм. препараты на её основе
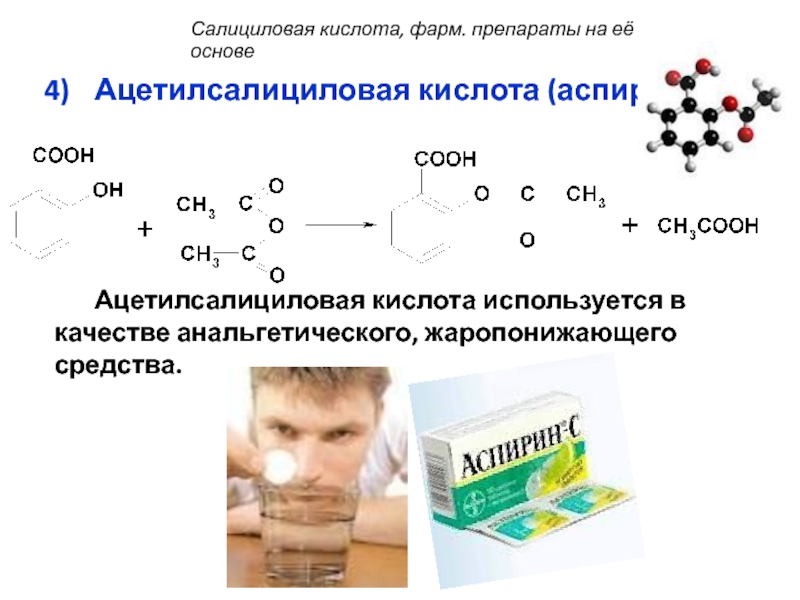
Слайд 52Ацетилсалициловая кислота (аспирин):
Ацетилсалициловая кислота используется в качестве анальгетического, жаропонижающего средства.
Салициловая кислота, фарм. препараты на её основе
Слайд 53Салициловая кислота и её производные со свободной гидроксильной группой дают
с раствором хлорида железа (III) фиолетовое окрашивание, характерное для фенолов,
что используется в качественном анализе.
Салициловая кислота, фарм. препараты на её основе