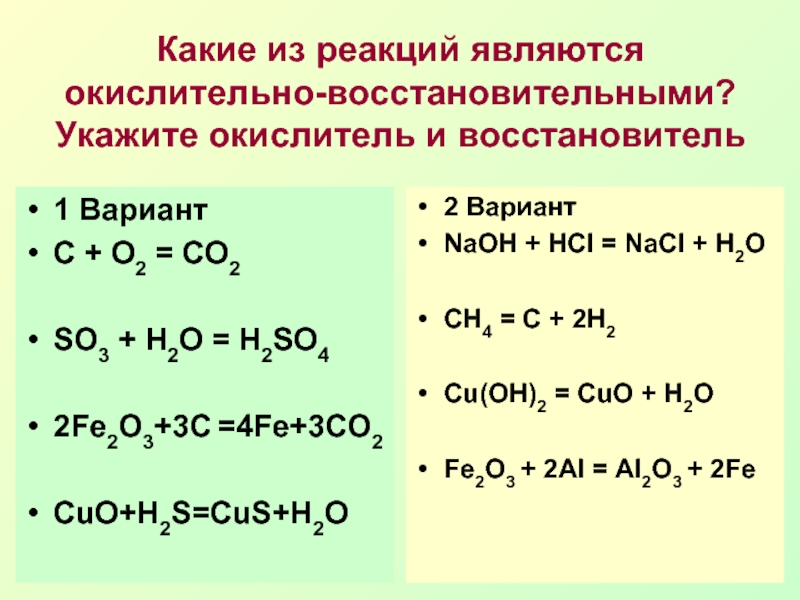
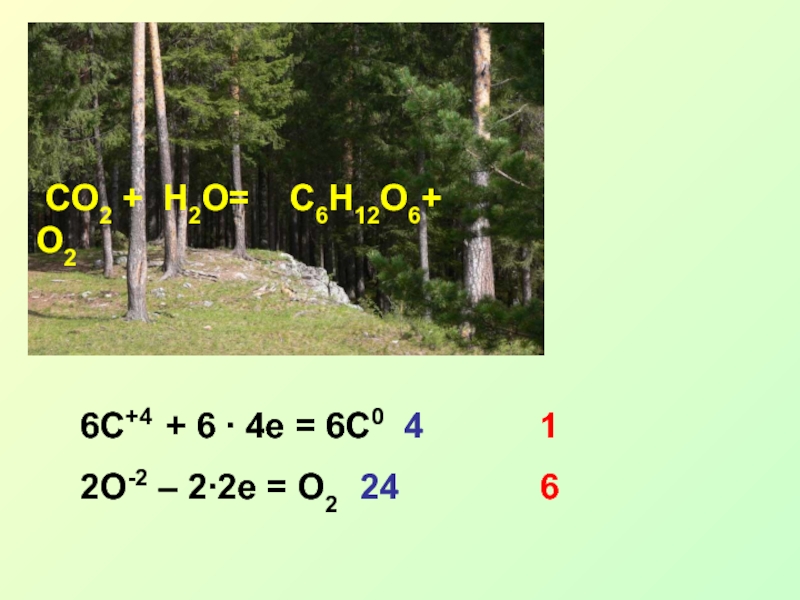
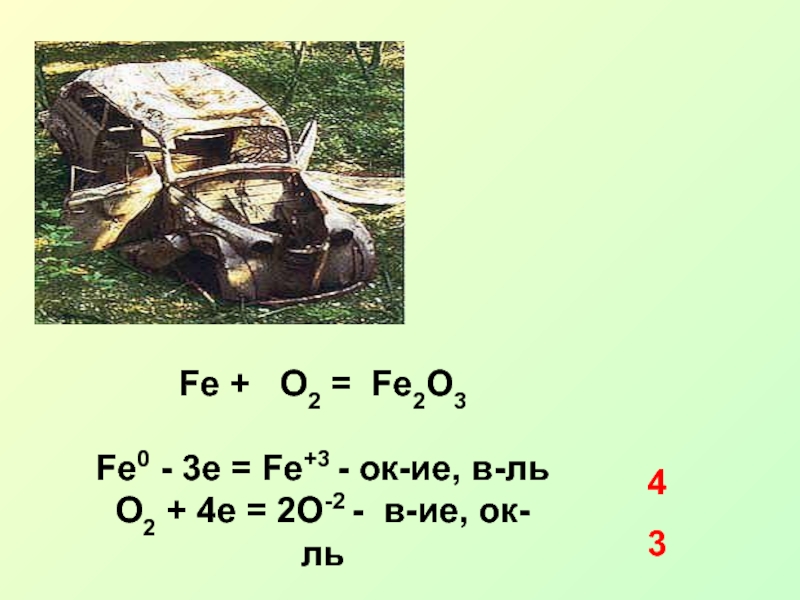
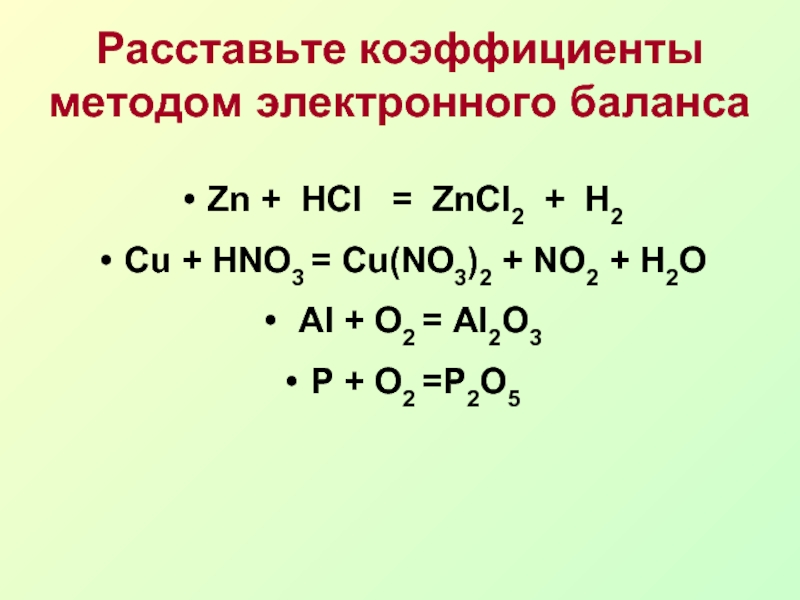
Вариант
С + О2 = СО2
SO3 + H2O = H2SO4
2Fe2O3+3C =4Fe+3CO2
CuO+H2S=CuS+H2O
2
ВариантNaOH + HCl = NaCl + H2O
CH4 = C + 2H2
Сu(OH)2 = CuO + H2O
Fe2O3 + 2Al = Al2O3 + 2Fe