Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химические уравнения. Реакции обмена
Содержание
- 1. Химические уравнения. Реакции обмена
- 2. *Лебедева Л.В.Повторим изученный материал Какое слово зашифровано
- 3. Реакции соединения - это реакции, при которых
- 4. Как расставить коэффициенты в реакциях
- 5. Na + Cl2
- 6. Цель урока: -познакомиться с реакциями обмена,
- 7. Химические уравнения. Реакции обмена. Правила техники безопасностиРеакция нейтрализацииЛабораторные опытыУсловия течения реакций идущих до концаПроверка знанийДомашнее задание
- 8. NaOH + HCl = NaCl + H2OЗапишите
- 9. Не брать вещества рукамиОсторожно! ..При
- 10. Получите нерастворимый Fe(OH)3↓.
- 11. На дне стакана равномерно разместите ложечку соды
- 12. А если бы в пробирках
- 13. Вопрос 1Какая реакция относится к реакциямионного обмена?Вопрос
- 14. НазадДомашнее задание Не забудьте пользоваться таблицей
- 15. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1
МОУ «Каратунская СОШ с углубленным изучением отдельных предметов»
Выполнила : учитель
химии второй квалификационной категории Яппарова А.Н.
Слайд 2*
Лебедева Л.В.
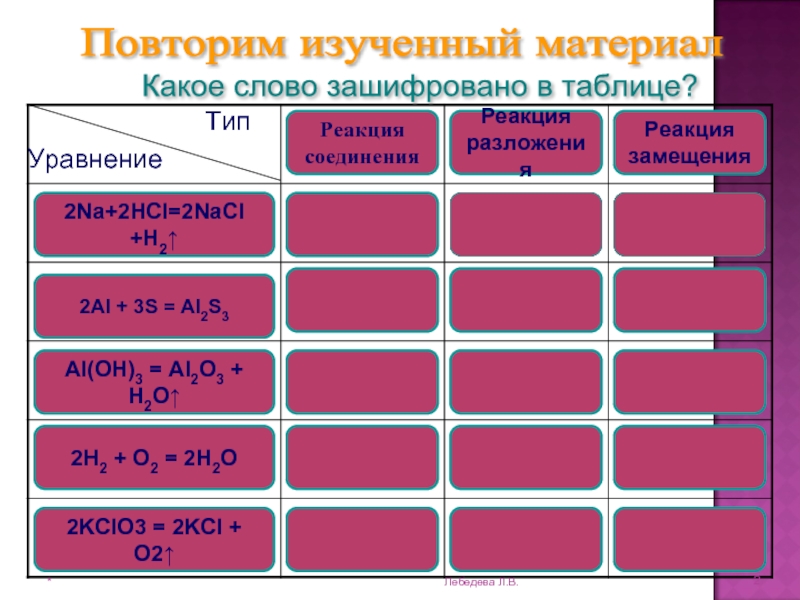
Повторим изученный материал
Какое слово зашифровано в таблице?
2Na+2HCl=2NaCl
+H2↑
2Al + 3S = Al2S3
Al(OH)3 = Al2O3 + H2O↑
2Н2 +
O2 = 2Н2O 2KClO3 = 2KCl + O2↑
Реакция
соединения
Реакция
разложения
Реакция
замещения
Нет
Не правильно
Нет
Ты уверен?
Не верно
Не верно
Ты уверен?
Не верно
Не правильно
Не правильно
О
Б
М
Е
Н
Слайд 3Реакции соединения - это реакции, при которых из нескольких веществ
образуется одно сложное.
Реакции замещения - это реакции, где атомы простого
вещества замещают атомы одного из элементов в сложном веществе.Реакции разложения - это реакции, в результате которых из одного вещества
получается несколько новых
веществ.
.
Укажите тип реакции по данному пределению
Слайд 4 Как расставить коэффициенты в реакциях с нечётным числом
атомов?
5
10
Обратите внимание!
Р
+
О
2
=
Р
2
О
5
Находим наименьшее
общее кратное
10
2. Находим
количество атомовкислорода
10
2
5
:
=
5
3. Уравнивам левую и правую части
2
4
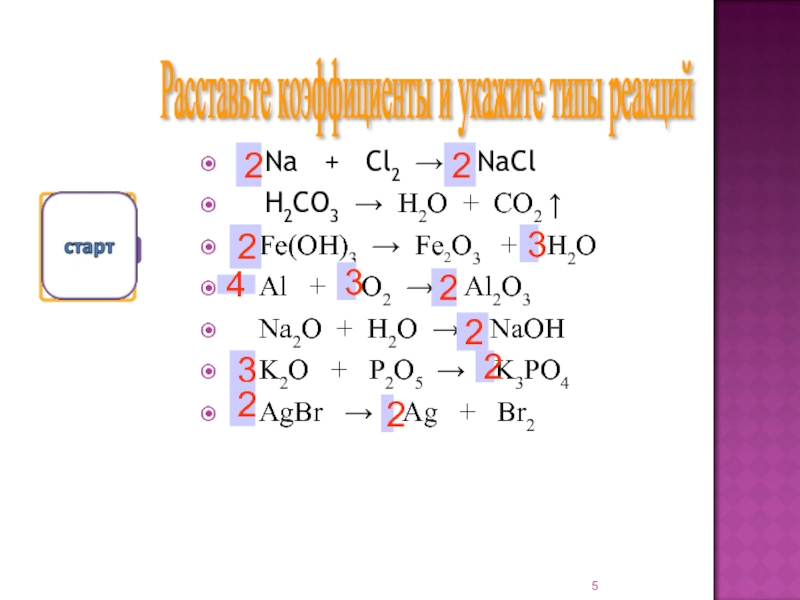
Слайд 5 Na + Cl2 → NaCl
H2CO3 → H2O + CO2 ↑
Fe(OH)3 →
Fe2O3 + H2OAl + O2 → Al2O3
Na2O + H2O → NaOH
K2O + P2O5 → K3PO4
AgBr → Ag + Br2
Расставьте коэффициенты и укажите типы реакций
2
2
4
0
1
2
3
4
5
6
7
8
9
10
3
2
3
2
2
3
2
2
2
Слайд 6Цель урока:
-познакомиться с реакциями обмена, дать определение
данным реакциям
-установить условия протекания реакций обмена до конца
-продолжить
учиться составлять уравнения реакцийХимические уравнения. Реакции обмена.
Слайд 7
Химические уравнения. Реакции обмена.
Правила техники безопасности
Реакция нейтрализации
Лабораторные опыты
Условия течения
реакций идущих до конца
Проверка знаний
Домашнее задание
Слайд 8NaOH + HCl = NaCl + H2O
Запишите уравнение подобной реакции
между
серной кислотой и гидроксидом калия
H2SO4 + 2 KOH = K2SO4 + 2 H2OТолько ли щёлочи вступают в
реакцию нейтрализации?
Ведь есть ещё нерастворимые основания.
.
Реакция нейтрализации
?
?
Назад
Слайд 9 Не брать вещества руками
Осторожно!
..При попадании на
руки кислоты и щелочи вызывают ожог
Сыпучие химические вещества накладывать лопаткой.
Правила
техники безопасности Назад
Слайд 10 Получите нерастворимый Fe(OH)3↓.
В
пробирку налейте 1 мл гидроксида натрия и прилейте несколько капель
хлорида железа (III). Что вы наблюдаете? Запишите уравнение реакции между хлоридом железа (III) и гидроксидом натрия.А теперь проведите реакцию нейтрализации. К осадку Fe(OH)3 прилейте серную кислоту. Что вы наблюдаете? Запишите уравнение реакции между Fe(OH)3 и серной кислотой.
.
Опыт №1 Реакция нейтрализации
Слайд 11На дне стакана равномерно разместите ложечку соды (карбоната натрия) и
прилейте 2 мл раствора серной кислоты, сразу же прикройте картоном.
Что вы наблюдаете?Внесите в стакан зажженную лучину. Что вы наблюдаете?
Какое вещество образовалось?
Запишите уравнение реакции между карбонатом натрия и серной кислотой. //Угольная кислота, образующаяся в результате реакции, сразу же разлагается
на воду и оксид углерода (IV)//.
Опыт №2 Получение углекислого газа
Назад
Слайд 12 А если бы в пробирках проходила реакция нейтрализации
между NaCl и H2SO4 ?
2NaCl + H2SO4 = Na2SO4
+ 2HClОбратитесь к таблице растворимости!
Реакция идёт лишь в том случае,
если образуется осадок или газ (↓ и ↑)
Назад
Условия течения реакций между растворами до конца
Слайд 13
Вопрос 1
Какая реакция относится к реакциям
ионного обмена?
Вопрос 1
К какому типу
реакций относится реакция
нейтрализации?
Вопрос 2
С какими веществами вступают
в реакции обмена
нерастворимые основания?Вопрос 3
Какие вещества образуется
в реакции обмена между
карбонатом калия и соляной кислотой ?
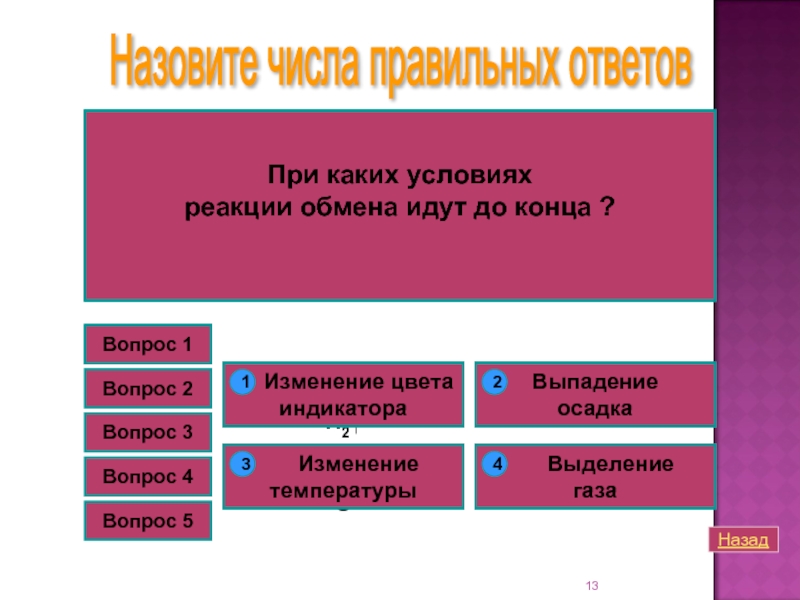
Вопрос 4
При каких условиях
реакции обмена идут до конца ?
Вопрос 5
Назад
Назовите числа правильных ответов