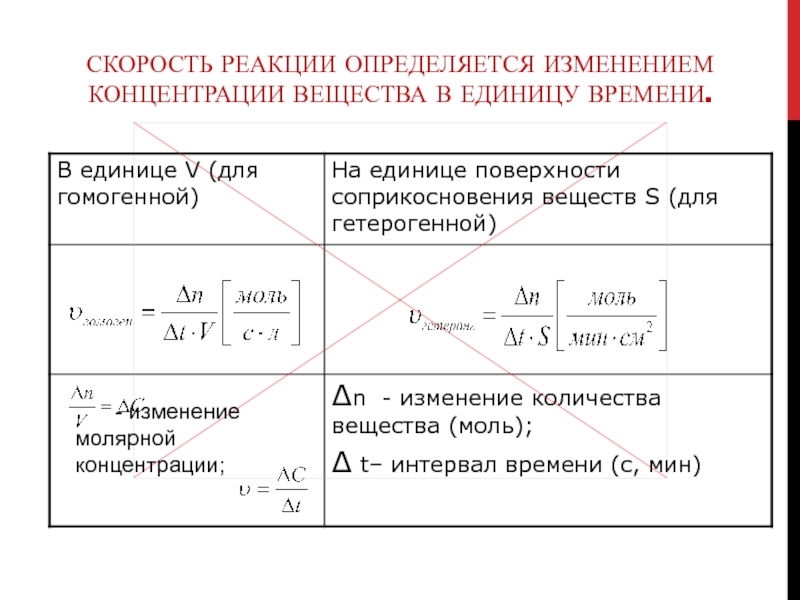
ФАКТОР
Суть: реакции происходят при столкновении частиц реагентов, которые обладают определённой
энергией.
Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
К реакции приводят лишь эффективные соударения, т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать достаточной энергией.
Минимальный избыток энергии (над средней энергией частиц в системе), необходимый для эффективного соударения частиц в системе), необходимый для эффективного соударения частиц реагентов, называется энергией активации Еа.
Суть: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией.
Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
К реакции приводят лишь эффективные соударения, т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать достаточной энергией.
Минимальный избыток энергии (над средней энергией частиц в системе), необходимый для эффективного соударения частиц в системе), необходимый для эффективного соударения частиц реагентов, называется энергией активации Еа.