Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химиялы? те?деу бойынша , бір зат арты? болатын есептеулер.
Содержание
- 1. Химиялы? те?деу бойынша , бір зат арты? болатын есептеулер.
- 2. Химиялық теңдеу бойынша , бір зат артық болатын есептеулер.
- 3. Сабақтың мақсаты: Оқушылардың металдардың жалпы қасиеттері тарауы
- 4. І топ Cu - Мыс ІI топ Zn - Мырыш ІII топ Fe - Темір
- 5. 1. Литий, натрий сілтілік металдарға жатады.2. Су
- 6. І топ Cu – сипаттамаІI топ Zn - сипаттамаІII топ Fe - сипаттама«Қиял әлемі»
- 7. ІІ топ 13 г мырыш 24,5 г
- 8. Шешуі: Сu + 4HNO3→ Cu(NO3)3
- 9. Шешуі:Zn + Н2SO4→ ZnSO4 + Н2М(Zn) =
- 10. Шешуі: Ғе + S →
- 11. Іздесең табасың, талаптансаң - жетесің, зейін салсаң
- 12. Шешуі:2Cu+ O2 = 2CuOCuO + HCI= CuCI2
- 13. Шешуі:2Cu+ O2 = 2CuOCuO + HCI= CuCI2
- 14. Шешуі:2 Zn + O2 = 2ZnO ZnO
- 15. Шешуі:Fe + CI2 FeCI2FeCI2 + NaOH
- 16. Бағалау. Үйге тапсырмаКелесі тақырыпты оқып келу.
- 17. РЕФЛЕКСИЯнені білесің?нені білдің?нені білгің келеді?
- 18. Көңіл аударып, белсенді қатысқандарыңызға рахмет!
- 19. Табыс критерийлері
- 20. Сандық есептер шығару
- 21. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Онтүстік Қазақстан облысы. Мақтарал ауданы. «Көктөбе» ауылы. № 19 М.Мақатаев атындағы жалпы
орта мектебі коммуналдық мемлекеттік мекемесінің
химия пәнінің мұғалімі
Битабарова Хадиша Исабековна.
Слайд 3Сабақтың мақсаты: Оқушылардың металдардың жалпы қасиеттері тарауы бойынша алған білімдерін
жүйелеу және қорытындылау. Сандық есептер шығару дағдысын қалыптастыру. Күтілетін нәтиже:
Оқушылар сын тұрғысынан ойланып, бір-бірімен диалогқа түсіп, тапсырмаларды топпен орындайды. Формативті және критериалды бағалау арқылы білімдерін қорытындылайды.Слайд 5
1. Литий, натрий сілтілік металдарға жатады.
2. Су бетінде жүзген металл
деп калийді айтады.
3. Натрий иондары жалынды сары түске бояйды.
4. Натрий
карбонаты тамаққа қосылады.5. Радиоактивті металл радийді ерлі-зайыпты Кюрилер ашты.
6. 2,4г магнийдің зат мөлшері 0,1 мольге тең.
7. Тістің және сүйектің негізін магний тұздары құрайды.
8. Уақытша кермектіктің құрамында кальций және магний
гидрокарбонаттары болады.
9. Мыс иондарын сілті арқылы анықтауға болады.
10. Темір тікелей хлормен қосылғанда темірдің ІІ хлориді түзіледі.
11. Шаштың ағаруы мыс иондарының жетіспеушілігінен
12. Қанға қызыл түс беретін темірдің ІІ ионы
Графикалық диктант.
__ ^ __ ^ __ __ ^ __ __ ^ __ ^
1 2 3 4 5 6 7 8 9 10 11 12
Слайд 7ІІ топ
13 г мырыш 24,5 г күкірт қышқылымен әрекеттескенде
түзілген сутегінің (қ.ж.) көлемі (л)
I топ
Массасы 30 г
мыс пен алюминий қоспасына концентрлі азот қышқылымен әсер еткенде 13,44 л газ (қ.ж.) бөлінді. Қоспаның құрамы ІІI топ
Реакция нәтижесінде темір (ІІ) сульфиді түзілген болса, 100,8 г темірмен әрекеттескен күкірттің массасы (г)
«Қане ойланайық...»
сандық есептер шығару
Слайд 8
Шешуі:
Сu + 4HNO3→ Cu(NO3)3 + 2NO2↑ +
Н2О
М(Cu)= 64 г/моль
m(Cu) =
ν · М(Cu) = 1 моль · 64 г/моль = 64 гVm = 22,4 л/моль
V(NO2) = ν · Vm = 2 моль · 22,4 л/моль = 44,8 л
х г Cu -----13,44 л NO2
64 г Cu ----44,8 л NO2
m(АІ) = 30 г – 19,2 г = 10,8 г
m(Cu) = 19,2 г; m(АІ) = 10,8 г
Слайд 9
Шешуі:
Zn + Н2SO4→ ZnSO4 + Н2
М(Zn) = 65 г/моль
m(Zn) =
ν · М(Zn) = 1 моль · 65 г/моль =
65 гМ(H2SO4) = 98 г/моль
ν(Zn) > ν(H2SO4)
Vm = 22,4 л/моль
V(Н2) = ν · Vm = 1 моль · 22,4 л/моль
13 г Zn ----- х л Н2
65 г Zn ---- 22,4 л Н2
Слайд 10
Шешуі:
Ғе + S → ҒеS
М(Ғе)
= 56 г/моль
m(Ғе) = ν · М(Ғе) =
1 моль · 56 г/моль = 56 гМ(S) = 32 г/моль
m(S) = ν · М(S) = 1 моль · 32 г/моль = 32 г
100,8 г Ғе ----- х г S
56 г Ғе ---- 32 г S
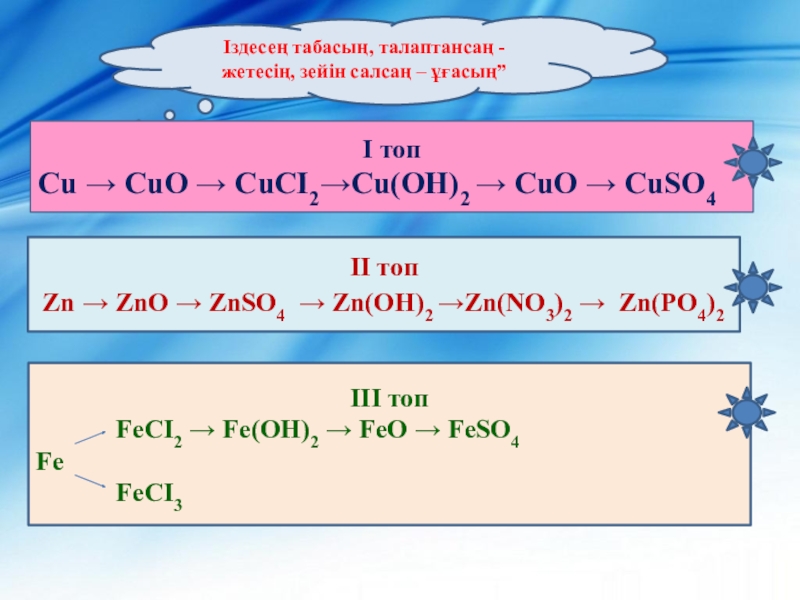
Слайд 11Іздесең табасың, талаптансаң - жетесің, зейін салсаң – ұғасың”
І топ
Cu → CuO → CuCI2→Cu(OH)2 → СuO → CuSO4
ІI
топ Zn → ZnO → ZnSO4 → Zn(OH)2 →Zn(NO3)2 → Zn(PO4)2
ІII топ
FeCI2 → Fe(OH)2 → FeO → FeSO4
Fe
FeCI3
Слайд 12
Шешуі:
2Cu+ O2 = 2CuO
CuO + HCI= CuCI2 + H2O
CuCI2 +
2NaOH = Cu(OH)2 + 2NaCI
Cu(OH)2 CuO + H2O
CuO +
H2SO4 CuSO4 + H2OСлайд 13
Шешуі:
2Cu+ O2 = 2CuO
CuO + HCI= CuCI2 + H2O
CuCI2 +
2NaOH = Cu(OH)2 + 2NaCI
Cu(OH)2 CuO + H2O
CuO +
H2SO4 CuSO4 + H2OСлайд 14
Шешуі:
2 Zn + O2 = 2ZnO
ZnO + H2SO4 =ZnSO4
+ H2O
ZnSO4 + 2KOH = Zn(OH)2 + K2SO4
Zn(OH)2 +2HNO3 =
Zn(NO3)2 + 2H2O3Zn(NO3)2 +2H3PO4 = Zn3(PO4)2↓ + 6HNO3
Слайд 15
Шешуі:
Fe + CI2 FeCI2
FeCI2 + NaOH NaCI +
Fe(OH)2↓
Fe(OH)2 FeO + H2O
FeO + H2SO4 FeSO4 +
H2O2Fe + 3CI2 2FeCI3
Слайд 19 Табыс критерийлері
«Сандық есептер шығару»
1 Реакцияны
жүзеге асыра білу3 Қосылыстың формуласын таба білу
4 Берілген масса бойынша пропорция құра отырып екінші заттың массасын табу
Табыс критерийлері
«Сандық есептер шығару»
1 Реакцияны жүзеге асыра білу
3 Қосылыстың формуласын таба білу
4 Берілген масса бойынша пропорция құра отырып екінші заттың массасын табу