Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Изменения, происходящие с веществами 9 класс
Содержание
- 1. Изменения, происходящие с веществами 9 класс
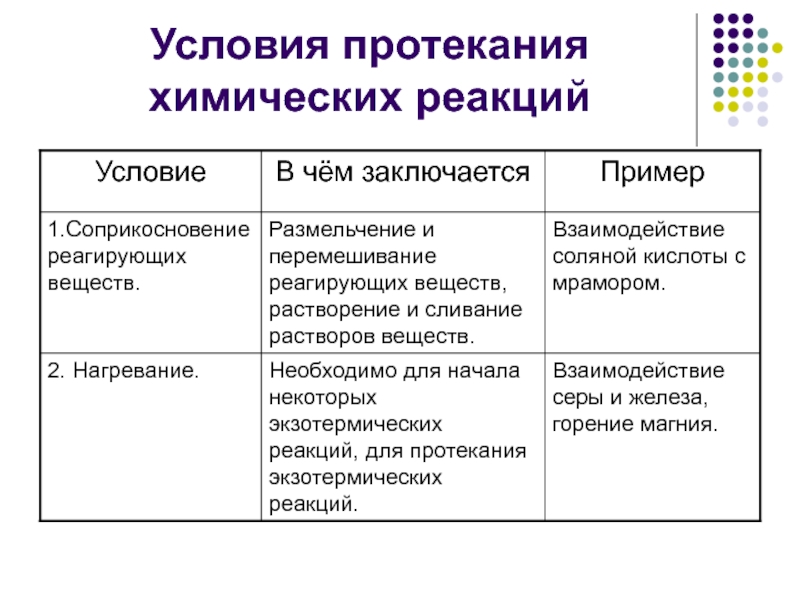
- 2. Условия протекания химических реакций
- 3. Взаимопревращение различных видов энергии в химических реакциях.
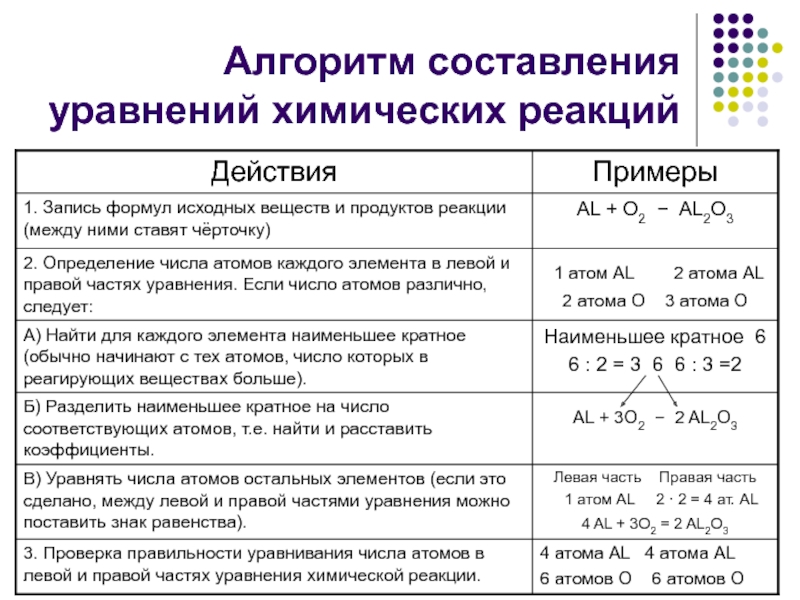
- 4. Алгоритм составления уравнений химических реакций
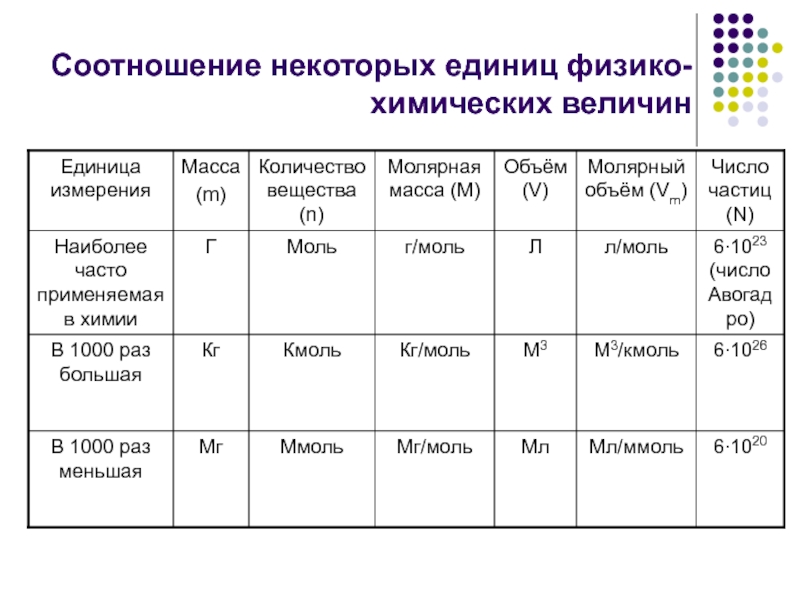
- 5. Соотношение некоторых единиц физико-химических величин
- 6. 1. Запишите краткое условие задачи.Дано:
- 7. Вариант 1.1. Очистка веществ методом дистилляции основана
- 8. Карточка №1.Сколько литров кислорода образуется из 200г
- 9. 1) SO2 + H2O → H2SO32) CuSO4
- 10. Слайд 10
- 11. Слайд 11
- 12. Скачать презентанцию
Условия протекания химических реакций
Слайды и текст этой презентации
Слайд 1Учебно-методический комплекс по теме «Изменения, происходящие с веществами»
Разработан по программе
курса химии для 8-9 класса базового уровня образования, составленной
ГабриеляномСлайд 61. Запишите краткое условие задачи.
Дано:
Решение:
m(Mg) = 6г 2. Составьте уравнение химической реакции. Расставьте в нём
коэффициенты. Подчеркните вещества, необходимые для решения
m(MgO) = ? задачи.
ν(MgO) = ? 2Mg + O2 = 2MgO
3. Под формулами необходимых веществ в уравнении запишите их количественные соотношения – данные по уравнению реакции с соответствующими единицами величин.
2Mg + O2 = 2MgO
2моль 2моль
24г/моль 40г/моль
4. Над формулами необходимых веществ запишите значения известных величин - данные по условию задачи с соответствующими единицами величин. Обозначьте неизвестные величины.
6г Хг
2Mg + O2 = 2MgO
2моль 2моль
24г/моль 40г/моль
5. Вычислите массы необходимых веществ по уравнению реакции, используя формулу . Запишите полученные данные с соответствующими единицами величин под формулами веществ в уравнении.
т(Мg) = 2моль ∙ 24г/моль = 48г
т(MgО) = 2 моль ∙ 40г/моль = 80г
Уравнение примет вид:
6г Хг
2Mg + O2 = 2MgO
2моль 2моль
24г/моль 40г/моль
48г 80г
6. Установите пропорциональную зависимость.
48г Mg 80г MgО
6г Mg Хг MgО
7. Составьте и решите пропорцию.
48 : 6 = 80 : Х
=> m(MgO) = 10г.
8. Используя полученные данные, вычислите оставшиеся неизвестные величины.
9. Запишите ответ.
Ответ: 10г MgО, 0,25моль MgО
Слайд 7Вариант 1.
1. Очистка веществ методом дистилляции основана на
1) различии
плотности веществ.
2) различии температур кипения веществ.
3) различии температур плавления веществ.
4)
различии растворимости веществ.2. Какое явление относится к химическим явлениям?
1) Гром во время грозы.
2) Приготовление яичницы на сковороде.
3) Испарение воды.
4) Образование сосулек.
3. Обязательным условием для протекания химической реакции является
1) растворение веществ.
2) сливание растворов веществ.
3) измельчение веществ.
4) предварительная очистка веществ от примесей.
4. Закон сохранения массы веществ гласит:
1) масса веществ, вступивших в химическую реакцию, превышает массу веществ, получившихся в результате реакции.
2) масса веществ, вступивших в химическую реакцию, меньше массы веществ, получившихся в результате реакции.
3) масса веществ, вступивших в химическую реакцию, равна массе веществ, получившихся в результате реакции.
4) масса веществ, вступивших в реакцию и образовавшихся в результате её, зависит от условий протекания данной реакции.
5. Коэффициенты расставлены правильно в следующем уравнении реакции:
1) 3С2Н6 + О2 → 3СО2 + 9Н2О
2) 2С2Н6 + 7О2 → СО2 + 3Н2О
3) С2Н6 + 3О2 → 2СО2 + 3Н2О
4) 2С2Н6 + 7О2 → 4СО4 + 6Н2О
Задача: рассчитайте массу и количество вещества кислорода, образующегося при разложении 3,6г воды.
Слайд 8Карточка №1.
Сколько литров кислорода образуется из 200г бертолетовой соли
KCIO3
по реакции
2KCIO3 = 2KCI + 3O2? К какому типу
относится данная реакция?Карточка№2.
Найдите объём углекислого газа, который выделится при горении 186л болотного газа СН4 по реакции СН4 + 2О2 = СО2 + 2Н2О.
Карточка №3.
Какой объём углекислого газа выделится при разложении 123г мела по реакции СаСО3 = СаО + СО2↑ К какому типу относится данная реакция?
Карточка №4.
Уксус – 6-9% водный раствор уксусной кислоты СН3СООН, кальцинированная сода – Na2СО3. Сколько литров углекислого газа выделится при взаимодействии 23г кальцинированной соды с необходимым количеством уксуса по реакции
2СН3СООН + Na2CO3 = 2CH3COONa + CO2↑ + Н2О?
Карточка №5.
Сколько грамм нашатыря NH4CI можно получить при взаимодействии 34г соляной кислоты с необходимым количеством гидроксида аммония NH4OH по реакции
NH4OH + HCI = NH4CI + H2O?
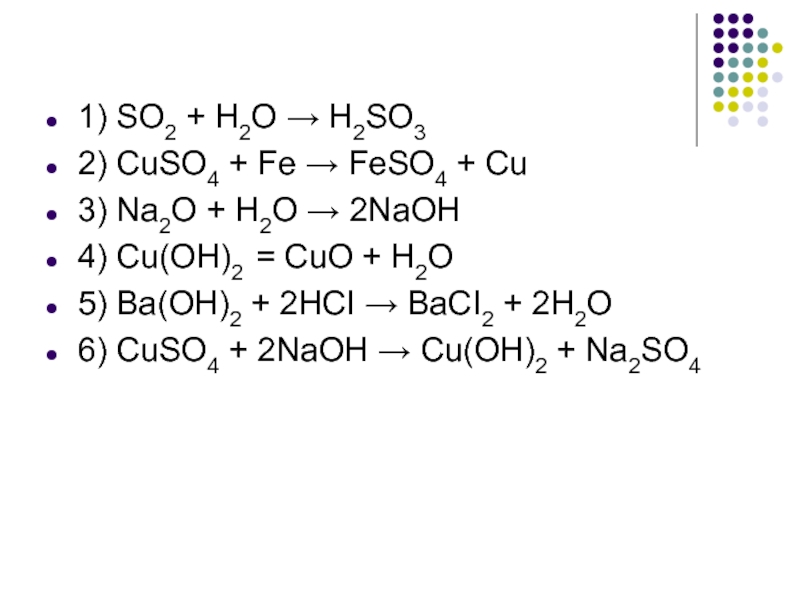
Слайд 91) SO2 + H2O → H2SO3
2) CuSO4 + Fe →
FeSO4 + Cu
3) Na2O + H2O → 2NaOH
4) Cu(OH)2 =
СuO + H2O5) Ba(OH)2 + 2HCI → BaCI2 + 2H2O
6) CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4