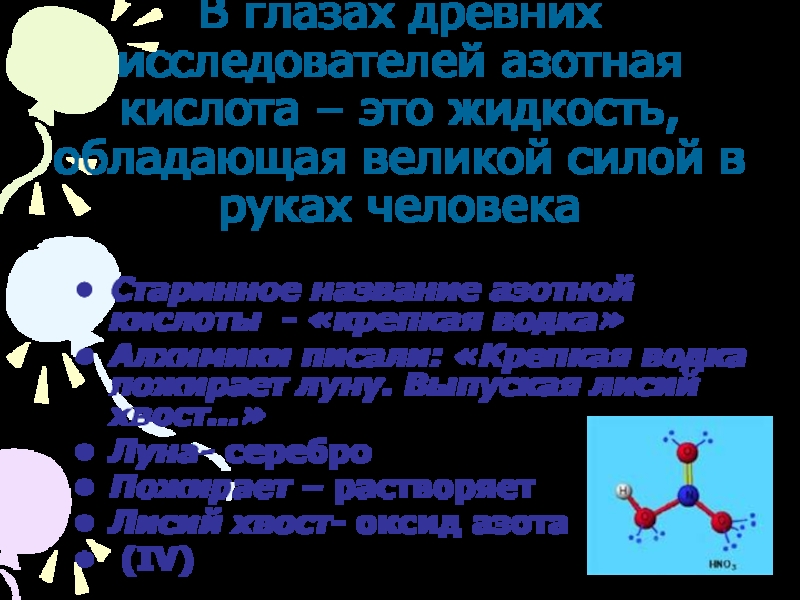
азота»
Повторить свойства азотной кислоты
Закрепить особенности взаимодействия азотной кислоты с
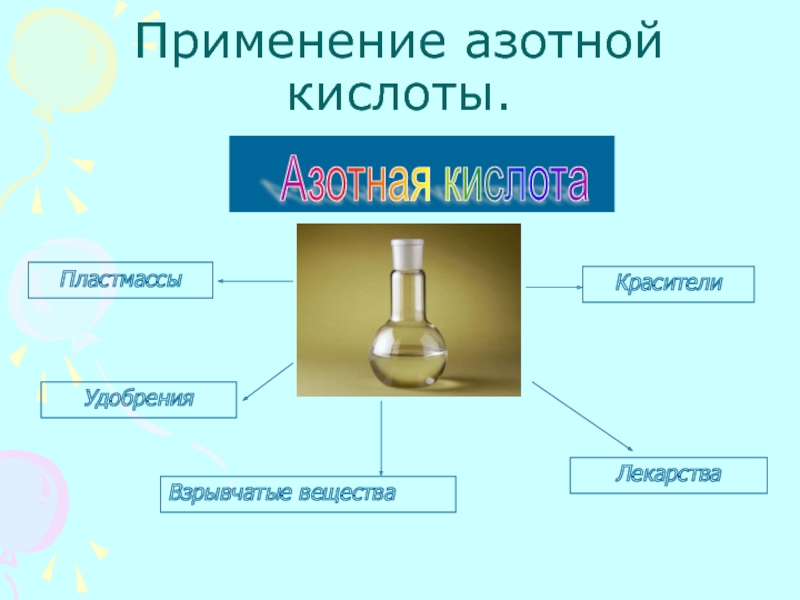
металлами и неметалламиРассмотреть получение и применение азотной кислоты