Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Көміртек және оның қосылыстары
Содержание
- 1. Көміртек және оның қосылыстары
- 2. Химия9 - сынып Көміртек, оның қосылыстарыС
- 3. Сабақтың мақсаты:Білімділік: Көміртек және оның қосылыстары туралы
- 4. Оқу нәтижелері: 1. Көміртектің атом құрылысы ,
- 5. Тапсырма беріліп, таныстырылым жасалады1 топ. Төмендегі сұрақтарға
- 6. IV топтың негізгі топша элементтеріне салыстырмалы
- 7. Атом құрылысы+6С)2е )4еКөміртек атомының электрондық формуласы:
- 8. Табиғатта таралуы
- 9. Физикалық қасиеті Алмаз ең
- 10. Көмірдің / әсіресе ағаш көмірінің / адсорбциялық
- 11. Көміртектің химиялық қасиетіКөміртек көптеген жай заттармен оңай
- 12. Химиялық қасиеттеріКөміртектің күрделі заттармен әрекеттесуі: 1) Сумен
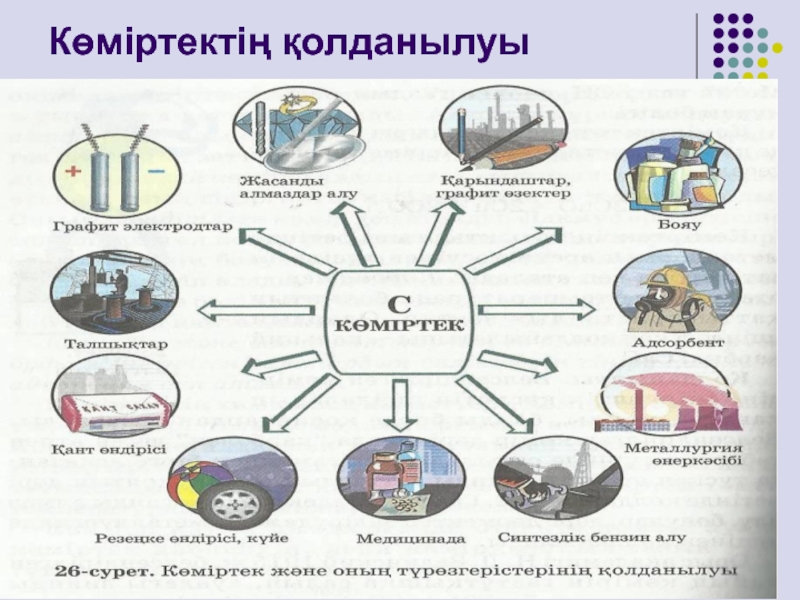
- 13. Көміртектің қолданылуы
- 14. ҚолданылуыОрыс академигіН.Д. Зелинский1915ж белсендірілгенқайың көмірін газтұтқышқа салып,
- 15. Көмір қышқылы және карбонаттарФизикалық қасиеттеріКөміртек (II) оксиді
- 16. Химиялық қасиеттеріСілтілермен орта және қышқыл тұздар түзеді:
- 17. Карбонаттар химиялық қасиеттеріҚыздырғанда ыдырайды: СаСО
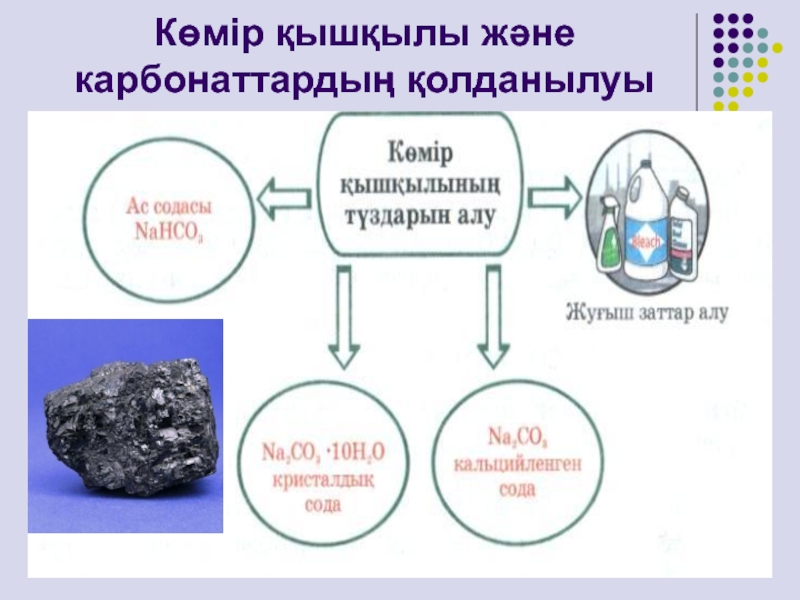
- 18. Көмір қышқылы және карбонаттардың қолданылуы
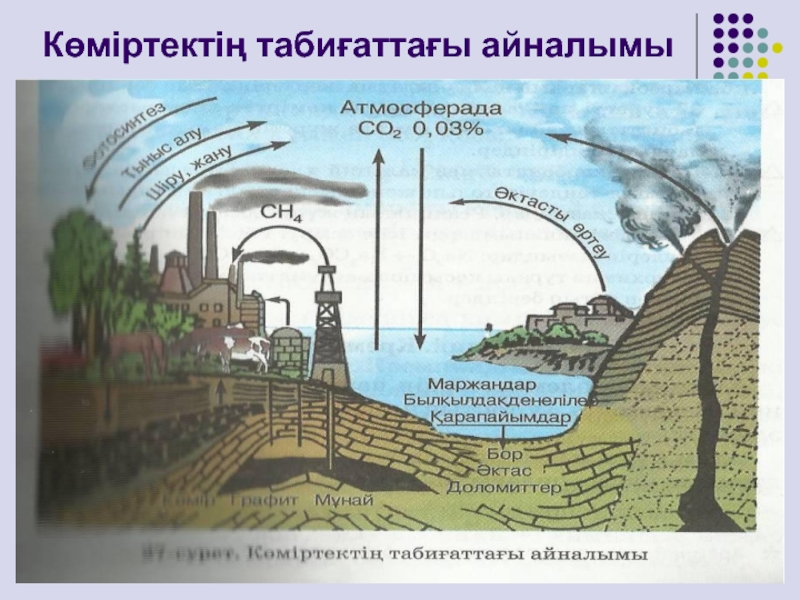
- 19. Көміртектің табиғаттағы айналымы
- 20. Есеп шығару№8 Натрий карбонаты мен кальций хлориді
- 21. Көміртектің аллотропиялық түр өзгерістері. Аллотропия – (грекше
- 22. Үйге тапсырма22- 23 тақырып 1-7 сұрақтар
- 23. Скачать презентанцию
Химия9 - сынып Көміртек, оның қосылыстарыС
Слайды и текст этой презентации
Слайд 3Сабақтың мақсаты:
Білімділік: Көміртек және оның қосылыстары туралы мәлімет алады
Дамытушылық: Сыни
ойлау қабілеті дамиды
Тәрбиелік: Топтық жұмыс арқылы ынтымақтастыққа тәрбиеленеді.
Слайд 4Оқу нәтижелері:
1. Көміртектің атом құрылысы , табиғатта кездесуі, физикалық
және химиялық қасиеттері, қолданылуы туралы біледі.
2. Көміртектің маңызды қосылыстары, алынуы,
физикалық және химиялық қасиеттері, қолданылуы туралы біледі3. Көміртектің маңызды қосылыстары тақырыбында есептер шығара алады.
4. Көміртектің аллотропиялық түрөзгерістерін салыстыра алады.
5. Көміртектің табиғаттағы айналымы, маңызы, физиологиялық әсері туралы жоба жасау
Слайд 5Тапсырма беріліп, таныстырылым жасалады
1 топ. Төмендегі сұрақтарға жауап беру арқылы
таныстырылым жасайды.
Көміртектің атом құрылысы , табиғатта кездесуі, физикалық және
химиялық қасиеттері, қолданылуы2 топ. Көміртектің маңызды қосылыстары, алынуы, физикалық және химиялық қасиеттері, қолданылуы
Формативті бағалау /өзара бағалау/
Слайд 6 IV топтың негізгі топша элементтеріне салыстырмалы сипаттама
2s22p2
3s23p2
4s24p2
5s25p2
6s26p2
C
Si
Ge
Sn
Pb
12
28
73
119
207
))
)))))
)))
))))))
)))))))
Т
Өме
Н
Д
Е
Й
Д
і
Т
Өме
Н
Д
Е
Й
Д
і
CO2,
H2CO3
қышқылдық
қасиет
SiO2, H2SiO3
қышқылдық
қасиет
GеO2, Gе(OH)4
амфотерлі
қасиет
РbO4, Pb(OH)4
амфотерлі
қасиет
SnO2, Sn(OH)4
амфотерлі қасиет
Слайд 7Атом құрылысы
+6С)2е )4е
Көміртек атомының электрондық формуласы:
1S2 2S2
2P2
Графиктік формуласы:
1S 2S 2PКөміртек қосылыстағы тотығу
дәрежелері: -4, +2, +4
Слайд 8Табиғатта
таралуы
Көміртек бос
күйінде алмазКөміртек бос күйінде алмаз, графитКөміртек бос күйінде алмаз, графит,
карбинКөміртек бос күйінде алмаз, графит, карбин деп аталатын аллотропиялық күйлерінде кездеседі. Табиғи қосылыстары карбонаттар (СаСО3 • MgCО3 - доломит, СаСО3 - мәрмәр - мәрмәр, MgCО3 - магнезит - мәрмәр, MgCО3 - магнезит). Байланысқан күйде көмірде, мұнайда, табиғи газдарда кездеседі. Бос күйінде көміртек улы емес, ал оның қосылыстары CO - иіс газы, ССl4 - төрт хлорлы көміртек, CS3 — күкіртті — күкіртті көміртек улы заттар. Аллотропиялық түр өзгерістері кристалдық торларының әр түрлілігімен сипатталады.Слайд 9Физикалық қасиеті
Алмаз ең қатты затАлмаз ең
қатты зат, графит майАлмаз ең қатты зат, графит май тәрізді
жылтыр сұр түсті жұмсақ зат. Графит 2000°С-да, төменгі қысымдаАлмаз ең қатты зат, графит май тәрізді жылтыр сұр түсті жұмсақ зат. Графит 2000°С-да, төменгі қысымда карбинге айналады. Жаңадан алынған фуллерен деген түрі де бар, ол футболАлмаз ең қатты зат, графит май тәрізді жылтыр сұр түсті жұмсақ зат. Графит 2000°С-да, төменгі қысымда карбинге айналады. Жаңадан алынған фуллерен деген түрі де бар, ол футбол добы сияқты құрылыстыАлмаз ең қатты зат, графит май тәрізді жылтыр сұр түсті жұмсақ зат. Графит 2000°С-да, төменгі қысымда карбинге айналады. Жаңадан алынған фуллерен деген түрі де бар, ол футбол добы сияқты құрылысты болады. Көміртектің бұл түр өзгерістерінеАлмаз ең қатты зат, графит май тәрізді жылтыр сұр түсті жұмсақ зат. Графит 2000°С-да, төменгі қысымда карбинге айналады. Жаңадан алынған фуллерен деген түрі де бар, ол футбол добы сияқты құрылысты болады. Көміртектің бұл түр өзгерістеріне аморфты көміртекті қосуға болады. Оны ағашАлмаз ең қатты зат, графит май тәрізді жылтыр сұр түсті жұмсақ зат. Графит 2000°С-да, төменгі қысымда карбинге айналады. Жаңадан алынған фуллерен деген түрі де бар, ол футбол добы сияқты құрылысты болады. Көміртектің бұл түр өзгерістеріне аморфты көміртекті қосуға болады. Оны ағаш көмірін, тас көмірді ауа қатысынсыз құрғақ айдау арқылы алады. Сонда алынған көмірде өз бетіне газдарды, сұйықтарды сіңіретін қасиетАлмаз ең қатты зат, графит май тәрізді жылтыр сұр түсті жұмсақ зат. Графит 2000°С-да, төменгі қысымда карбинге айналады. Жаңадан алынған фуллерен деген түрі де бар, ол футбол добы сияқты құрылысты болады. Көміртектің бұл түр өзгерістеріне аморфты көміртекті қосуға болады. Оны ағаш көмірін, тас көмірді ауа қатысынсыз құрғақ айдау арқылы алады. Сонда алынған көмірде өз бетіне газдарды, сұйықтарды сіңіретін қасиет (адсорбция) пайда болады.Слайд 10Көмірдің / әсіресе ағаш көмірінің / адсорбциялық қабілеті жоғары. Адсорбция
деп көмірдің немесе басқа қатты не сұйық заттардың өз бетінде
газ, бу, т.б еріген заттарды сіңіру қабілетін айтады. Беттерінде адсорбция жүретін заттарды адсорбенттер, ал сіңірілетін заттарды адсорбаттар деп атайды. Егер, мысалы, алдымен сия ерітіндісіне ұсақ ұнтақталған көмір қосып шайқап, сосын сүзсек, филтратта түссіз сұйықтық су қалады.Себебі еріген сия молекулаларын көмір сіңіріп алады.Мұнда: көмір-адсорбент, бояу-адсорбат.
АДСОРБЦИЯ
Слайд 11Көміртектің химиялық қасиеті
Көміртек көптеген жай заттармен оңай әрекеттеседі.
1) Жану реакциясы:
a)
2С + О2 = 2СО
ә) С + О2 = CO2
2)
Хлормен2) Хлормен әрекеттескенде көміртек тек жарық2) Хлормен әрекеттескенде көміртек тек жарық сәулесінің әсерінен төрт хлорлы көміртек түзіледі:С + 2Cl2= CCl4 (бағалы еріткіш) өрт сөндіруде қолданылады.
3) Металдармен3) Металдармен әрекеттесіл карбидтер түзеді:
2С + Са = СаС2 (бұдан ацетилен алынады)
4) Күкіртпен күкіртті көміртек түзеді:
С + 2S = CS2 (еріткіш)
5) Сутекпен әрекеттескенде метан түзіледі:
С + 2Н2→СН4 (отын - ол табиғи газдың негізгі
құрам бөлігі)
Слайд 12Химиялық қасиеттері
Көміртектің күрделі заттармен әрекеттесуі:
1) Сумен әрекеттескенде газдар коспасы
(су газы) бөлінеді:
С + Н2О
= CO + Н2 (су газы - бағалы отын)Алынған газдардың екеуі жанғыш болғандықтан
жылу көбірек бөлінеді. Сондықтан көмірді
жаққанда сулау қажет.
2) Концентрлі күкірт және азот қышқылдарымен әрекеттескенде тотығады:
С + 4HNО3(конц)=СО2+4NO2+2Н2O
3) С+ 2H2SО4(конц) = СО2+2SO2+2Н2O
Слайд 14Қолданылуы
Орыс академигі
Н.Д. Зелинский1915ж
белсендірілген
қайың көмірін
газтұтқышқа салып,
ауадағы зиянды
қоспалардан
тыныс
алу мүшелерін сақтау
үшін қолдануды ұсынған.
Слайд 15Көмір қышқылы және карбонаттар
Физикалық қасиеттері
Көміртек (II) оксиді СО - түссіз,
иіссіз, дәмсіз, ауадан сәл жеңіл, улы газ. Суда нашар ериді
Көміртек
(IV) оксиді СО2 - иіссіз, түссіз, ауадан 1,5 есе ауыр газ. Молекуласы сызықтық құрылысты: О=С=ОСлайд 16Химиялық қасиеттері
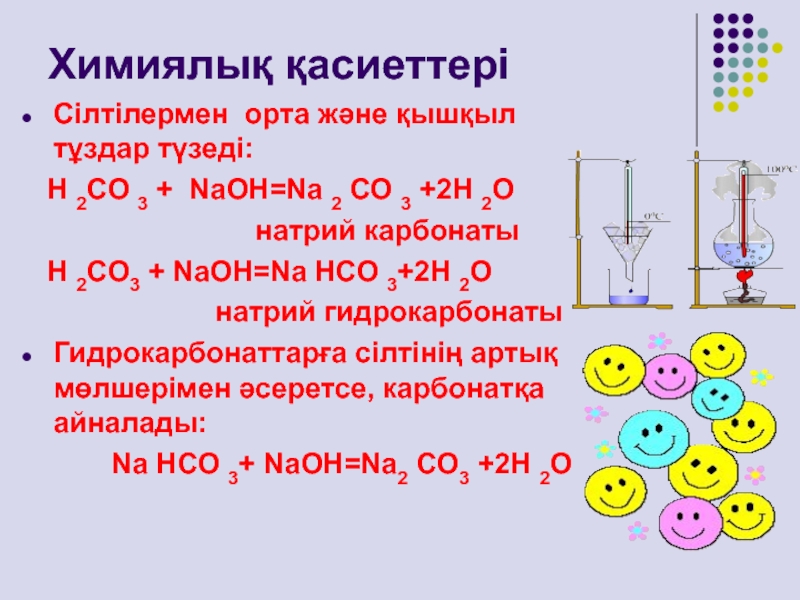
Сілтілермен орта және қышқыл тұздар түзеді:
Н 2СО
3 + NаОН=Nа 2 СО 3 +2Н 2О
натрий карбонатыН 2СО3 + NаОН=Nа НСО 3+2Н 2О
натрий гидрокарбонаты
Гидрокарбонаттарға сілтінің артық мөлшерімен әсеретсе, карбонатқа айналады:
Nа НСО 3+ NаОН=Nа2 СО3 +2Н 2О
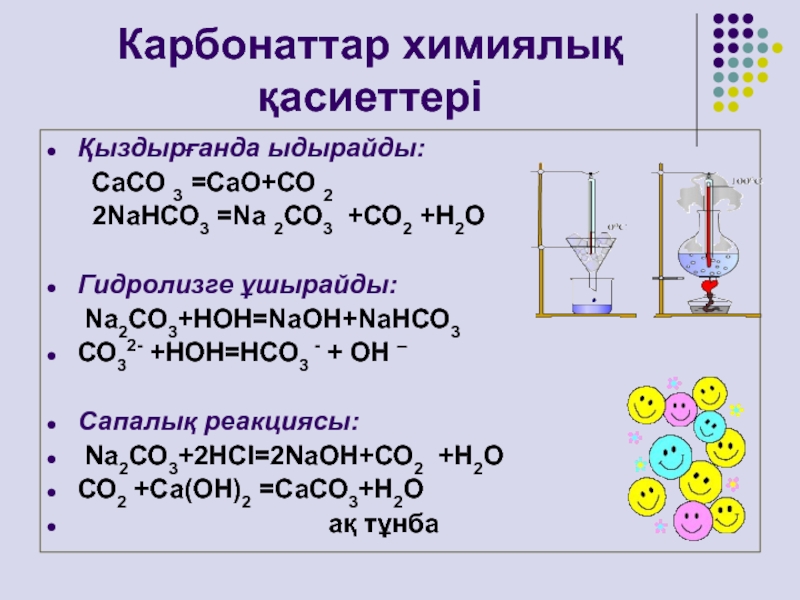
Слайд 17Карбонаттар химиялық қасиеттері
Қыздырғанда ыдырайды:
СаСО 3 =СаО+СО 2
2NаНСО3 =Nа 2СО3 +СО2 +Н2О
Гидролизге ұшырайды:
Nа2СО3+НОН=NаОН+NаНСО3СО32- +НОН=НСО3 - + ОН –
Сапалық реакциясы:
Nа2СО3+2НСl=2NаОН+СО2 +Н2О
СО2 +Са(ОН)2 =СаСО3+Н2О
ақ тұнба
Слайд 20Есеп шығару
№8
Натрий карбонаты мен кальций хлориді арасында жүретін
реакция теңдеуін толық және қысқартылған иондық теңдеу түрінде жазыңдар
№9
Төмендегі
айналымдарды іске асыруға болатын реакция теңдеулерін жазыңдар:Na2O-Na2CO3-NaHCO3-Na2CO3-CO2
Слайд 21Көміртектің аллотропиялық түр өзгерістері.
Аллотропия – (грекше allos - өзге және
tropos – бұрылыс, қасиет ) химиялық
элементтердің бірнеше жай заттар
түрінде болуы. Қазақша тұрпаттастық деп аталады.алмаз
графит
карбин