Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Эффективные и нетрудоемкие способы регенерации серебра из отходов
Содержание
- 1. Эффективные и нетрудоемкие способы регенерации серебра из отходов
- 2. Слайд 2
- 3. Физические свойства серебра
- 4. Химические свойства серебра Из благородных металлов
- 5. Получение серебра
- 6. Эффективные и нетрудоемкие способы получения серебра
- 7. Получение серебра. Реакция «серебряное зеркало»
- 8. Получение серебра. Реакция «серебряное зеркало»2Ag+ + 2OH-
- 9. Получение серебра из зеркального боя Зеркальный
- 10. Восстановление серебра металламиВосстановление серебра металлами основано
- 11. Восстановление серебра металлами Преимущества процесса – дешевизна
- 12. Восстановление серебра из фотопленки Для восстановления
- 13. Восстановление серебра из фотоматериалов
- 14. Восстановление серебра магнием Реакции происходит с
- 15. Восстановление серебра магниемНитрат серебра –ценный компо-нент, поэтому
- 16. Слайд 16
- 17. Скачать презентанцию
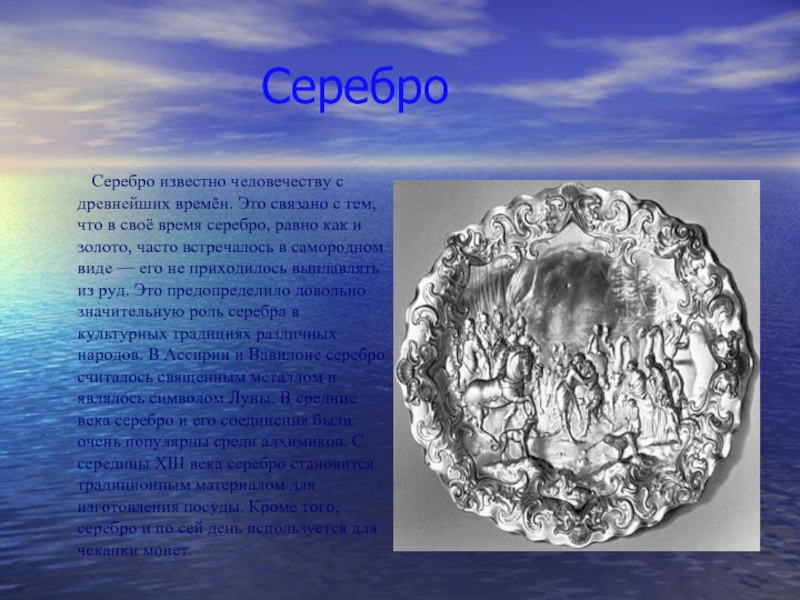
Серебро Серебро известно человечеству с древнейших времён. Это связано с тем, что в своё время серебро, равно как и золото,
Слайды и текст этой презентации
Слайд 1Эффективные и нетрудоемкие способы регенерации
серебра из отходов
Владимирова Ирина Алексеевна
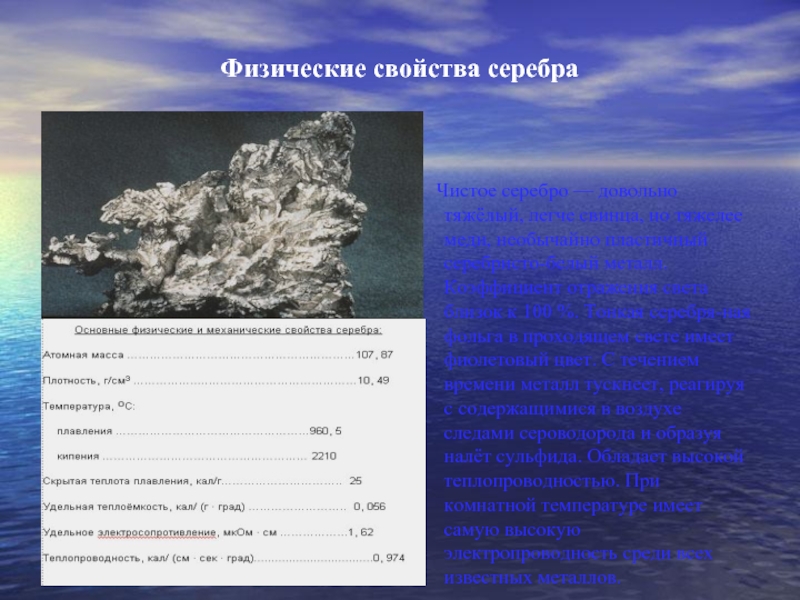
Слайд 3Физические свойства серебра
Чистое
серебро — довольно тяжёлый, легче свинца, но тяжелее меди, необычайно
пластичный серебристо-белый металл. Коэффициент отражения света близок к 100 %. Тонкая серебря-ная фольга в проходящем свете имеет фиолетовый цвет. C течением времени металл тускнеет, реагируя с содержащимися в воздухе следами сероводорода и образуя налёт сульфида. Обладает высокой теплопроводностью. При комнатной температуре имеет самую высокую электропроводность среди всех известных металлов.Слайд 4Химические свойства серебра
Из благородных металлов серебро наиболее реакционноспособный.
Серебро химически мало активно и легко вытесняется из своих соединений
более активными металлами. Углем, Н2 и другими восстановителями ионы серебра восстанавливаются до Ag0. При комнатной температуре серебро . не взаимодействует с О2 воздуха, но при нагревании до 170°С покрывается пленкой оксида Ag2OСлайд 8Получение серебра. Реакция «серебряное зеркало»
2Ag+ + 2OH- = Ag2O +
H2O
2Ag2O + 4NH3 + H2O = [Ag(NH3)2]OH
Кроме того, формальдегид
и аммиак будут между собой взаимодейство-
вать с образованием белого осадка
уротропина (гексаметилентетрамина):
6CH2O + 4NH3 = (CH2)6N4 + 6H2O
Слайд 9Получение серебра из зеркального боя
Зеркальный бой и елочные
игруш-ки также содержат большое коли-чество серебра: зеркала - от 3
до 7 г/кв.м, игрушки - от 0,2 до 0,5% от массы осколков. Для снятия серебросодержащего слоя с зер-кального боя его помещают в кислотоустойчивую емкость, зали-вают горячим раствором соляной кислоты и подвергают механи-ческой обработке: проще говоря, ворошат до полного отделения серебросодержащего слоя от стекла. В промышленности для этой цели применяют вращаю-щийся барабан.Слайд 10Восстановление серебра металлами
Восстановление серебра металлами основано на выделении металлического
серебра из растворов его солей большинством других металлов. Наибольшее применение
для этой цели полу-чили железо, алюминий, цинк, которые используются в виде стружки, опилок или пыли (отходы производства). Стружку перед применением обезжиривают в 3%-ном растворе щелочи.Скорость процесса восстановления возрастает с увеличением поверхности соприкосновения металла с раствором, а также при перемешивании
Слайд 11Восстановление серебра металлами
Преимущества процесса –
дешевизна и высокое содержа-
ние
серебра в осадке;
недостатки - длительность,
необходимость периодического перемешивания
Слайд 12Восстановление серебра из фотопленки
Для восстановления серебра из золы
фотоматериалов вам понадобится муфельная печь и термостойкие тигли, спо-собные выдержать
тысяче-градусную температуру. Зола тщательно перемешивается с содой и битым стеклом в следующих соотношениях: 30% золы, 65% двуугле-кислого натрия и 5% битого стекла.Слайд 13Восстановление серебра из фотоматериалов
Составленная таким образом
шихта спекается при темпе-ратуре 1200°С. Расплав выливают в чугунную излож-ницу,
смазанную порошком окиси железа. Можно осту-дить расплав и в тигле, но потом его придется разби-вать, а на дне у вас окажется слиток чистого серебраСлайд 14Восстановление серебра магнием
Реакции происходит с выделение черного металлического
серебра, затем бурого дыма NO2, дальше следует яркая вспышка. После
реакции остается смесь черных частичек серебра и белых окиси магния. Реакцию можно условно выразить уравнением:3Mg + AgNO3 = 3MgO + 0.5N2 + Ag
Слайд 15Восстановление серебра магнием
Нитрат серебра –ценный компо-
нент, поэтому желательно брать
его
в недостатке (относительно
количества, необходимого для
восстановления всего кисло-
рода в
AgNO3). Недостаток окислителя компенсируется за
счет кислорода воздуха.
Не стоит брать большое коли-
чество смеси, и не только пото-
му, что это опасно.
Если вы хотите продемонстри-
ровать большую вспышку –
воспользуйтесь более дешевыми
компонентами.
Слайд 16 ВЫВОД
Проанализировав
эффективность и трудоемкость вышеуказанных
опытов, а также учитывая требования техники безопасности
проведения опытов и продолжительность опытов, расход материа-лов, я пришла к выводу: реакция «серебряное зеркало» является
самой эффективной и нетрудоемкой при получении вторичного
серебра в школьных лабораториях.