Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Соли: свойства, получение, применение 8 класс УМК О.С. Габриелян
Содержание
- 1. Соли: свойства, получение, применение 8 класс УМК О.С. Габриелян
- 2. 4. Что такое кислоты?1. Какие классы веществ
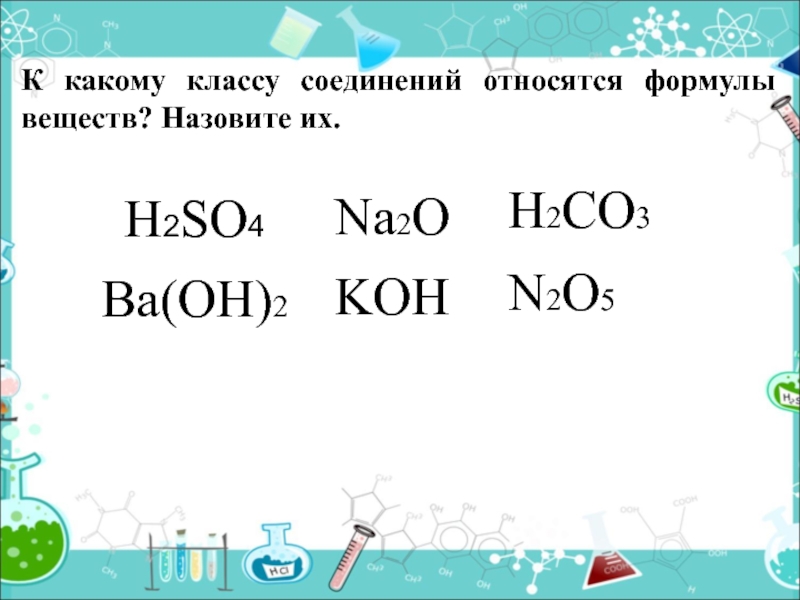
- 3. К какому классу соединений относятся формулы веществ? Назовите их.H2SO4Na2OBa(OH)2H2CO3N2O5KOH
- 4. О каком веществе идёт речь? У
- 5. • научить составлять формулы солей и давать
- 6. Задачи:Научить находить среди неорганических веществ формулы солей;составлять формулы солей;называть соли.
- 7. План урока:6. Химические свойства.1. Что такое соли?2.
- 8. PO4Ион металлаКислотный остатокИон металлаКислотный остатокNaClK3Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка.
- 9. Найдите среди формул веществ- формулы солейCO2
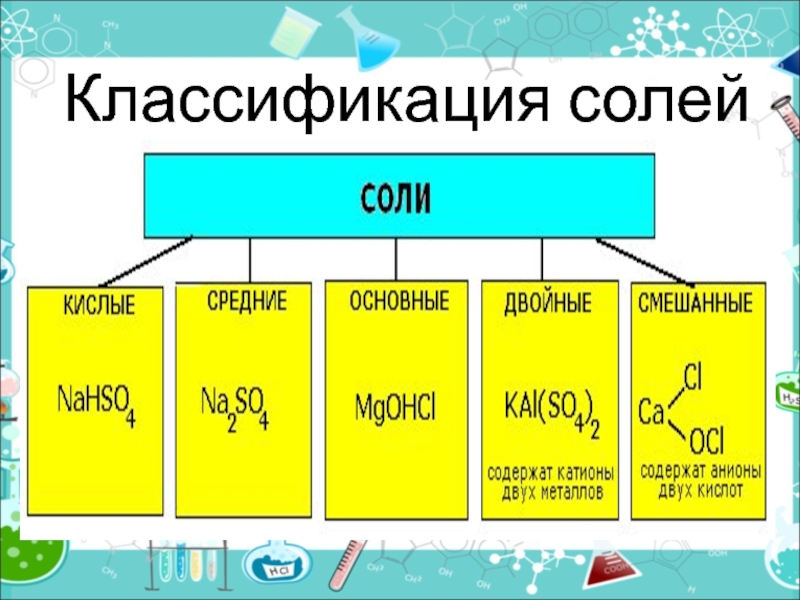
- 10. Классификация солей
- 11. Средние (нормальные) соли — все атомы водорода в
- 12. Двойные соли — в их составе присутствует
- 13. Номенклатура средних солеймагнияНазвание кислотного остаткаНаименование металла в родительном падежеМgСL2 хлорид
- 14. Номенклатура кислых солейУказать название кислотного остаткаК названию кислотного остатка прибавить «гидро-»Наименование металла в родительном падежеNaHSO4сульфатгидронатрия
- 15. Номенклатура основных солейУказать название кислотного остаткаК названию кислотного остатка прибавить «основной-»Наименование металла в родительном падежеMgOHClхлоридосновноймагния
- 16. Номенклатура двойных солейталлия (I) -натрияНазвание кислотного остаткаНаименование металлов в родительном падежеNaTl(NO3)2 нитрат
- 17. Номенклатура смешанных солейкальцияНазвание кислотных остатковНаименование металла в родительном падежеCaCLOCL хлорид-гипохлорит
- 18. Составить формулы солей: нитрита магния, силиката натрия, фосфата кальция.
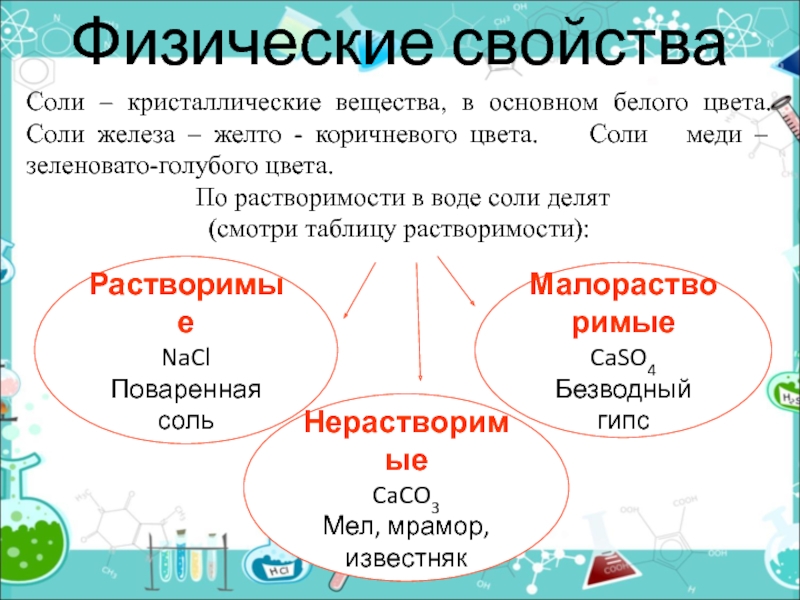
- 19. Физические свойстваРастворимыеNaClПоваренная сольСоли – кристаллические вещества, в
- 20. Химические свойства1. Взаимодействие с металлами. Каждый левее
- 21. Химические свойства2. Взаимодействие со щелочами:В результате обязательно
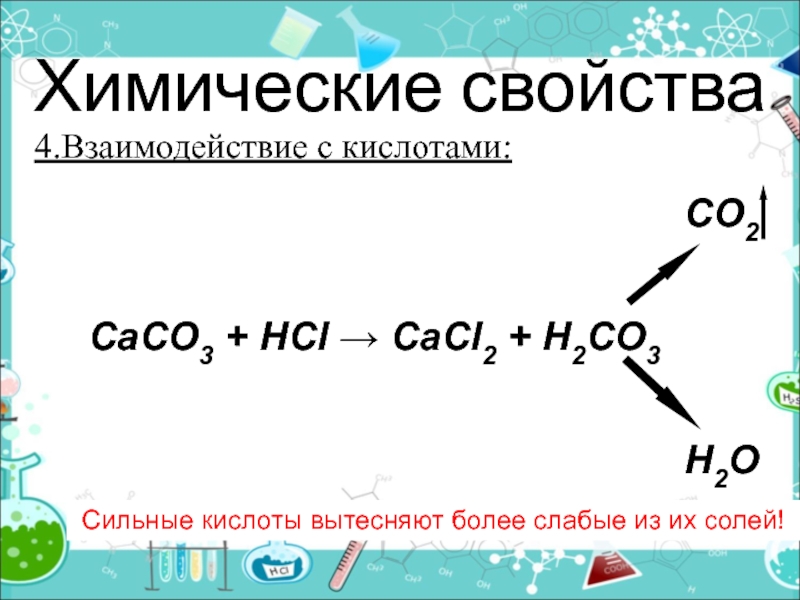
- 22. Химические свойства4.Взаимодействие с кислотами:Сильные кислоты вытесняют более
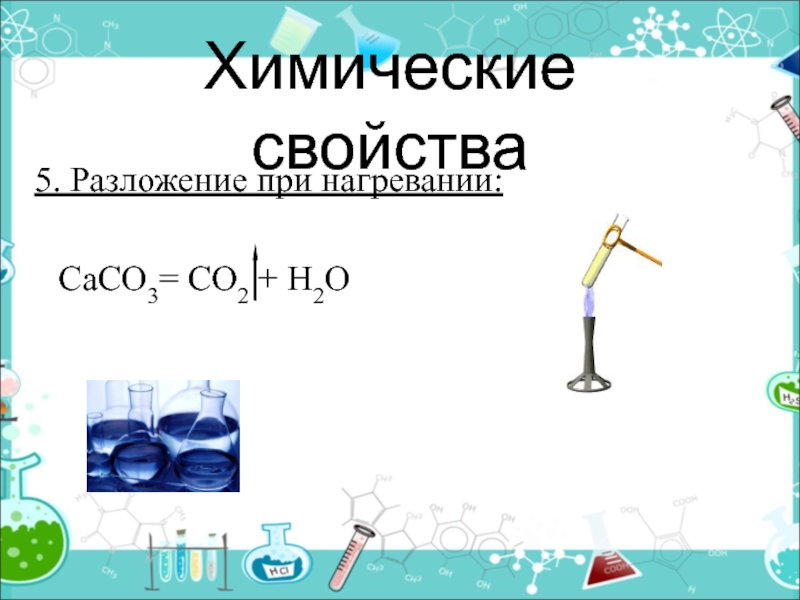
- 23. Химические свойства5. Разложение при нагревании:
- 24. Способы получения 1. Кислота + основание =
- 25. Способы получения 5. Основание + соль
- 26. Применение солейСоли соляной кислоты. Из хлоридов больше
- 27. Применение солейСоли серной кислоты. В строительстве и
- 28. Применение солейСоли азотной кислоты. Нитраты больше всего
- 29. Применение солейСоли угольной кислоты. Карбонат кальция используют
- 30. О соли Мёртвое море
- 31. Розовое озеро в Сенегале Это
- 32. Самое большое солевое озеро в мире расположено
- 33. Химический диктант1 вариант 1.соли металла2.
- 34. Сиквейн 1. В первой
- 35. Сиквейн1. Соль2. Белая, кристаллическая3. Солит, удобряет, растворяется 4. Соль наносит вред здоровью5. Селитра
- 36. Домашнее задание§33, Упр.2, 3, 6 (письменно)
- 37. СПАСИБО ЗА УРОК!
- 38. Список используемых источниковРудзитис Г.Е. Химия. Неорганическая химия.
- 39. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1
Муниципальное бюджетное общеобразовательное учреждение
«Средняя общеобразовательная школа № 21»
г. Мурманск
Соли:
свойства,
получение, применение 8 класс. УМК О. С. Габриелян
химииСлайд 24. Что такое кислоты?
1. Какие классы веществ вы знаете?
2. Что
такое оксиды?
3. Что такое основания?
5. Что такое основные оксиды, (кислотные
оксиды)?Проверка домашнего задания
Слайд 3К какому классу соединений относятся формулы веществ? Назовите их.
H2SO4
Na2O
Ba(OH)2
H2CO3
N2O5
KOH
Слайд 4О каком веществе идёт речь?
У травоядных животных потребность
в этом веществе велика. В тех странах, где этого вещества
мало, люди прибегали к различным способам чтобы ... Меланезийцы каждое утро пили морскую воду, в Новой Зеландии пищу запивали морской водой, в Северной Америке индейские племена высушивали морскую капусту и добавляли её в пищу.Слайд 5• научить составлять формулы солей и давать им названия;
• узнать
классификацию, свойства солей, способы получения и применение солей.
Цели урока:
Слайд 6Задачи:
Научить
находить среди неорганических веществ формулы солей;
составлять формулы солей;
называть соли.
Слайд 7План урока:
6. Химические свойства.
1. Что такое соли?
2. Классификация солей.
3. Номенклатура
солей.
4. Физические свойства.
5. Химические свойства.
6. Получение.
7. Применение.
8. Некоторые интересные факты.
Слайд 8PO4
Ион
металла
Кислотный
остаток
Ион
металла
Кислотный
остаток
Na
Cl
K3
Соли – это сложные вещества, состоящие
из ионов металла и кислотного остатка.
Слайд 11Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены
на атомы металла (KCl)
Кислые соли — атомы водорода в кислоте
замещены атомами металла частично (NaHCO3)Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. ( ( CuOH)2CO3)
Слайд 12Двойные соли — в их составе присутствует два различных катиона,
получаются кристаллизацией из смешанного раствора солей с разными катионами, но
одинаковыми анионами (KAl(SO4)2х12H2O)Смешанные соли — в их составе присутствует два различных аниона (Ca(OCl)Cl)
Слайд 13Номенклатура средних солей
магния
Название кислотного остатка
Наименование металла в родительном падеже
МgСL2
хлорид
Слайд 14Номенклатура кислых солей
Указать название кислотного остатка
К названию кислотного остатка прибавить
«гидро-»
Наименование металла в родительном падеже
NaHSO4
сульфат
гидро
натрия
Слайд 15Номенклатура основных солей
Указать название кислотного остатка
К названию кислотного остатка прибавить
«основной-»
Наименование металла в родительном падеже
MgOHCl
хлорид
основной
магния
Слайд 16Номенклатура двойных солей
таллия (I) -натрия
Название кислотного остатка
Наименование металлов в родительном
падеже
NaTl(NO3)2
нитрат
Слайд 17Номенклатура смешанных солей
кальция
Название кислотных остатков
Наименование металла в родительном падеже
CaCLOCL
хлорид-гипохлорит
Слайд 19Физические свойства
Растворимые
NaCl
Поваренная соль
Соли – кристаллические вещества, в основном белого цвета.
Соли железа – желто - коричневого цвета. Соли
меди – зеленовато-голубого цвета.По растворимости в воде соли делят
(смотри таблицу растворимости):
Нерастворимые
CaCO3
Мел, мрамор, известняк
Малорастворимые
CaSO4
Безводный гипс
Слайд 20Химические свойства
1. Взаимодействие с металлами. Каждый левее стоящий металл в
ряду напряжений вытесняет последующий из раствора его соли.
Fe + CuCI2=Cu
+ FeCI2
Fe° + Cu²+ + 2CI = Cu° + Fe²+ +2CI-
Fe° + Cu²+ = Cu° + Fe²+или Fe° – 2e → Fe²+ │ процесс окисления (восстановитель) Cu²+ + 2e → Cu° │ процесс восстановления (окислитель)
Слайд 21Химические свойства
2. Взаимодействие со щелочами:
В результате обязательно должно образоваться нерастворимое
основание.
3. Взаимодействие солей между собой:
2NaОН + CuSO4 → Cu(OH)2 + Na2SO4
КСl + AgNO3 → AgCl + KNO3
Слайд 22Химические свойства
4.Взаимодействие с кислотами:
Сильные кислоты вытесняют более слабые из их
солей!
CO2CaCO3 + HCl → CaCl2 + H2CO3
H2O
Слайд 24Способы получения
1. Кислота + основание = соль + вода
H2SO4 +2NaOH = Na2SO4 + 2H2O
2. Кислота +
металл = соль + водород2HCL +Zn = ZnCL2 + H2
3. Кислота + основный оксид = соль + вода
2HCL + CuO = CuCL2 + H2O
4. Кислота + соль = новая кислота + новая соль
H2SO4 + BaCL2 = 2HCL + BaSO4
Условия: в результате реакции должны получиться газ, осадок или вода.
Основаны на химических свойствах оксидов,
оснований, кислот
Слайд 25Способы получения
5. Основание + соль = новое основание +
новая соль
2КОН + СаSO4 = Са(ОН) 2
+ К2SO4 6. Основание + кислотный оксид + = соль + вода
2NaOH + SO3 = Na2SO4 + H2O
7. Кислотный оксид + основный оксид = соль
СО2+ СаО = СаСО3
8. Соль + соль = новая соль + новая соль
КСl + AgNO3 → AgCl + KNO3
9. Соль + металл = новая соль + металл
CuSO4 + Fe = FeSO4 + Cu
10. Металл + неметалл = соль
Fe +S = FeS
Слайд 26Применение солей
Соли соляной кислоты. Из хлоридов больше всего используют хлорид
натрия и хлорид калия. Хлорид натрия (поваренную соль) выделяют из озерной
и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды. Хлорид калия используют в сельском хозяйстве как калийное удобрение.Слайд 27Применение солей
Соли серной кислоты. В строительстве и в медицине широко
используют полуводный гипс, получаемый при обжиге горной породы (дигидрат сульфата
кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс. Декагидрат сульфата натрия используют в качестве сырья для получения соды.Слайд 28Применение солей
Соли азотной кислоты. Нитраты больше всего используют в качестве
удобрений в сельском хозяйстве. Важнейшим из них является нитрат натрия,
нитрат калия, нитрат кальция и нитрат аммония. Обычно эти соли называют селитрами.Слайд 29Применение солей
Соли угольной кислоты. Карбонат кальция используют в качестве сырья
для получения извести. Карбонат натрия (соду) применяют в производстве стекла и
при варке мыла. Карбонат кальция в природе встречается и в виде известняка, мела и мрамора.Слайд 31 Розовое озеро в Сенегале Это озеро имеет такой цвет из-за
большого количества микроорганизмов и полезных ископаемых. Местные женщины проводят до
14 часов в день собирая там соль.Слайд 32Самое большое солевое озеро в мире расположено на юге пустынной
равнины Альтиплано, в Боливии, на высоте около 3700 м. Его
площадь составляет 10,5 квадратных километров. В центре толщина соли достигает 10 метров. Это озеро содержит более 10 миллиардов тонн соли. Когда Salar de Uyuni покрывается водой, в нем отражается каждое облако.Слайд 33 Химический диктант
1 вариант
1.соли металла
2. сульфат алюминия
3. белого
4.
Cu(OH)2
5. хлора, соды
2 вариант
1. ионов металла и кислотного
остатка.2. нитрат кальция.
3.растворимые, нерастворимые и малорастворимые.
4. CаCL2
5. калийное
Критерии оценки
5 правильных ответов — «5»
4 правильных ответов — «4»
3 правильных ответов — «3»
Меньше 3 правильных ответов — «2»
Слайд 34 Сиквейн
1. В первой строчке тема называется
одним словом (обычно существительным). 2. Вторая строчка — это
описание темы в двух словах (двумя прилагательными). 3. Третья строчка — это описание действия в рамках этой темы тремя словами (глаголами). 4. Четвертая строка — это фраза из четырех слов, показывающая отношение к теме. 5. Последняя строка — это синоним из одного слова, который повторяет суть темы.Слайд 35 Сиквейн
1. Соль
2. Белая, кристаллическая
3. Солит, удобряет, растворяется
4.
Соль наносит вред здоровью
5. Селитра
Слайд 38Список используемых источников
Рудзитис Г.Е. Химия. Неорганическая химия. 8 класс: Учебник
для общеобразовательных учреждений с прил. на электрон. носителе: базовый уровень.
Просвещение, 2011 – 176 с.Журнал Химия в школе №7. 2012 год [стр. 24-25];
•Дидактический и раздаточный материал. Издательство «Учитель», 2012
http://school-collection.edu.ru/collection/organic/
http://ru.wikipedia.org/wiki/
• http://www.chemnet.ru
• http://www.hij.ru
• http://him-school.ru
• www.bfnm.ru