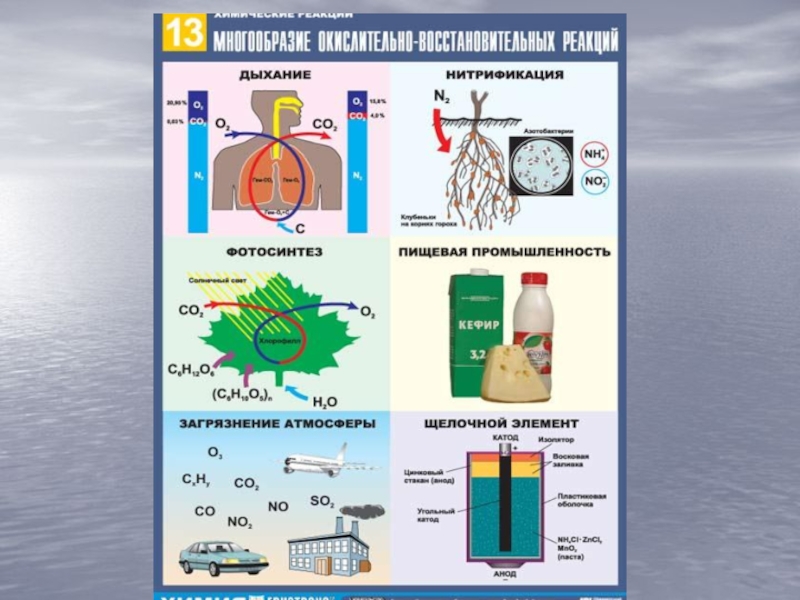
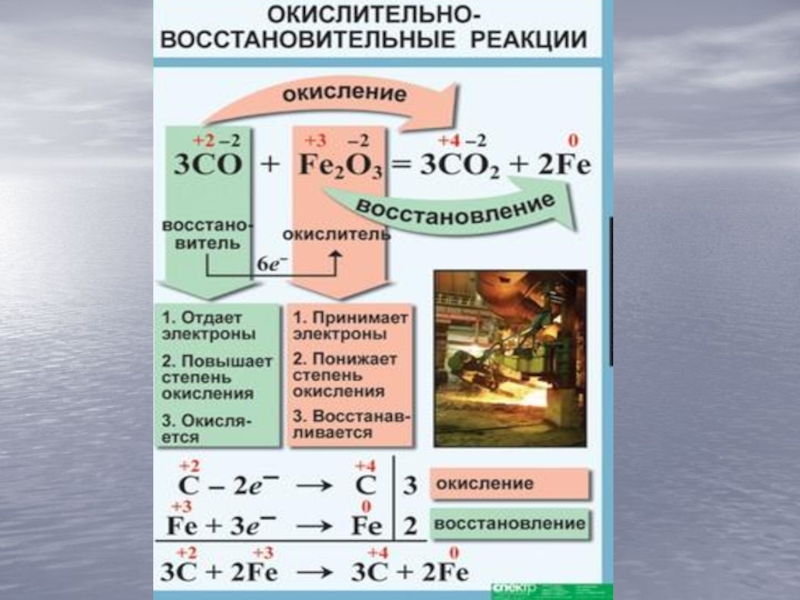
, ОF2.)
Водород с металлами имеет СО равную -1, в других
соединениях в основном +1.Металлы главных подгрупп имеют + СО, равную номеру группы.
Фтор всегда имеет СО равную -1.
СО элементов простых веществ и отдельных атомов всегда равна нулю.
В химической формуле алгебраическая сумма степеней окисления всегда равна нулю.