Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электрохимический ряд напряжений металлов. Общие химические свойства металлов
Содержание
- 1. Электрохимический ряд напряжений металлов. Общие химические свойства металлов
- 2. Цель урока: Повторить и обобщить общие химические свойства металлов с учетом их положения в ЭХРНМ
- 3. Задачи урока:Повторить общие химические свойства металловОбъяснить зависимость
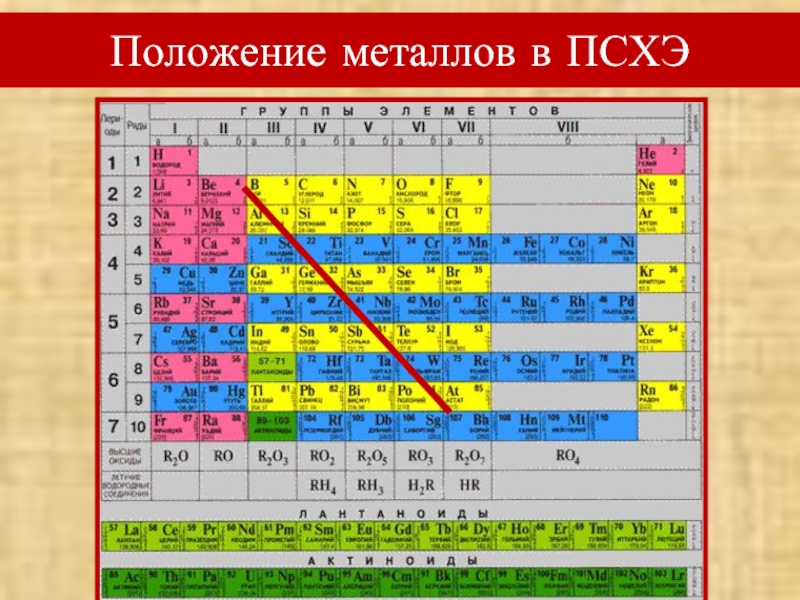
- 4. Вспомним! Положение металлов в ПСХЭОсобенности строения атомов
- 5. Положение металлов в ПСХЭ
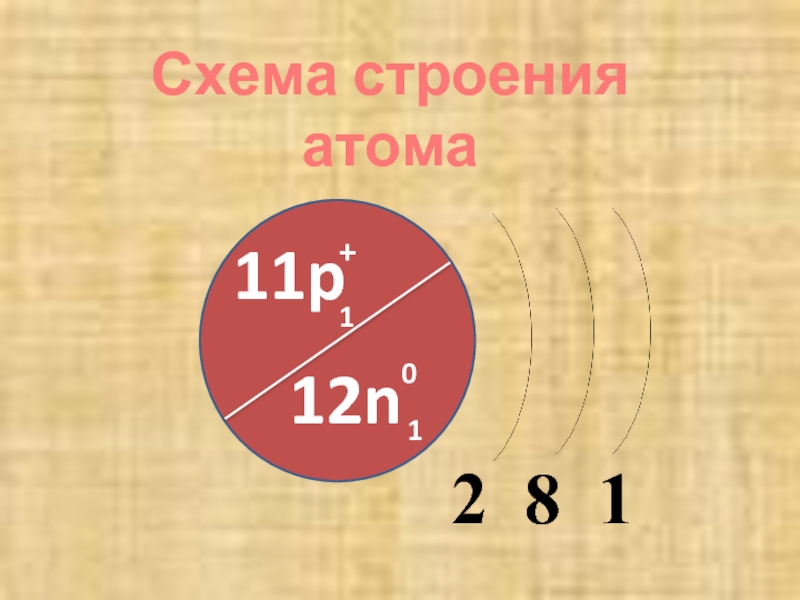
- 6. 2 8 111p+112n01Схема строения атома
- 7. Вывод: Атомы металлов – ……………. электроны с внешнего энергетического уровня, поэтому являются ………………………..отдаютвосстановителями
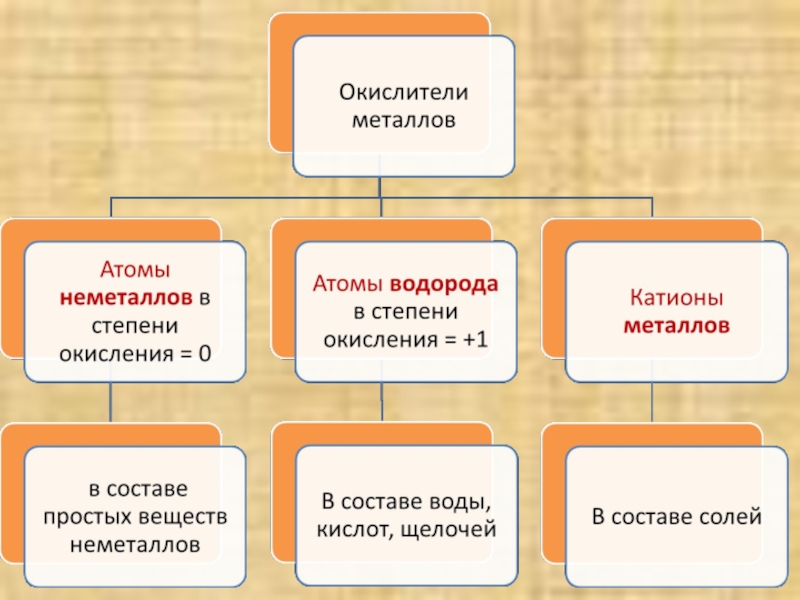
- 8. Атомы металлов – восстановители, а катионы металлов? Катионы металлов принимают электроны, и являются окислителями
- 9. Слайд 9
- 10. Металлы взаимодействуютС неметаллами с образованием бинарных соединений
- 11. Электрохимический ряд напряжений металлов. Стр. 201
- 12. 4 правила ЭХРНМ1. Чем левее стоит металл
- 13. Металлы после водорода…Взаимодействие с концентрированной серной кислотой
- 14. Металлы после водорода…Взаимодействие с концентрированной и разбавленной
- 15. Металлы после водорода…3. Взаимодействие золота с «царской
- 16. Подведем черту…Металл + кислород = оксид металлаМеталл
- 17. Подведем черту…Металл + серная кислота (к) =
- 18. Напишите реакции:калий + вода = гидроксид калия
- 19. железо + соляная кислота = хлорид железа
- 20. железо + сульфат меди (II) = медь
- 21. ДиагностикаНапишите реакции взаимодействия магния с кислородом, хлором,
- 22. Решение диагностики:1. 2Mg +O2 =
- 23. Домашнее заданиеВыполните задания диагностики для следующих металлов:1
- 24. Скачать презентанцию
Цель урока: Повторить и обобщить общие химические свойства металлов с учетом их положения в ЭХРНМ
Слайды и текст этой презентации
Слайд 2Цель урока:
Повторить и обобщить общие химические свойства металлов с учетом
их положения в ЭХРНМ
Слайд 3Задачи урока:
Повторить общие химические свойства металлов
Объяснить зависимость свойств металлов от
их положения в ЭХРНМ
Выполнить упражнения на написание уравнений химических реакций,
характеризующих общие химические свойства металловПровести диагностику и коррекцию знаний
Слайд 4Вспомним!
Положение металлов в ПСХЭ
Особенности строения атомов металлов (радиус атома,
количество электронов на внешнем энергетическом уровне, электроотрицательность)
Способность к принятию или
отдаче электроновСлайд 7Вывод:
Атомы металлов – …………….
электроны с внешнего энергетического уровня,
поэтому являются ………………………..
отдают
восстановителями
Слайд 8Атомы металлов – восстановители,
а катионы металлов?
Катионы металлов принимают электроны,
и являются окислителями
Слайд 10Металлы взаимодействуют
С неметаллами с образованием бинарных соединений (оксидов, гидридов, сульфидов,
галогенидов и др.)
С водой с образованием щелочей или оксидов и
выделением водородаС растворами кислот с образованием солей и выделением водорода
С растворами солей с образованием новой соли и нового металла
Слайд 124 правила ЭХРНМ
1. Чем левее стоит металл в ЭХРНМ тем
более сильным восстановителем он является
2. Каждый металл способен вытеснять из
растворов солей те металлы , которые вЭХРНМ стоят правее его Опыт 1
3. Металлы, находящиеся в ряду напряжений левее водорода, вытесняют его из кислот в растворе Опыт 2
4. Металлы, являющиеся самыми сильными восстановителями (щелочные и щелочноземельные ), в водных растворах взаимодействуют прежде всего с водой Опыт 3
↓
Слайд 13Металлы после водорода…
Взаимодействие с концентрированной серной кислотой при нагревании
Cu
+ 2H2SO4 = CuSO4 + 2H2O + SO2↑
Слайд 14Металлы после водорода…
Взаимодействие с концентрированной и разбавленной азотной кислотой. Опыт
- 4
Cu + 4HNO3 = Cu(NO3)2 + 2H2O + NO2↑
3Cu + 8HNO3 = 3Cu(NO3)2 + 4H2O + 2NO↑Слайд 15Металлы после водорода…
3. Взаимодействие золота с «царской водкой»
Au + HNO3
+ 4HCl = H[AuCl4] + NO + 2H2O
Слайд 16Подведем черту…
Металл + кислород = оксид металла
Металл + хлор =
хлорид металла
Металл + сера = сульфид металла
Металл + вода =
щелочь (оксид) + H2Металл + кислота (р) = соль + H2
Металл + соль (р) = соль + металл
Слайд 17Подведем черту…
Металл + серная кислота (к) = соль + вода
+ «Х», где «Х» - SO2, S, H2S в зависимости
от положения металла в ЭХРНММеталл + азотная кислота = соль + вода + «У»
где «У» - NO2, NO, N2O, N2, NH3 в зависимости от положения металла в ЭХРНМ и концентрации кислоты
Слайд 18Напишите реакции:
калий + вода = гидроксид калия + водород
кальций +
вода = гидроксид кальция + водород
цинк + вода = оксид
цинка + водородолово + вода = оксид олова (II) + водород
металлы, стоящие в ЭХРНМ до водорода, взаимодействуют с водой с образованием щелочи и водорода или с образованием оксида и водорода. Это зависит от их активности.
Слайд 19
железо + соляная кислота = хлорид железа (II) + водород
никель
+ серная кислота = сульфат никеля (II) + водород
металлы, стоящие
в ЭХРНМ до водорода, взаимодействуют с растворами кислот (кроме азотной) с образованием растворимой соли и водорода.Слайд 20
железо + сульфат меди (II) = медь + сульфат железа
(II)
медь + нитрат ртути (II) = ртуть + нитрат меди
(II)металлы взаимодействуют с растворами солей. Согласно ЭХРНМ, каждый более активный металл вытесняет менее активный из раствора соли. НЕ БРАТЬ АКТИВНЫЕ МЕТАЛЛЫ!
Слайд 21Диагностика
Напишите реакции взаимодействия магния с кислородом, хлором, азотом, водой, соляной
кислотой, хлоридом меди(II)
Напишите реакцию взаимодействия цинка с концентрированной серной кислотой
при нагревании. Определите с какими из перечисленных веществ (H2SO4(p), H2SO4(к), MgCl2, CuSO4) при обычных условиях взаимодействует железо. Составьте уравнения возможных реакций, укажите в них окислитель и восстановитель, запишите процессы окисления и восстановления.
Слайд 22Решение диагностики:
1. 2Mg +O2 = 2MgO
Mg +Cl2 =
MgCl2
3Mg +N2 = Mg3N2
Mg +2H2O = Mg(OH)2 +H2
Mg +2HCl =
MgCl2 +H2Mg +CuCl2 = MgCl2 + Cu
4Zn +5H2SO4(конц) = 4ZnSO4 +4H2O + H2S↑
Fe + H2SO4 = FeSO4 + H2↑
Fe + CuSO4 = FeSO4 + Cu
Слайд 23Домашнее задание
Выполните задания диагностики для следующих металлов:
1 задание для лития
Li
2 задание для ртути Hg и концентрированной азотной кислоты HNO3
3
задание для цинка Zn
Теги











![Электрохимический ряд напряжений металлов. Общие химические свойства металлов Металлы после водорода…3. Взаимодействие золота с «царской водкой» Au + HNO3 + Металлы после водорода…3. Взаимодействие золота с «царской водкой» Au + HNO3 + 4HCl = H[AuCl4] + NO +](/img/thumbs/ef4dd08cb96cb860f1c4775aa1bd3501-800x.jpg)



























