Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Неметаллы. Водород. Галогены.
Содержание
- 1. Неметаллы. Водород. Галогены.
- 2. Цель урока:Повторение знаний о неметаллах.Повторение изученного материала в 8 классе.Закрепление и коррекция знаний материала, изученного самостоятельно.
- 3. 3. Физические свойства и применение водорода:4. Общая
- 4. Слайд 4
- 5. Особенности строения атомов неметаллов.Атомы металлов имеют большой
- 6. Физические свойства.
- 7. Слайд 7
- 8. Аллотропия — существование одного и того же
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. Нахождение в природеВ составе Солнца – 70%В атмосфере на высоте 100км Звёзды Вода Нефть
- 13. Получение водорода
- 14. Техника безопасности при работе с водородомХлопокС воздухом
- 15. Слайд 15
- 16. Водород был открыт в 1766 году английским
- 17. Газ без цвета и запахаСамый лёгкий газ
- 18. Соединения водорода с металлами –Названия следующих веществ:
- 19. F Cl Br
- 20. История открытия галогенов«Иод открыл кот»“Иодэс”
- 21. Вы пролили йод на белую салфетку.
- 22. 1826 г. Br2
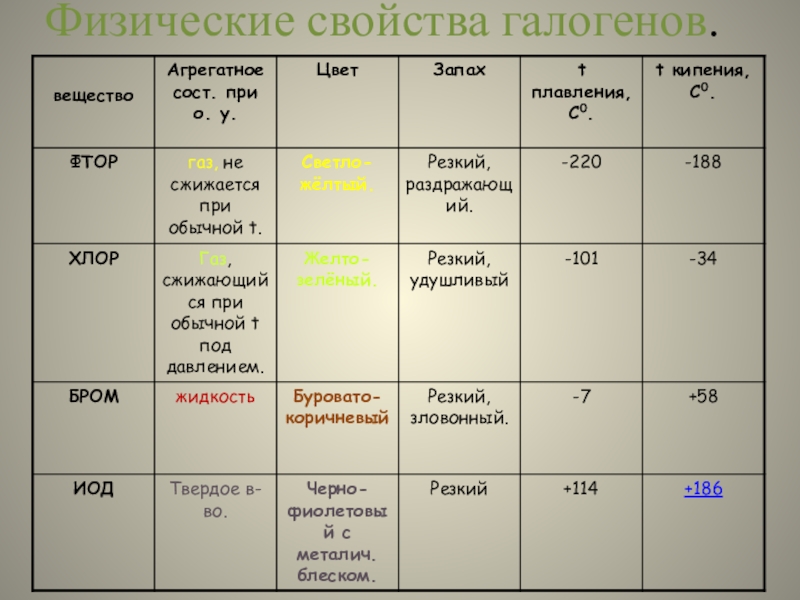
- 23. Физические свойства галогенов.
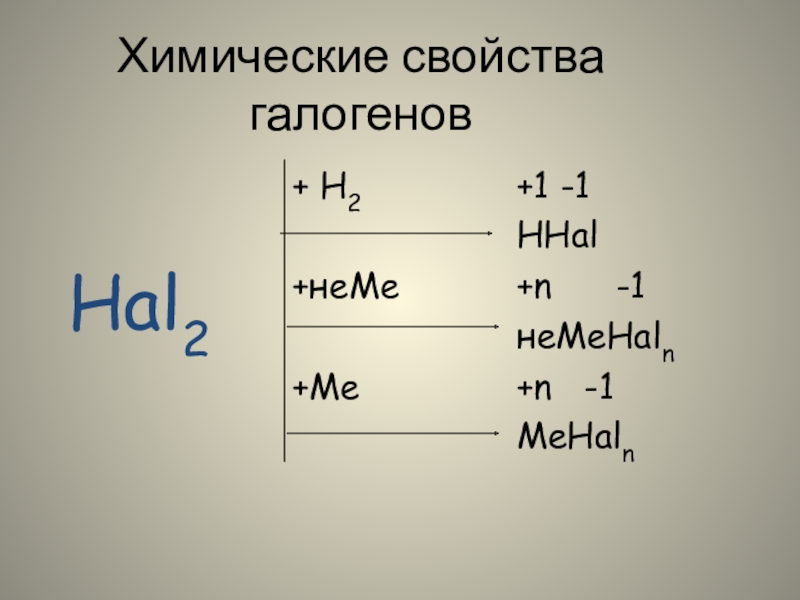
- 24. Химические свойства галогенов
- 25. Галогены взаимодействуют с водой:2F2 + 2Н2O =
- 26. Соли галогеноводородных кислот.Для определения в растворе хлорид-,
- 27. Подумайте….Что образуется в данной реакции, оксид фтораили фторид кислорода?F2 + O2
- 28. Биологическое значение и применение галогеновФтор играет очень
- 29. Хлор (хлорид-ион) важен для жизнедеятельности животных и
- 30. Бром также входит в число необходимых микроэлементов
- 31. Йод в организме человека начинает накапливаться еще
- 32. Основные соединения галогеновСоли ― галогениды:NaCl ―поваренная, каменная
- 33. В ряду HF, НСI, HBr, HI прочность
- 34. Слайд 34
- 35. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Цель урока:
Повторение знаний о неметаллах.
Повторение изученного материала в 8 классе.
Закрепление
и коррекция знаний материала, изученного самостоятельно.
Слайд 3
3. Физические свойства и применение водорода:
4. Общая характеристика галогенов: строение
атомов. Простые вещества, их физические свойства. Краткие сведения о хлоре,
фторе, броме и йоде. Применение галогенов.6. Основные соединения галогенов (НГ, галогениды). Качественная реакция на хлориды.
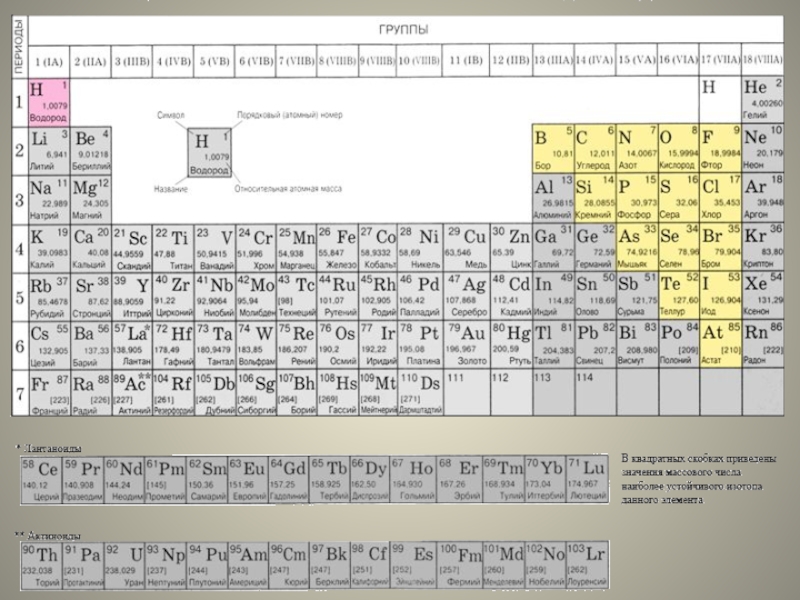
1.Общая характеристика неметаллов: положение в периодической системе, строение атомов; электроотрицательность как мера «неметалличности», ряд ЭО. Кристаллическое строение неметаллов – простых веществ. Аллотропия. Физические свойства неметаллов. Относительность понятий «металл» и «неметалл».
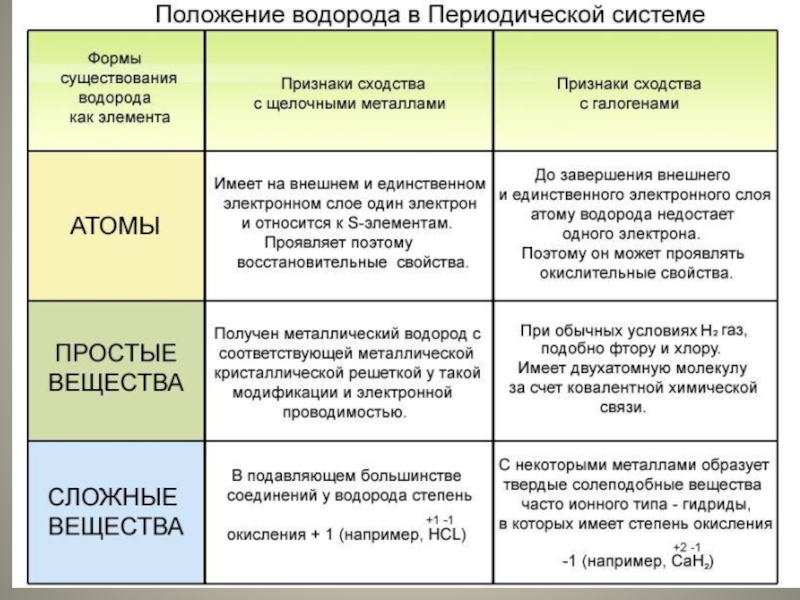
2. Водород. Положение в периодической системе. Строение атома и молекулы. Химические свойства водорода, его получение.
5. Химические свойства галогенов.
Слайд 5Особенности строения атомов неметаллов.
Атомы металлов имеют большой радиус - атомы
неметаллов имеют малый радиус.
Атомы металлов имеют мало электронов на
внешнем уровне - атомы неметаллов имеют много электронов на внешнем уровне. Атомы металлов легко отдают электроны с внешнего уровня - атомы неметаллов легко принимают недостающие электроны на внешний уровень.
Металлы - хорошие восстановители. Неметаллы - хорошие окислители
Слайд 8Аллотропия — существование одного и того же химического элемента в
виде двух и более простых веществ, различных по строению и
свойствам, т. е. аллотропных модификаций.Слайд 13Получение водорода
электр. ток
1) 2Н2О 2Н2↑+О2↑ (промышленный способ)
2) Zn+2HCI → H2↑ + ZnCI2 (лабораторный способ)
НСI
Zn
H2
Слайд 14Техника безопасности при работе с водородом
Хлопок
С воздухом водород образует взрывоопасные
смеси, поэтому обращаться с ним следует весьма осторожно.
Водород при смеси
с воздухом образует взрывоопасную смесь - так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1 Водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.Слайд 16Водород был открыт в 1766 году английским химиком Генри Кавендишем,
который установил, что при взаимодействии металлов с разбавленными кислотами выделяется
некий "горючий воздух" (в те времена все газы называли "воздухом"). Наблюдая горение водорода на воздухе, Кавендиш установил, что в результате появляется вода. Это было в 1782 гМысль о том, что вода - сложное вещество, первым высказал не Кавендиш, а знаменитый изобретатель паровой машины Джеймс Уатт в 1783 году. В этом же году французский химик Антуан-Лоран Лавуазье выделил водород путем разложения воды раскаленным железом. С современной точки зрения этот опыт выглядел довольно странно, потому что Лавуазье продувал струю водяного пара через нагретый до красного каления... ружейный ствол!
Слайд 17Газ без цвета и запаха
Самый лёгкий газ
Сжижается при температуре
−253 °С.
Быстрее других газов диффундирует через тонкие отверстия
Способен растворяться в
металлахПри низких температурах у большинства металлов и сплавов очень повышается способность проводить электричество. Сверхпроводимость относится к технике
чувствительных электронных приборов (метрология)
Теплопроводнее и электропроводнее других газов
Способность развивать при горении большое количество тепла
В современной энергетике для охлаждения электрических машин
В качестве ракетного топлива. Когда-нибудь будут широко применять как топливо для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающей среды.
Спайка металлов без припоя. Плавление платины
Слайд 18Соединения водорода с металлами –
Названия следующих веществ:
гидриды
сероводород
аммиак
гидрид
кальцияпероксид водорода
Слайд 19 F Cl Br I At
Усиление
восстановительных свойств
Усиление окислительных свойств
Увеличение радиуса атома
Общая
характеристика галогеновСлайд 20История
открытия
галогенов
«Иод открыл кот»
“Иодэс” - фиолетовый, открыл Куртуа.
Любимый
кот ученого прыгнул на бутылки, содержащие золу морских водорослей в
спиртовом растворе и концентрированную серную кислоту. Бутылки разбились, жидкости смешались, с пола стали подниматься клубы сине-фиолетового пара, который и оказался иодом.Слайд 21Вы пролили йод на белую салфетку. Однако через несколько дней
пятно исчезло в результате физического процесса – постепенной сублимации йода,
адсорбированного тканью. Сублимация или возгонка — переход вещества из твёрдого состояния в газообразное без пребывания в жидком состоянии
Сублимированные продукты значительно превосходят сушеные по пищевой ценности, так как возгонке поддаётся только вода, а при термическом испарении теряются многие полезные вещества.
Слайд 221826 г. Br2 Балар;
«Бромос» –
зловонный
1866 г. F2 Анри Муассан ; «Фторос» -
разрушающийПолучен при исследовании жидкости из растворенной в воде золы морских водорослей (при пропускании через нее хлора).
Был удостоен Нобелевской премии за открытие фтора. Однако, когда Муассан докладывал Парижской академии наук о своем открытии, один глаз его был закрыт черной повязкой.
Хроническая сердечная недостаточность и годы работы с ядовитыми химическими веществами ослабили организм.
В течение двух лет получал Г. Дэви, но был тяжело отравлен фтористым водородом.
Пять лет братья Нокс проводили опасные эксперименты, но тоже отравились. Один из братьев умер сразу, а другой — три года спустя.
Французский химик Д. Никле. Пытаясь получить фтор, серьезно подорвали свое здоровье Ж.Л. Гей-Люссак и Л.Ж. Тенар.
Слайд 25Галогены взаимодействуют с водой:
2F2 + 2Н2O = 4HF + O2
Вода
во фторе горит, кислород является не причиной, а следствием горения,
выступая в непривычной для него роли восстановителя!F2 > Сl2 > Вr2 > I2,
т. е. окислительные свойства уменьшаются.
Так, хлор вытесняет бром и йод (но не фтор), а бром в состоянии вытеснить только йод из растворов соответствующих солей:
2NaBr + Cl2 = 2NаСl + Br2
2КI + Br2 = 2КВr + I2.
Слайд 26Соли галогеноводородных кислот.
Для определения в растворе хлорид-, бромид- и иодид-ионов
и их различения используют реакцию с нитратом серебра AgNO3.
Cl-+Ag+=AgCl (белый)Br-+Ag+=AgBr (светло-желтый)
I-+Ag+=AgI (желтый)
Для распознания фторидов AgNO3 в качестве реактива не подходит, т.к. образующийся AgF растворим в воде. В этом случае используют реакцию с ионами Са2+.
F-+Ca2+=CaF2
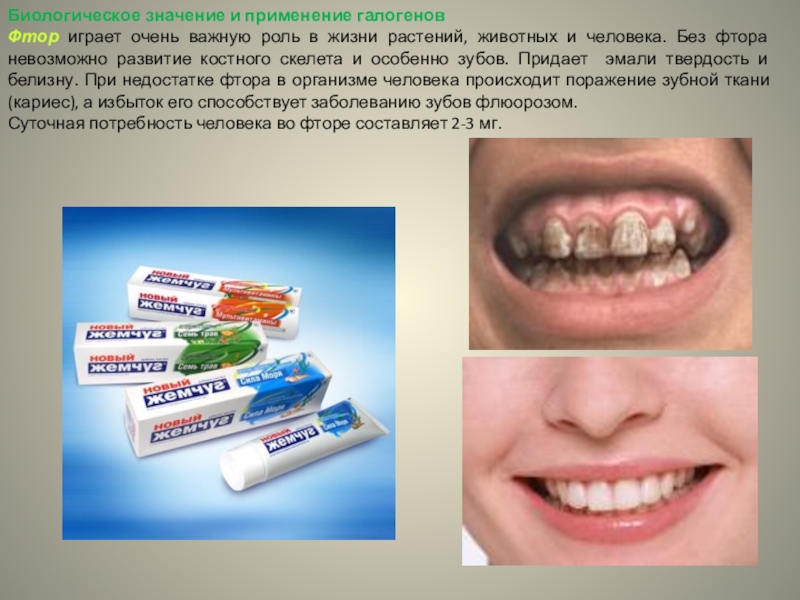
Слайд 28Биологическое значение и применение галогенов
Фтор играет очень важную роль в
жизни растений, животных и человека. Без фтора невозможно развитие костного
скелета и особенно зубов. Придает эмали твердость и белизну. При недостатке фтора в организме человека происходит поражение зубной ткани (кариес), а избыток его способствует заболеванию зубов флюорозом.Суточная потребность человека во фторе составляет 2-3 мг.
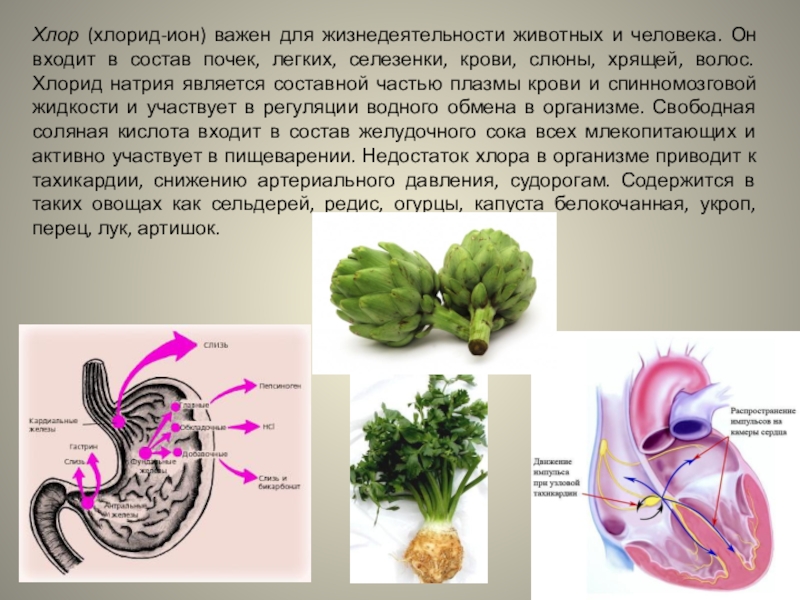
Слайд 29Хлор (хлорид-ион) важен для жизнедеятельности животных и человека. Он входит
в состав почек, легких, селезенки, крови, слюны, хрящей, волос. Хлорид
натрия является составной частью плазмы крови и спинномозговой жидкости и участвует в регуляции водного обмена в организме. Свободная соляная кислота входит в состав желудочного сока всех млекопитающих и активно участвует в пищеварении. Недостаток хлора в организме приводит к тахикардии, снижению артериального давления, судорогам. Содержится в таких овощах как сельдерей, редис, огурцы, капуста белокочанная, укроп, перец, лук, артишок.Слайд 30Бром также входит в число необходимых микроэлементов и больше всего
его содержится в гипофизе, крови, щитовидной железе, надпочечниках. Бромиды положительно
действуют не центральную нервную систему. В природе бромиды накапливаются в таких растениях, как рожь, пшеница, ячмень, картофель, морковь, черешня, яблоки. Много брома содержится в голландском сыре..
Слайд 31Йод в организме человека начинает накапливаться еще в утробе матери.
В гормоне щитовидной железы человека ― тироксине ― содержится 60%
связанного йода. Этот гормон с током крови поступает в печень, почки, молочные железы, желудочно-кишечный тракт. Недостаток йода в организме человека вызывает такие заболевания, как эндемический зоб и кретинизм, при котором замедляется рост и развивается умственная отсталость. Основными поставщиками йода для человека служат злаки, баклажаны, фасоль, капуста белокочанная и цветная, картофель, лук, морковь, огурцы, тыква, салат, морская капуста, кальмары.Слайд 32Основные соединения галогенов
Соли ― галогениды:
NaCl ―поваренная, каменная соль, галит ―
сырье для получения щелочи, хлора, соляной кислоты, соды, применяется в
мыловарении, красильном деле, как приправа к пище;KCl ― сильвин ― удобрение и реактив в химических лабораториях;
ZnCl2 ― хлорид цинка ― используется как пропитка телеграфных столбов и железнодорожных шпал для предохранения их от гниения;
HgCl2 ― сулема ― сильный яд, очень разбавленные растворы ― дезинфицирующее средство для протравливания семян, дубления кожи, в органическом синтезе;
AgCl ― применяется в фотографическом производстве, так как обладает высокой светочувствительностью.
СаF2 ― флюорит, плавиковый шпат ― издревле использовали в качестве флюса ― вещества, которое при выплавке металлов добавляют в руду, чтобы понизить ее температуру плавления.
NаСl•КСl -
сильвинит – получение пищевой соли
Слайд 33В ряду HF, НСI, HBr, HI прочность молекул
так как радиус атома галогена , уменьшается его ЭО. Отсюда сила кислот, образуемых при растворении галогеноводородов в воде,
HF ― кислота средней силы, остальные относятся к сильным кислотам;
обладает уникальной способностью разъедать стекло, ее хранят в полиэтиленовой, свинцовой или парафиновой посуде. Уже в XVII в. раствор плавиковой кислоты служил для вытравливания узоров на стеклянной посуде.
НCl ― в концентрированном состоянии «дымит» на воздухе. («Царская водка» ― смесь из 3 частей концентрированной соляной кислоты и 1 части концентрированной азотной кислоты )
Галогеноводороды ― Н:Г или Нδ+Гδ+ ― это едкие газы с резким запахом, хорошо растворимы в воде. Растворы их представляют собой бескислородные кислоты.
уменьшается ,
увеличивается
увеличивается