Слайд 1Урок химии по теме
“Коррозия металлов и способы защиты от
коррозии"
Подготовила учитель химии СШ РГКП «Республиканский центр реабилитации для детей
и подростков»
Лепесбаева Сандугаш Кайратовна
Слайд 2Цели урока:
сформировать представление учащихся о механизме коррозийных процессов, об их
последствиях и способах защиты от коррозии;
развивать умение работать с опорным
конспектом, наблюдать, делать выводы;
воспитывать эмоциональное отношение к изучаемому явлению.
Слайд 3Чугун
Сплав железа с углеродом (2-4%)
Сталь
Сплав железа с углеродом (меньше 2%)
Применяется
в фасонном литье
При добавлении легирующих элементов улучшает качества
Слайд 4 В III до нашей эры
на острове Родос
был построен
маяк в виде огромной
статуи Гелиоса. Колосс
Родосский
считался одним
из семи чудес света, однако
просуществовал всего 66 лет
и рухнул во время
землетрясения. У Колосса
Родосского бронзовая
оболочка была смонтирована
На железном каркасе. Под
действием влажного,
насыщенного солями
средиземноморского воздуха
железный каркас разрушился.
Слайд 5Что является символом Парижа? – Эйфелева башня. Она неизлечима больна,
ржавеет и разрушается, и только постоянная химиотерапия помогает бороться с
этим смертельным недугом:
её красили 18 раз, отчего её масса 9000 т каждый раз увеличивается на 70 т.
Слайд 6
Коррозия – рыжая крыса,
Грызёт металлический лом.
В. Шефнер
Ежегодно в мире «теряется»
до ¼ произведённого железа…
А.Н.Несмеянов
Знать – значит победить!
Слайд 8Путешествие по царству «Рыжего дъявола»
ст. Информационная
ст. Экспериментальная
ст. Практическая
Слайд 9разрушение металлов и сплавов под воздействием окружающей среды.
Коррозия
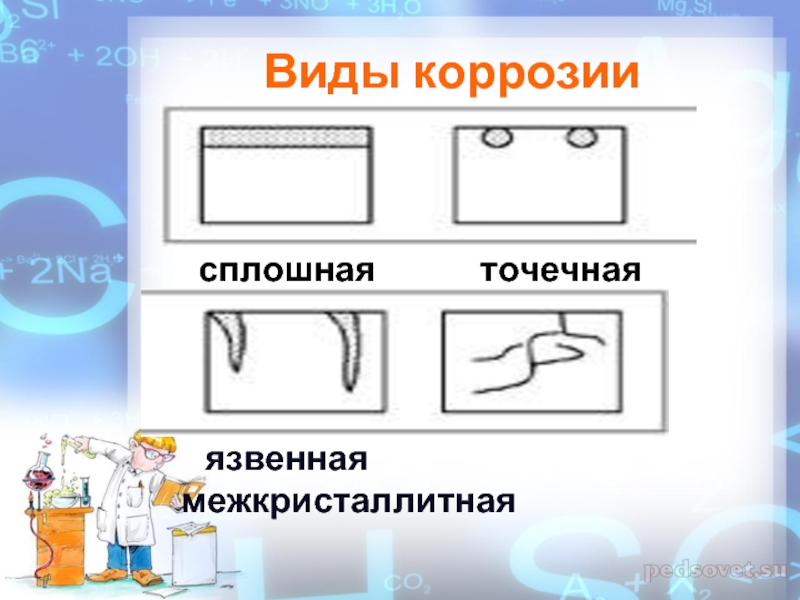
Слайд 10Виды коррозии
По механизму действия
химическая, электрохимическая
По виду коррозионной среды
газовая, жидкостная
(кислотная,
солевая, щелочная)
почвенная, атмосферная
По характеру разрушения
сплошная (общая):
равномерная, неравномерная
локальная(местная):
точечная, пятнами,
язвами, подповерхностная, сквозная и др.
Слайд 11Виды коррозии
сплошная
точечная
язвенная межкристаллитная
Слайд 12Химическая коррозия
- металл разрушается в результате его химического взаимодействия с
агрессивной средой (сухими газами, жидкостями-неэлектролитами).
Образование окалины при взаимодействии материалов
на основе железа при высокой температуре с кислородом:
8ē
3Fe0 + 2O20 → (Fe+2Fe2+3)O4-2
Видео- фрагмент
Лабораторный опыт – накаливание медной проволоки
Слайд 13Электрохимическая коррозия
- в среде электролита возникает электрический ток при контакте
двух металлов (или на поверхности одного металла, имеющего неоднородную структуру);
-
коррозия напоминает работу гальванического элемента: происходит перенос электронов от одного участка металла к другому (от металла к включению).
Видео- фрагмент
Слайд 14
Образующиеся на аноде ионы Fe2+ окисляются до Fe3+ :
4Fe2+ (водн.)
+ O2 (г.) + (2n + 4)H2O (ж.) = 2Fe2O3•nH2O
(тв.) + 8H+ (водн.)
Коррозия металла на влажном воздухе
Слайд 16Железо слабо прокорродировало в воде, в чистой воде коррозия идет
медленнее, т. к. вода слабый электролит.
Сравним результаты опытов № 2
и № 5
Слайд 17Добавка к воде NaCl усиливает коррозию Fe. добавка к раствору
NaCl – NaOH, как видно из опыта, наоборот ослабила коррозию,
ржавчины получилось мало.
Сравним результаты опытов № 1 и № 2
Слайд 18Т. о. скорость коррозии данного металла зависит от состава омывающей
среды. Одни составные части омывающий металл среды, в частности Cl-
- ионы усиливают коррозию металлов, другие составные части могут ослаблять коррозию. Коррозия Fe ослабевает в присутствии OH- - ионов.
Слайд 19В обоих случаях Fe находится в одном и том же
растворе, но в одном случае оно соприкасается с цинком, а
в другом нет.
В пробирке № 2 осадок бурого цвета – это ржавчина, а в пробирке № 4 осадок – белого цвета – это Zn(OH)2
Вывод: В опыте № 4 корродировало не Fe, а Zn , т. к. железо почти не корродирует, если оно соприкасается с цинком.
Сравним результаты опытов № 2 и № 4
Слайд 20
Окисляется Zn, как более активный металл
А (-)
отщепляющиеся от его
атомов
перемещаются на поверхность Fe и
восстанавливают
К (+) Fe
Слайд 21В обоих случаях Fe находится в одном и том же
растворе, но в одном случае оно соприкасается с медью, а
в другом нет. В обеих пробирках произошла коррозия и появился бурый осадок ржавчины.
В пробирке №2 ржавчины получилось меньше, чем в пробирке №3.
Вывод: таким образом, коррозия и ржавление железа сильно усиливается, когда оно соприкасается с медью.
Сравним результаты опытов № 2 и № 3
Слайд 22
А (-)
К (+) Cu
Реакция растворенного в воде кислорода
с железом приводит к образованию бурой ржавчины.
Слайд 23Коррозия металла резко усиливается, если он соприкасается с каким-либо другим,
менее активным металлом, т. е. расположенным в электрохимическом ряду напряжений
металлов правее его. Но коррозия замедляется, если металл соприкасается с другим металлом, расположенным левее в электрохимическом ряду напряжений металлов, т. е. более активным.
Слайд 25Защита от коррозии
- Изоляция металла от среды
- Изменение состава
металла
(сплава)
- Изменение среды
Слайд 26Барьерная защита
- механическая изоляция поверхности при использовании поверхностных защитных покрытий:
неметаллических
(лаки, краски, смазки, эмали, гуммирование (резина), полимеры);
металлических (Zn, Sn,
Al, Cr, Ni, Ag, Au и др.);
химических (пассивирование концентрированной азотной кислотой, оксодирование, науглероживание и др.)
Слайд 27Какое поверхностное
защитное покрытие
использовалось
в данном случае?
К какой группе
поверхностных
защитных покрытий
оно относится?
Барьерная защита
Слайд 28Какое поверхностное
защитное покрытие
использовалось
в данном случае?
К какой группе
поверхностных
защитных покрытий
оно относится?
Видео- фрагмент
Барьерная защита
Слайд 29Изменение состава металла (сплава)
Протекторная защита
- добавление в материал покрытия порошковых
металлов, создающих с металлом донорские электронные пары; создание контакта с
более активным металлом (для стали - цинк, магний, алюминий).
Под действием агрессивной среды постепенно растворяется порошок добавки, а основной материал коррозии не подвергается.
Слайд 30К основной конструкции прикрепляются заклёпки или пластины из более активного
металла, которые и подвергаются разрушению. Такую защиту используют в подводных
и подземных сооружениях.
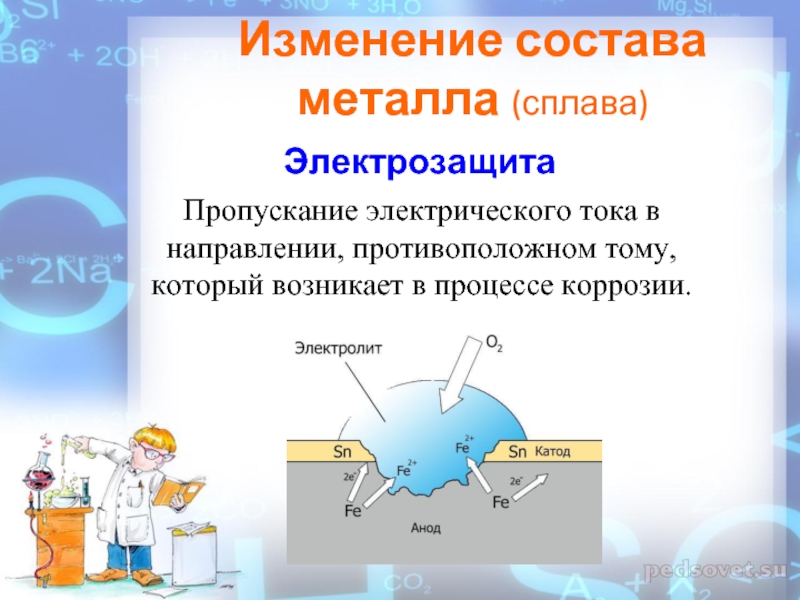
Слайд 31Пропускание электрического тока в направлении, противоположном тому, который возникает в
процессе коррозии.
Изменение состава металла (сплава)
Электрозащита
Слайд 32 В повседневной жизни человек чаще всего
встречается с покрытиями железа цинком и оловом. Листовое железо, покрытое
цинком, называют оцинкованным железом, а покрытое
оловом – белой жестью. Первое в больших количествах идет на кровли домов, а из второго изготавливают консервные банки.
Изменение состава металла (сплава)
Видео- фрагмент
Слайд 33Введение в металл легирующих добавок:
Cr, Ni, Ti, Mn, Mo,
V, W и др.
Изменение состава металла (сплава)
Легирование
Слайд 34Изменение среды
Ингибирование
Введение веществ, замедляющих коррозию (ингибиторов):
- для кислотной коррозии:
азотсодержащие органические основания, альдегиды, белки, серосодержащие органические вещества;
- в
нейтральной среде: растворимые фосфаты (Na3PO4), дихроматы (K2Cr2O7), сода (Na2CO3), силикаты (Na2SiO3);
- при атмосферной коррозии: амины, нитраты и карбонаты аминов, сложные эфиры карбоновых кислот.
Слайд 35В какой пробирке гвоздь не заржавел и почему?
Изменение среды
Слайд 36Изменение среды
Деаэрация - удаление веществ, вызывающих коррозию:
нагревание воды;
пропускание воды
через железные стружки;
химическое удаление кислорода
(например, 2Na2SO3 + O2
→ 2Na2SO4).
Слайд 37Подумай и объясни
(домашнее задание)
1. В раствор хлороводородной (соляной) кислоты
поместили пластинку из Zn и пластинку из Zn, частично покрытую
Cu. В каком случае процесс коррозии происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов.
2. Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов.