Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Окисление спиртов и альдегидов перманганатом калия
Содержание
- 1. Окисление спиртов и альдегидов перманганатом калия
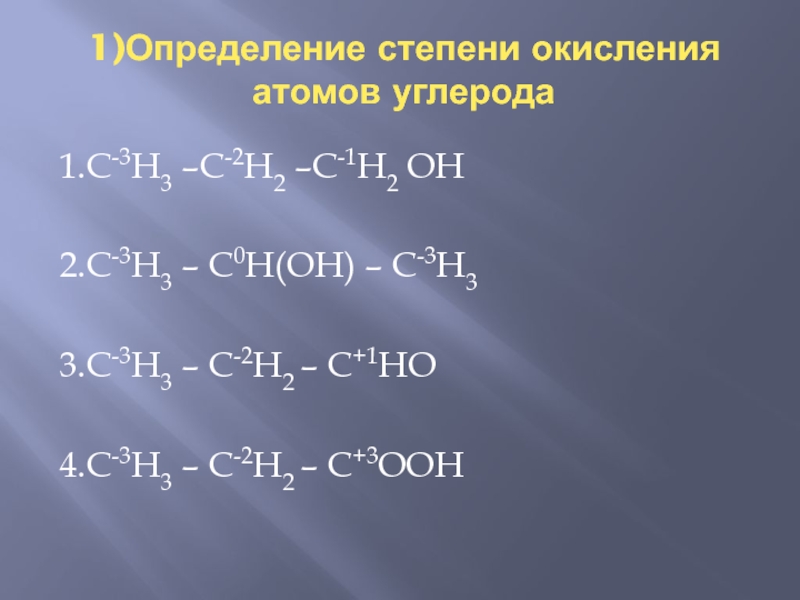
- 2. 1)Определение степени окисления атомов углерода 1.С-3Н3 –С-2Н2
- 3. 2)А. Окисление этанола в кислой среде.
- 4. Б)Окисление пропанола-2 СН3 – С0Н(ОН)
- 5. 2)В нейтральной среде:СН3 – С0Н(ОН) – СН3
- 6. В) Окисление метанола С-2Н3 ОН + КMn+7O4
- 7. Г) Окисление метаналя НС0НО + КMn+7O4 +
- 8. Д) Окисление этаналя СН3 – С+1НО
- 9. СН3 – С+1НО + КMn+7O4 +КОН
- 10. Скачать презентанцию
1)Определение степени окисления атомов углерода 1.С-3Н3 –С-2Н2 –С-1Н2 ОН2.С-3Н3 – С0Н(ОН) – С-3Н33.С-3Н3 – С-2Н2 – С+1НО 4.С-3Н3 – С-2Н2 – С+3ООН
Слайды и текст этой презентации
Слайд 21)Определение степени окисления атомов углерода
1.С-3Н3 –С-2Н2 –С-1Н2 ОН
2.С-3Н3 – С0Н(ОН)
– С-3Н3
С+3ООНСлайд 32)А. Окисление этанола в кислой среде.
СН3 –С-1Н2 – ОН
+ КMn+7O4 + H2 SO4 СН3 – С+1НО
+ Mn+2SO4 + K2SO4 +H2OC-1 - 2ē С+1 5 восстановитель
Mn+7 +5ē Mn+2 2 окислитель
Итоговое уравнение
5СН3 –СН2 – ОН + 2КMnO4 + 3H2 SO4 = 5СН3 – СНО + 2MnSO4 + K2SO4 +8H2O
Слайд 4Б)Окисление пропанола-2
СН3 – С0Н(ОН) – СН3 + КMn+7O4 +
H2 SO4 СН3 – С+2О – СН3 +
Mn+2SO4 + K2SO4 +H2OC0 - 2ē С+2 5 восстановитель
Mn+7 +5ē Mn+2 2 окислитель
Итоговое уравнение
5СН3 – СН(ОН) – СН3 + 2КMnO4 + 3H2SO4 = 5СН3 – СО – СН3 +2MnSO4 + K2SO4 +8H2O
1) В кислой среде:
Слайд 52)В нейтральной среде:
СН3 – С0Н(ОН) – СН3 + КMn+7O4
СН3 – С+2О – СН3 + Mn+4O2 + KОН+H2O
C0 - 2ē С+2 3 восстановительMn+7 +3ē Mn+4 2 окислитель
Итоговое уравнение
3СН3 – СН(ОН) – СН3 + 2КMnO4 = 3СН3 – СО – СН3 + 2MnO2 + 2KОН+2H2O
Слайд 6В) Окисление метанола
С-2Н3 ОН + КMn+7O4 + H2 SO4
С+4О2 + Mn+2SO4 + K2SO4 +H2O
C-2 - 6ē
С+4 5 восстановительMn+7 +5ē Mn+2 6 окислитель
Итоговое уравнение
5СН3 ОН + 6КMnO4 + 9H2 SO4 = 5СО2 + 6MnSO4 + 3K2SO4 +9H2O
Слайд 7Г) Окисление метаналя
НС0НО + КMn+7O4 + H2SO4
С+4О2 + Mn+2SO4 + K2SO4 +H2O
C0 - 4ē С+4
5 восстановительMn+7 +5ē Mn+2 4 окислитель
Итоговое уравнение
5НСНО +4КMnO4 + 6H2 SO4 = 5СО2 + 4MnSO4 + 2K2SO4 +11H2O
Слайд 8Д) Окисление этаналя
СН3 – С+1НО + КMn+7O4 + H2SO4
СН3 – С+3ООН + Mn+2SO4 + K2SO4 +H2O
C+1
- 2ē С+3 5 восстановительMn+7 +5ē Mn+2 2 окислитель
Итоговое уравнение
5СН3 – СНО + 2КMnO4 + 3H2SO4 = 5СН3 – СООН + 2MnSO4 + K2SO4 +3H2O
1)В кислой среде:
Слайд 9СН3 – С+1НО + КMn+7O4 +КОН СН3
– С+3ООК + Mn+2O2 +H2O
C+1 - 2ē С+3
3 восстановительMn+7 +3ē Mn+4 2 окислитель
Итоговое уравнение
3СН3 – СНО + 2КMnO4 +КОН = 3СН3 – СООК + 2MnO2 +2H2O
2) В щелочной среде: