Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая связь. Метод молекулярных орбиталей 11 класс
Содержание
- 1. Химическая связь. Метод молекулярных орбиталей 11 класс
- 2. Метод молекулярных орбиталей (МО) наиболее нагляден в
- 3. Перекрываются атомные орбитали, близкие по энергии. В
- 4. Молекулярная орбиталь, не участвующая в образовании химической
- 5. Применим метод МО ЛКАО и разберем строение
- 6. Далее мысленно перекроем две атомные орбитали, образовав
- 7. Видно, что имеется выигрыш в энергии по
- 8. Метод МО ЛКАО позволяет наглядно объяснить образование
- 9. В анионе Н2- на двух молекулярных орбиталях
- 10. Если два электрона, опустившись на связывающую орбиталь,
- 11. Известно, что щелочные металлы в газообразном состоянии
- 12. Перекрывание валентных 2s-орбиталей атомов лития приведет также
- 13. Перекрывание одинаковых 1s-орбиталей атомов лития даст
- 14. Используя метод МО ЛКАО, рассмотрим возможность образования
- 15. В этом случае два электрона займут связывающую
- 16. Методом МО ЛКАО легко продемонстрировать парамагнитные свойства
- 17. Перекрывание p-АО, направленных вдоль оси x -связи
- 18. Энергетическая диаграмма,иллюстрирующая с помощью метода МО ЛКАОпарамагнитные свойства молекулы O2
- 19. Среди молекулярных орбиталей молекулы кислорода, образовавшихся в
- 20. Среди двухатомных молекул одной из наиболее прочных
- 21. Результатом перекрывания p-орбиталей атомов O и C
- 22. Метод МО ЛКАО можно использовать не только
- 23. Поскольку три атома водорода имеют только три
- 24. Упражнения 1. Какие виды связей можно отнести
- 25. 5. Что такое электроотрицательность? Из каких данных
- 26. Упражнения 7. Используя метод валентных связей, объясните
- 27. Используемая литератураАхметов М. А. Конспект лекций по
- 28. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Химическая связь
Метод молекулярных орбиталей
Учитель химии
Ворсина Светлана Анатольевна
ГБОУ СОШ №10
с углубленным
Слайд 2Метод молекулярных орбиталей (МО) наиболее нагляден в его графической модели
линейной комбинации атомных орбиталей (ЛКАО). Метод МО ЛКАО основан на
следующих правилах.
При сближении атомов до расстояний химических связей из атомных орбиталей (АО) образуются молекулярные.
Число полученных молекулярных орбиталей равно числу исходных атомных.
Слайд 3Перекрываются атомные орбитали, близкие по энергии. В результате перекрывания двух
атомных орбиталей образуются две молекулярные. Одна из них имеет меньшую
энергию по сравнению с исходными атомными и называется связывающей, а вторая молекулярная орбиталь обладает большей энергией, чем исходные атомные орбитали, и называется разрыхляющей.При перекрывании атомных орбиталей возможно образование и σ-связи (перекрывание по оси химической связи), и π-связи (перекрывание по обе стороны от оси химической связи).
Слайд 4Молекулярная орбиталь, не участвующая в образовании химической связи, носит название
несвязывающей. Ее энергия равна энергии исходной АО.
На одной молекулярной орбитали
(как, впрочем, и атомной) возможно нахождение не более двух электронов.Электроны занимают молекулярную орбиталь с наименьшей энергией (принцип наименьшей энергии).
Заполнение вырожденных (с одинаковой энергией) орбиталей происходит последовательно по одному электрону на каждую из них.
Слайд 5Применим метод МО ЛКАО и разберем строение молекулы водорода. Изобразим
на двух параллельных диаграммах энергетические уровни атомных орбиталей исходных атомов
водорода.
Энергетическая диаграмма несвязанных атомов водорода
Слайд 6Далее мысленно перекроем две атомные орбитали, образовав две молекулярные, одна
из которых (связывающая) обладает меньшей энергией (расположена ниже), а вторая
(разрыхляющая) – большей энергией (расположена выше).
Диаграмма уровней энергии АО атомов H и МО молекулы H2
Слайд 7Видно, что имеется выигрыш в энергии по сравнению с несвязанными
атомами. Свою энергию понизили оба электрона, что соответствует единице валентности
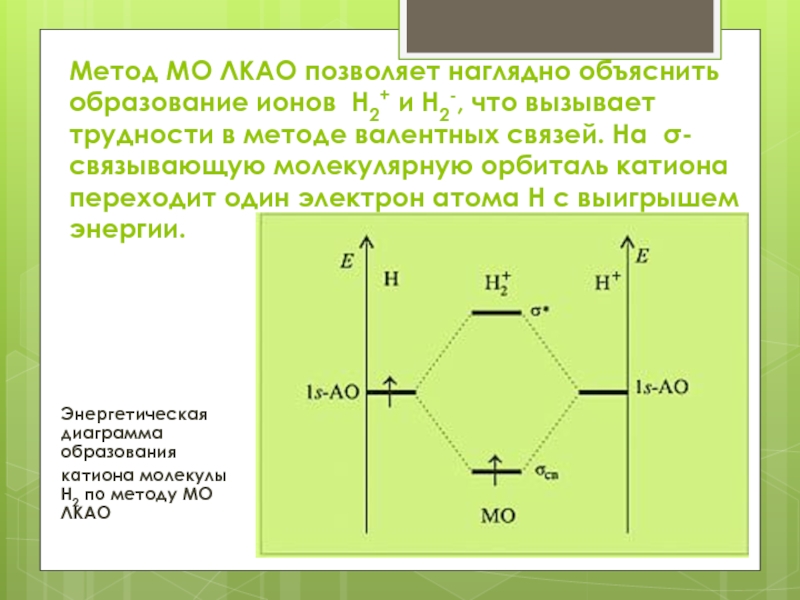
в методе валентных связей (связь образуется парой электронов).Слайд 8Метод МО ЛКАО позволяет наглядно объяснить образование ионов Н2+ и
Н2-, что вызывает трудности в методе валентных связей. На σ-связывающую
молекулярную орбиталь катиона переходит один электрон атома H с выигрышем энергии.
Энергетическая диаграмма образования
катиона молекулы H2 по методу МО ЛКАО
Слайд 9В анионе Н2- на двух молекулярных орбиталях необходимо разместить уже
три электрона
Энергетическая диаграмма образования
аниона молекулы H2 по методу МО ЛКАО
Слайд 10Если два электрона, опустившись на связывающую орбиталь, дают выигрыш в
энергии, то третьему электрону приходится повысить свою энергию. Однако энергия,
выигранная двумя электронами, больше, чем проигранная одним. Такая частица может существовать.Слайд 11Известно, что щелочные металлы в газообразном состоянии существуют в виде
двухатомных молекул. Попробуем убедиться в возможности существования двухатомной молекулы Li2,
используя метод МО ЛКАО.Энергетическая диаграмма образования
двухатомной молекулы Li2 по методу
МО ЛКАО
Слайд 12Перекрывание валентных 2s-орбиталей атомов лития приведет также к образованию одной
σ-связывающей и одной разрыхляющей молекулярных орбиталей. Два внешних электрона займут
связывающую орбиталь, обеспечивая общий выигрыш в энергии (кратность связи равна 1).Исходный атом лития содержит электроны на двух энергетических уровнях – первом и втором (1s и 2s).
Слайд 13
Перекрывание одинаковых 1s-орбиталей атомов лития даст две молекулярные орбитали
(связывающую и разрыхляющую), которые согласно принципу минимума энергии будут полностью
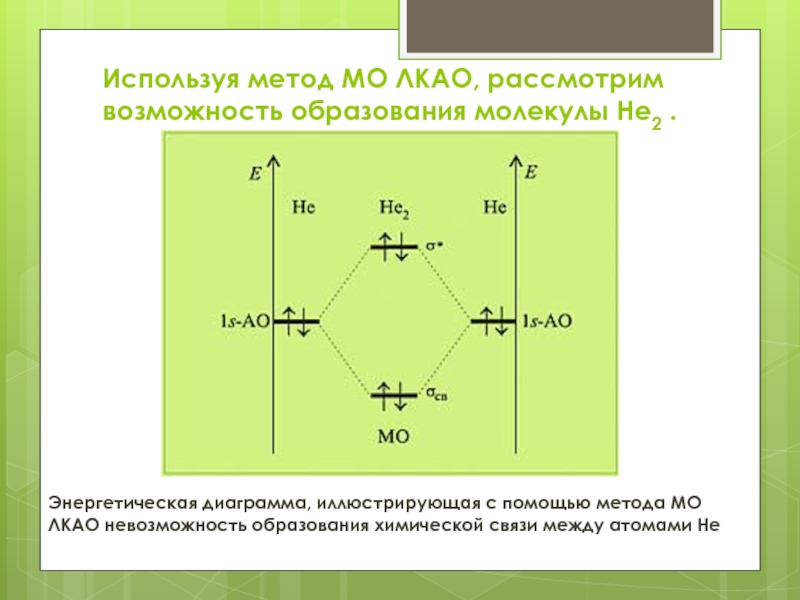
заселены четырьмя электронами. Выигрыш в энергии, получаемый в результате перехода двух электронов на связывающую молекулярную орбиталь, не способен компенсировать ее потери при переходе двух других электронов на разрыхляющую молекулярную орбиталь. Вот почему вклад в образование химической связи между атомами лития вносят лишь электроны внешнего (валентного) электронного слоя.Слайд 14Используя метод МО ЛКАО, рассмотрим возможность образования молекулы He2 .
Энергетическая
диаграмма, иллюстрирующая с помощью метода МО ЛКАО невозможность образования химической
связи между атомами HeСлайд 15В этом случае два электрона займут связывающую молекулярную орбиталь, а
два других – разрыхляющую. Выигрыша в энергии такое заселение двух
орбиталей электронами не принесет. Следовательно, молекулы He2 не существует.Слайд 16Методом МО ЛКАО легко продемонстрировать парамагнитные свойства молекулы кислорода. С
тем чтобы не загромождать рисунок, не будем рассматривать перекрывание 1s-орбиталей
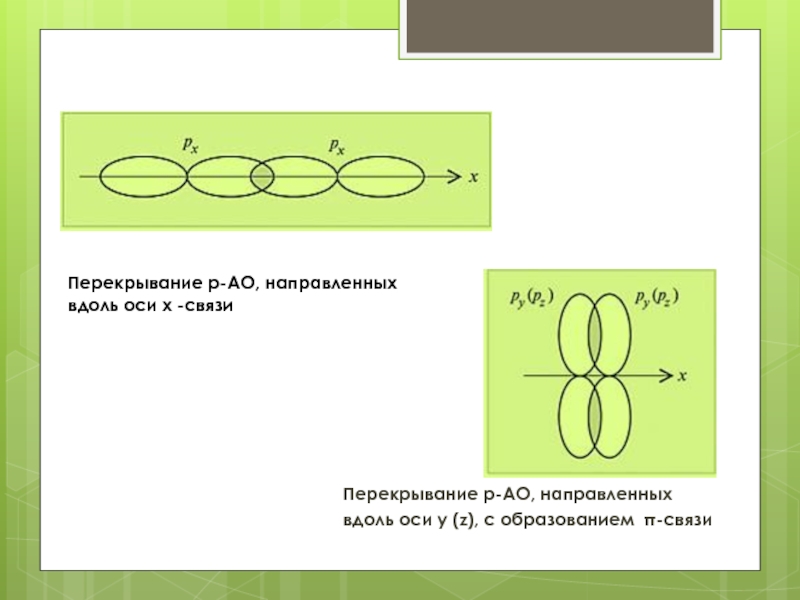
атомов кислорода первого (внутреннего) электронного слоя. Учтем, что p-орбитали второго (внешнего) электронного слоя могут перекрываться двумя способами. Одна из них перекроется с аналогичной с образованием σ-связи. Две других p-АО перекроются по обе стороны от оси x с образованием двух π-связей.Слайд 17Перекрывание p-АО, направленных вдоль оси x -связи
Перекрывание p-АО, направленных
вдоль оси y (z), с образованием π-связи
Слайд 18Энергетическая диаграмма,
иллюстрирующая с помощью метода МО ЛКАО
парамагнитные свойства молекулы O2
Слайд 19Среди молекулярных орбиталей молекулы кислорода, образовавшихся в результате перекрывания p-АО,
две π-связывающие вырожденные (с одинаковой энергией) орбитали обладают меньшей энергией,
чем σ-связывающая, впрочем, как и π*-разрыхляющие орбитали обладают меньшей энергией всравнении с
σ*-разрыхляющей
орбиталью.
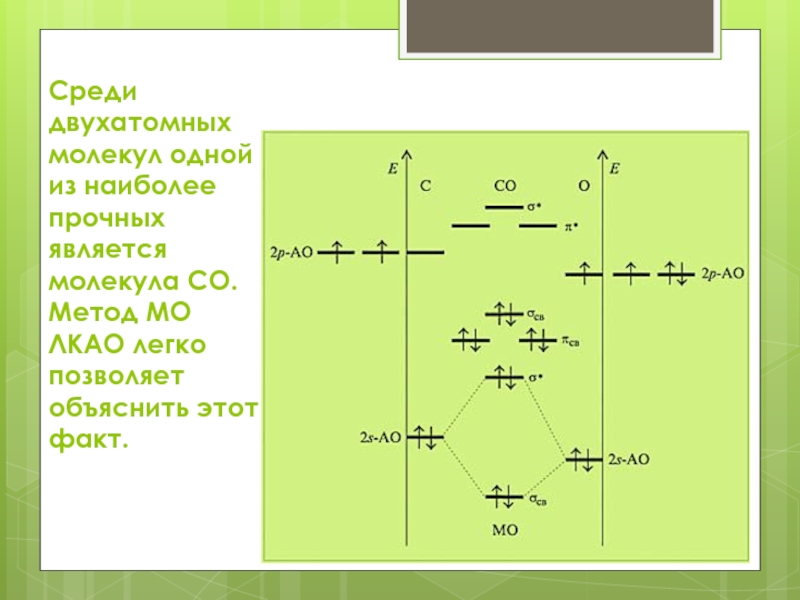
Слайд 20Среди двухатомных молекул одной из наиболее прочных является молекула CO.
Метод МО ЛКАО легко позволяет объяснить этот факт.
Слайд 21Результатом перекрывания p-орбиталей атомов O и C является образование двух
вырожденных π-связывающих и одной – σ связывающей орбитали. Эти молекулярные
орбитали займут шесть электронов. Следовательно, кратность связи равна трем.Слайд 22Метод МО ЛКАО можно использовать не только для двухатомных молекул,
но и для многоатомных. Разберем в качестве примера в рамках
данного метода строение молекулы аммиака.Слайд 23Поскольку три атома водорода имеют только три 1s-орбитали, то суммарное
число образованных молекулярных орбиталей будет равно шести (три связывающих и
три разрыхляющих). Два электрона атома азота окажутся на несвязывающей молекулярной орбитали (неподеленная электронная пара).Слайд 24Упражнения
1. Какие виды связей можно отнести к химическим?
2. Какие два
основных подхода к рассмотрению химической связи вам известны? В чем
состоит их отличие?3. Дайте определение валентности и степени окисления.
4. В чем состоят отличия простой ковалентной, донорно-акцепторной, металлической, ионной связей?
Слайд 255. Что такое электроотрицательность? Из каких данных электроотрицательность рассчитывается? О
чем электроотрицательности атомов, образующих химическую связь, позволяют судить? Как изменяется
электроотрицательность атомов элементов при продвижении в периодической таблице Д.И.Менделеева сверху вниз и слева направо?6. Какими правилами необходимо руководствоваться при рассмотрении строения молекул методом МО ЛКАО?
Упражнения
Слайд 26Упражнения
7. Используя метод валентных связей, объясните строение водородных соединений элементов
2-го периода.
8. Почему при обычных условиях CO2 – газ, а
SiO2 – твердое вещество, H2O – жидкость,а H2S – газ? Попробуйте объяснить агрегатное состояние веществ.
9. Используя метод МО ЛКАО, объясните возникновение и особенности химической связи в молекулах B2, C2, N2, F2, LiH, CH4.
10. Используя теорию отталкивания валентных электронных пар, определите формы молекул кислородных соединений элементов 2-го периода.