Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Окислительно-восстановительные реакции 11 класс
Содержание
- 1. Окислительно-восстановительные реакции 11 класс
- 2. Понятие окислительно-восстановительных реакций Химические реакции, протекающие
- 3. Окисление - процесс отдачи электронов атомом, молекулой
- 4. Восстановление - процесс присоединения электронов
- 5. Восстановители - атомы,
- 6. Окислители - атомы, молекулы или
- 7. На проявление окислительно-восстановительных свойств влияет такой фактор,
- 8. Например, азот имеет высокую электроотрицательность и мог
- 9. Или НСLO более сильный окислитель в растворе, чем НСLO4, так как НСLO – менее устойчивая кислота.
- 10. Если химический элемент находится в промежуточной степени окисления, то он проявляет свойства и окислителя, и восстановителя.
- 11. Степени окисления серы: -2,0,+4,+6 Н2S-2 - восстановитель2Н2S+3O2=2H2O+2SO2S0,S+4O2
- 12. Определение степеней окисления атомов химических элементовС.о. атомов
- 13. Классификация окислительно-восстановительных реакцийРеакции межмолекулярного окисления2Al0 + 3Cl20
- 14. Это полезно знатьСтепени окисления элементов в составе
- 15. Окислительные свойства концентрированной серной кислотыПродукты восстановления серы:H2SO4
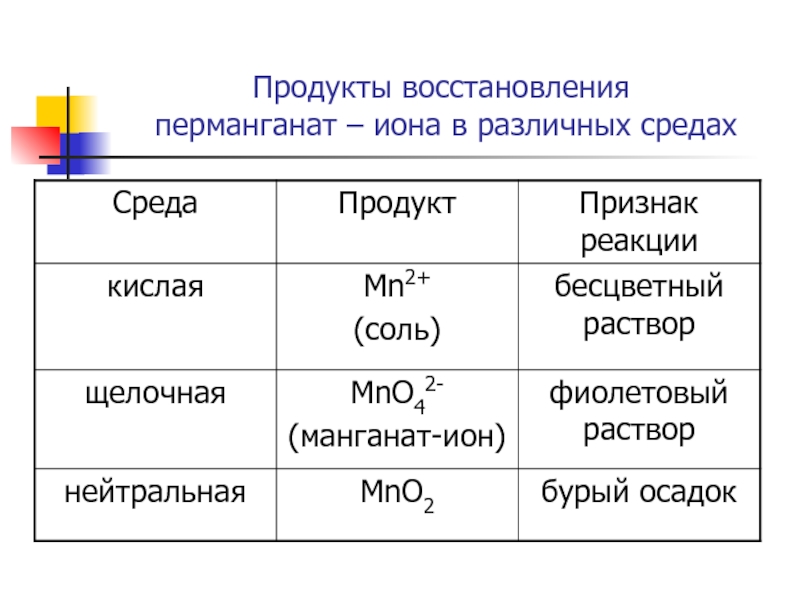
- 16. Продукты восстановления перманганат – иона в различных средах
- 17. Пероксид водорода в окислительно-восстановительных реакциях
- 18. Азотная кислота в окислительно-восстановительных реакцияхПродукты восстановления азота:Концентрированная
- 19. Значение ОВРОВР чрезвычайно распространены. С ними связаны
- 20. Скачать презентанцию
Понятие окислительно-восстановительных реакций Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными
Слайды и текст этой презентации
Слайд 3Окисление - процесс отдачи электронов атомом, молекулой или ионом.
Атом превращается
в положительно заряженный ион: Zn0 – 2e
→ Zn2+отрицательно заряженный ион становится нейтральным атомом: 2Cl- -2e →Cl20
S2- -2e →S0
Величина положительно заряженного иона (атома) увеличивается соответственно числу отданных электронов: Fe2+ -1e →Fe3+
Mn+2 -2e →Mn+4
Слайд 4 Восстановление - процесс присоединения электронов атомом, молекулой или
ионом.
Атом превращается в отрицательно заряженный ион
S0 + 2e → S2−
Br0
+ e → Br −Величина положительно заряженного иона (атома)
уменьшается соответственно числу присоединенных электронов: Mn+7 + 5e → Mn+2
S+6 + 2e → S+4
− или он может перейти в нейтральный атом:
Н+ + е → Н0
Cu2+ + 2e → Cu0
Слайд 5 Восстановители - атомы, молекулы или
ионы, отдающие электроны. Они в процессе
ОВР окисляютсяТипичные восстановители:
● атомы металлов с большими атомными радиусами (I-А, II-А группы), а так же Fe, Al, Zn
● простые вещества-неметаллы: водород, углерод, бор;
● отрицательно заряженные ионы: Cl−, Br−, I−, S2−, N−3. Не являются восстановителем фторид- ионы F−.
● ионы металлов в низшей с.о.: Fe2+,Cu+,Mn2+,Cr3+;
● сложные ионы и молекулы, содержащие атомы с промежуточной с.о.: SO32−, NO2−; СО, MnO2 и др.
Слайд 6 Окислители - атомы, молекулы или ионы, присоединяющие электроны.
Они в процессе ОВР восстанавливаются
Типичные окислители:
●
атомы неметаллов VII-А, VI-А, V-A группы в составе простых веществ● ионы металлов в высшей с.о.:
Cu2+, Fe3+,Ag+ …
● сложные ионы и молекулы, содержащие атомы с высшей и высокой с.о.: SO42−, NO3−, MnO4−, СlО3−, Cr2O72-, SO3, MnO2 и др.
Слайд 7На проявление окислительно-восстановительных свойств влияет такой фактор, как устойчивость молекулы
или иона. Чем прочнее частица, тем в меньшей степени она
проявляет окислительно-восстановительные свойстваСлайд 8Например, азот имеет высокую электроотрицательность и мог бы быть сильным
окислителем в виде простого вещества, но в его молекуле тройная
связь, молекула очень устойчивая, азот химически пассивен.Слайд 9Или НСLO более сильный окислитель в растворе, чем НСLO4, так
как НСLO – менее устойчивая кислота.
Слайд 10Если химический элемент находится в промежуточной степени окисления, то он
проявляет свойства и окислителя, и восстановителя.
Слайд 11Степени окисления серы: -2,0,+4,+6
Н2S-2 - восстановитель
2Н2S+3O2=2H2O+2SO2
S0,S+4O2 – окислитель и восстановитель
S+O2=SO2
2SO2+O2=2SO3
(восстановитель)S+2Na=Na2S SO2+2H2S=3S+2H2O
(окислитель)
Н2S+6O4 - окислитель
Cu+2H2SO4=CuSO4+SO2+2H2O
Слайд 12Определение степеней окисления атомов химических элементов
С.о. атомов х/э в составе
простого вущества = 0
Алгебраическая сумма с.о. всех элементов в составе
иона равна заряду ионаАлгебраическая сумма с.о. всех элементов в составе сложного вещества равна 0.
K+1 Mn+7 O4-2
1+х+4(-2)=0
Слайд 13Классификация окислительно-восстановительных реакций
Реакции межмолекулярного окисления
2Al0 + 3Cl20 → 2Al+3 Cl3-1
Реакции
внутримолекулярного окисления
2KCl+5O3-2 →2KCl-1 + 3O20
Реакции диспропорционирования, дисмутации
(самоокисления-самовосстановления):
3Cl20
+ 6KOH (гор.) →KCl+5O3 +5KCl-1+3H2O2N+4O2+ H2O →HN+3O2 + HN+5O3
Слайд 14Это полезно знать
Степени окисления элементов в составе аниона соли такие
же, как и в кислоте, например: (NH4)2Cr2+6O7 и H2Cr2+6O7
Степень окисления
кислорода в пероксидах равна -1
Степень окисления серы в некоторых сульфидах равна -1, например: FeS2
Фтор- единственный неметалл, не имеющий в соединениях положительной степени окисления
В соединениях NH3, CH4 и др. знак электроположительного элемента водорода на втором месте
Слайд 15Окислительные свойства концентрированной серной кислоты
Продукты восстановления серы:
H2SO4 + оч.акт. металл
(Mg, Li, Na…) → H2S
H2SO4 + акт. металл (Mn, Fe,
Zn…) → SH2SO4 + неакт. металл (Cu, Ag, Sb…) → SO2
H2SO4 + HBr → SO2
H2SO4 + неметаллы (C, P, S…) → SO2
Примечание: часто возможно образование смеси этих продуктов в различных пропорциях
Слайд 18Азотная кислота в окислительно-восстановительных реакциях
Продукты восстановления азота:
Концентрированная HNO3: N+5 +1e
→ N+4 (NO2)
(Ni, Cu, Ag, Hg; C, S,
P, As, Se); пассивирует Fe, Al, CrРазбавленная HNO3: N+5 +3e → N+2 (NO)
(Металлы в ЭХРНМ Al …Cu; неметаллы S, P, As, Se)
Разбавленная HNO3: N+5 +4e → N+1 (N2O) Ca, Mg, Zn
Разбавленная HNO3: N+5 +5e → N0 (N2)
Очень разбавленная: N+5 + 8e → N-3 (NH4NO3)
(активные металлы в ЭХРНМ до Al)