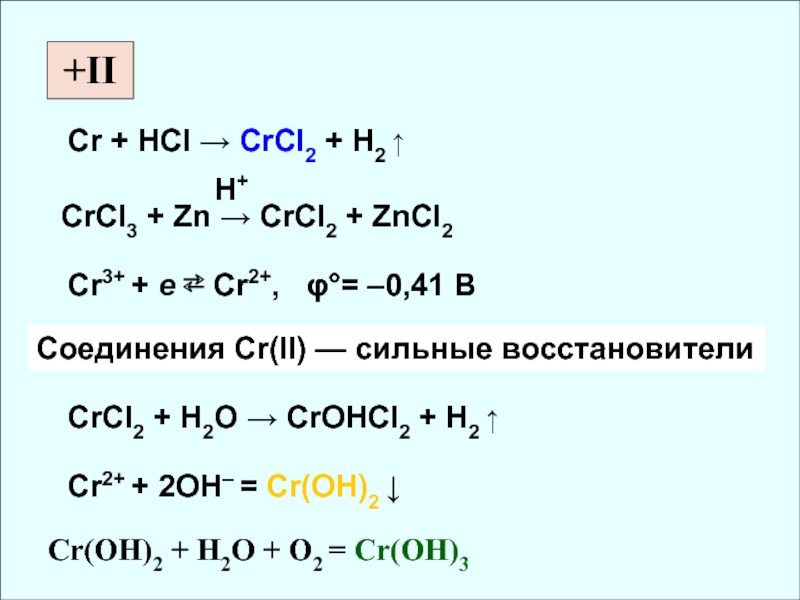
rат, нм
СО Cr [Ar] 3d54s1 0,126 II, III, VI
Mo [Kr] 4d55s1 0,136 (IV, V), VI
W [Xe] 4f145d46s2 0,137 (IV, V), VI
✓ r Mo ≈ r W как следствие лантаноидного сжатия
✓ Склонность к проявлению высшей СО растёт
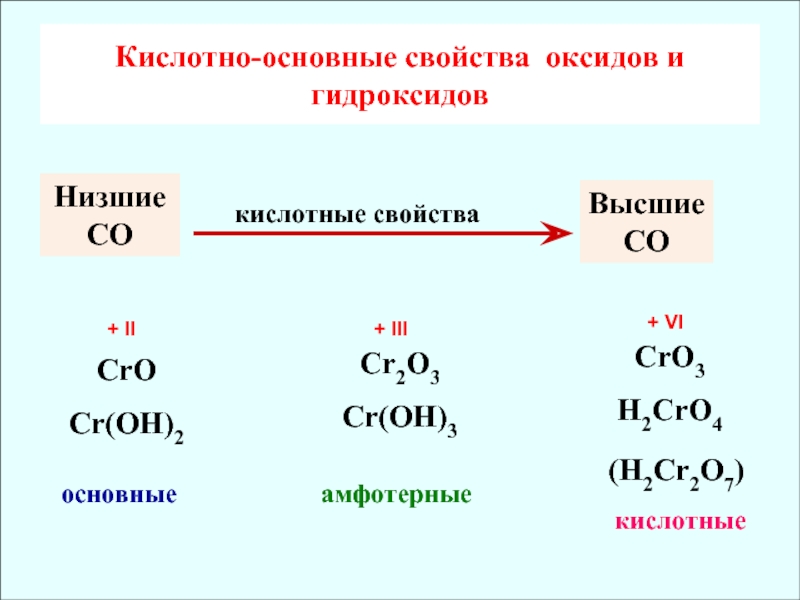
✓ Убывание кислотных свойств (H2CrO4 и H2MoO4)
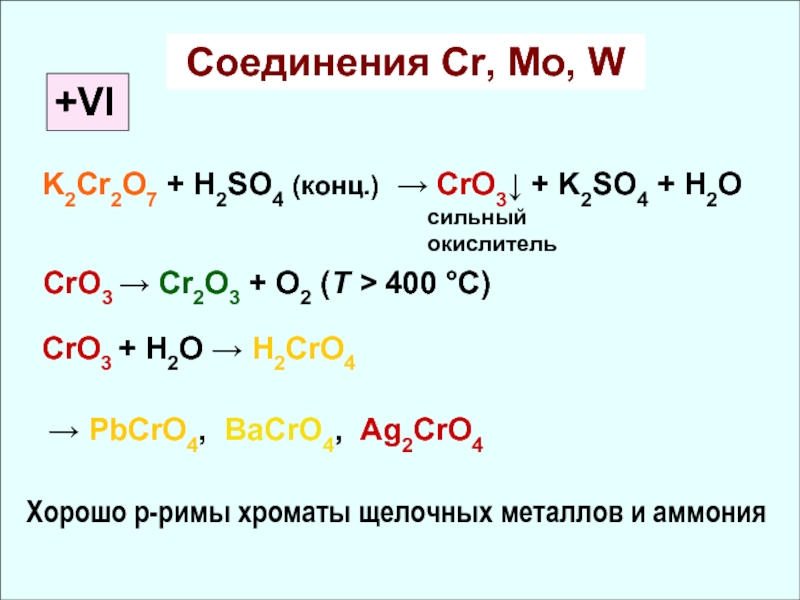
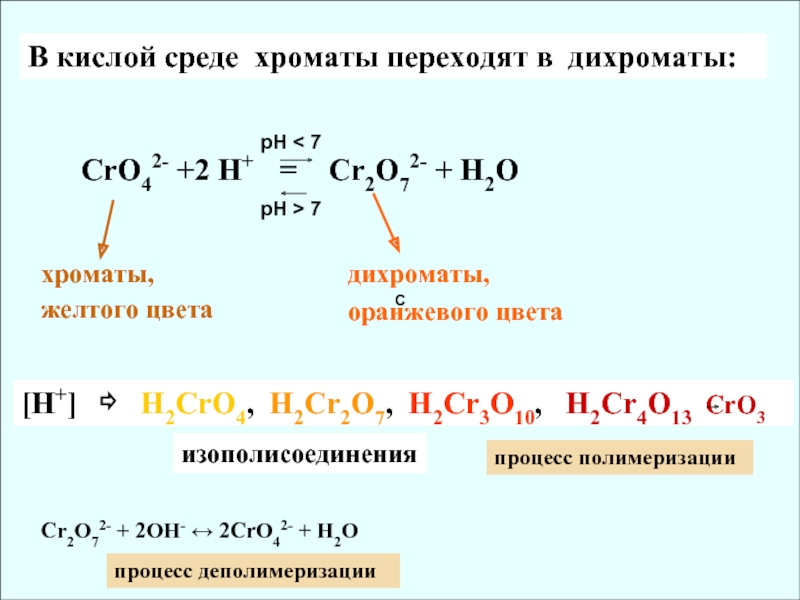
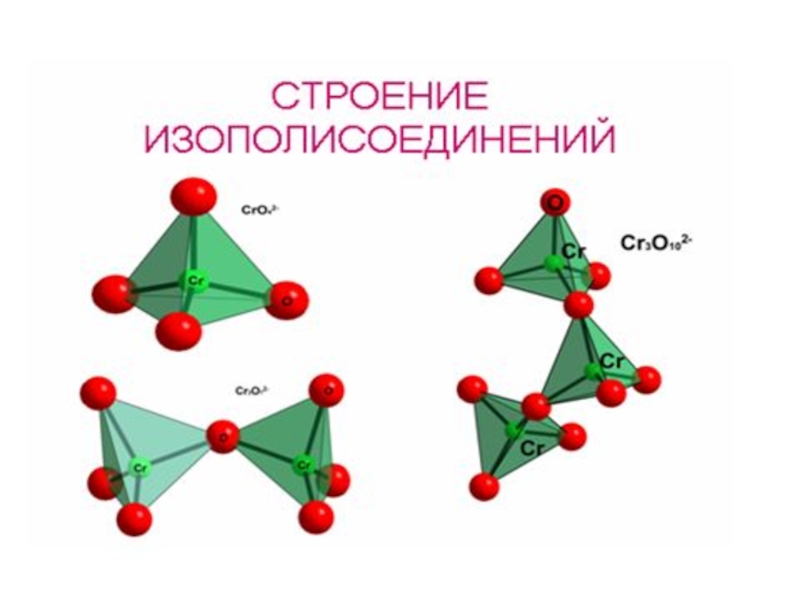
✓ Активные комплексообразователи (изополи- и
гетерополисоединения)


![Химия элементов VIB подгруппы Cr, Mo, W Cr + H2SO4 (разб.) → СrSO4 + H2↑Mo + H2SO4 (конц.) Cr + H2SO4 (разб.) → СrSO4 + H2↑Mo + H2SO4 (конц.) → H4[MoO4SO4] + SO2↑+ H2O (MoO2SO4)](/img/thumbs/11be14477083b6c0583bb7fd830b3cd6-800x.jpg)
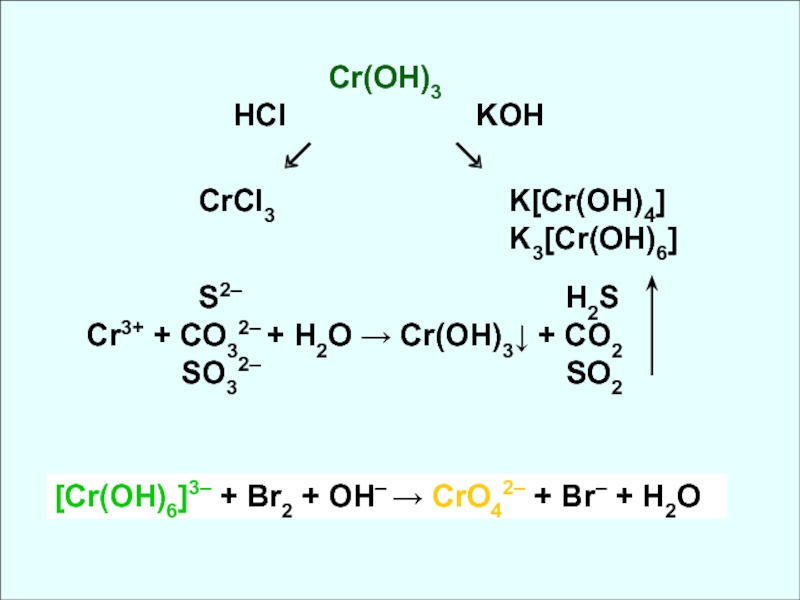
![Химия элементов VIB подгруппы Cr, Mo, W Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2OCr(OH)3 + NaOH = Na[Cr(OH)4]тетрагидроксохромит Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2OCr(OH)3 + NaOH = Na[Cr(OH)4]тетрагидроксохромит натрияCr2O3 + NaOH = NaCrO2](/img/thumbs/76259c4e2358cb6dbe7c64bb9de248f0-800x.jpg)



![Химия элементов VIB подгруппы Cr, Mo, W Вольфрам. Изополисоединения. [H2W12O42]10-- паравольфрамат Б-ион; [H2W12O40]6-- метавольфрамат-ион[W7O24]6-- паравольфрамат А-ионNa2MoO4 —→ 3MoO3 Вольфрам. Изополисоединения. [H2W12O42]10-- паравольфрамат Б-ион; [H2W12O40]6-- метавольфрамат-ион[W7O24]6-- паравольфрамат А-ионNa2MoO4 —→ 3MoO3 • Mo2O5 • H2O ↓Молибденовые и](/img/thumbs/85d38bf67a3cabf358ed6fa30bbfb7df-800x.jpg)


![Химия элементов VIB подгруппы Cr, Mo, W [Cr(H2O)6]3+ [Cr(H2O)5OH]2+ [Cr(H2O)6]3+ [Cr(H2O)5OH]2+](/img/thumbs/6eddf412327c151025d5784b88728af0-800x.jpg)
![Химия элементов VIB подгруппы Cr, Mo, W CrIIICrVICr3+[Cr(OH)6]3-Cr2O72-CrO42-H+H+OH-OH-Схема переходов CrIII в CrVI в различных средах+ восстановитель+ окислитель CrIIICrVICr3+[Cr(OH)6]3-Cr2O72-CrO42-H+H+OH-OH-Схема переходов CrIII в CrVI в различных средах+ восстановитель+ окислитель](/img/thumbs/9d5e14e6ff842f9aca3ea043c96efd09-800x.jpg)