Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Общая химия: Кинетика химических реакций (скорости и механизмы).
Содержание
- 1. Общая химия: Кинетика химических реакций (скорости и механизмы).
- 2. Молекулярность химической реакции – число частиц в
- 3. Классификация реакцийпростые реакции - осуществляются посредством однотипных
- 4. Скорость реакции (Vr)Скорость реакции (Vr) – изменение
- 5. Скорость реакциизависит от факторов:природы реагирующих веществ;концентрации реагирующих веществ;температуры;наличия катализатора;величины поверхности раздела фаз (для гетерогенных реакций);
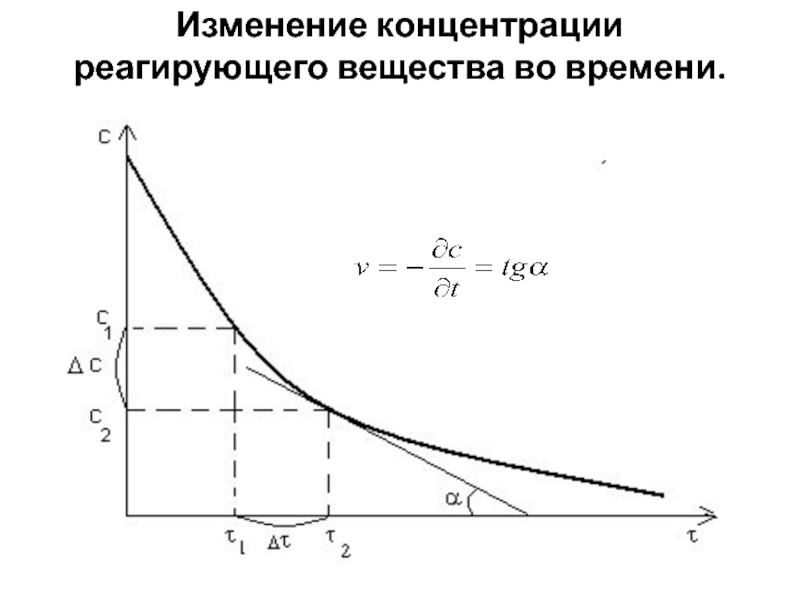
- 6. Изменение концентрации реагирующего вещества во времени.
- 7. Зависимость скорости реакции от концентрации реагирующих веществСредняя скорость реакцииИстинная скорость реакции
- 8. −dc /dτ = k·cn
- 9. Дифференциальные и интегральные уравнения для реакций различного порядка
- 10. «частный порядок» реакцииaА + bВ → dD
- 11. Молекулярность и порядок реакцииCOCl2 → CO +
- 12. Молекулярность и порядок реакции2 NO2 → N2
- 13. Истинная и экспериментальная константаH2O2 + 2I− +
- 14. Экспериментальные методы определения константV = k·cn lgV = lgk + nlgc
- 15. Скачать презентанцию
Молекулярность химической реакции – число частиц в единичном столкновении реакцииМОНОМОЛЕКУЛЯРНЫЕ J2 ↔ 2JCaCO3 → CaO + CO2 БИМОЛЕКУЛЯРНЫЕ H2 + J2 ↔ 2HJ ТРИМОЛЕКУЛЯРНЫЕ H2 + 2NO → N2O + H2O?4NH3 + 5O2 → 4NO +
Слайды и текст этой презентации
Слайд 2Молекулярность химической реакции – число частиц в единичном столкновении реакции
МОНОМОЛЕКУЛЯРНЫЕ
J2
↔ 2J
CaCO3 → CaO + CO2
БИМОЛЕКУЛЯРНЫЕ
H2 + J2 ↔ 2HJ
ТРИМОЛЕКУЛЯРНЫЕ
H2
+ 2NO → N2O + H2O?
4NH3 + 5O2 → 4NO + 6H2O
Слайд 3Классификация реакций
простые реакции - осуществляются посредством однотипных элементарных актов
сложные реакции
осуществляются посредством разнотипных элементарных актов (последовательных, параллельных, последовательно-параллельных, цепных, сопряженных
и т.д.)лимитирующая стадия реакции – элементарный акт, определяющий скорость реакции в целом: для строго последовательных реакций – это самая медленная стадия; для строго параллельных реакций – самая быстрая.
Слайд 4Скорость реакции (Vr)
Скорость реакции (Vr) – изменение количества исходных веществ
или продуктов реакции, происходящие в единицу времени (τ) в единице
объема (для гомогенных реакций)или на единице площади поверхности (для гетерогенных реакций).
Слайд 5Скорость реакции
зависит от факторов:
природы реагирующих веществ;
концентрации реагирующих веществ;
температуры;
наличия катализатора;
величины
поверхности раздела фаз (для гетерогенных реакций);
Слайд 7Зависимость скорости реакции от концентрации реагирующих веществ
Средняя скорость реакции
Истинная скорость
реакции
Слайд 10«частный порядок» реакции
aА + bВ → dD
v =
−dc(А) /dτ = −dc(В) /dτ
= k·c(A)p·c(B)q
c(A),
c(B) – концентрации реагентов, моль/л; k – константа скорости реакции, равная скорости при концентрациях реагирующих веществ 1 моль/л;
p – порядок реакции по реагенту А;
q – порядок реакции по реагенту В.
Слайд 11Молекулярность и порядок реакции
COCl2 → CO + Cl2
реакция сложная
и обратимая в данных условиях n = 1,5
Слайд 12Молекулярность и порядок реакции
2 NO2 → N2 + 2O2
- реакция
простая n = 2 и не обратима в данных
условиях.Слайд 13Истинная и экспериментальная константа
H2O2 + 2I− + 2H+ → I2
+ 2H2O
I2 + 2S2O32- → 2I- + S4O62-
С(I-) = const,
C(H+) = constV = K(ист)· С(I-)· C(H+)· C(H2O2)
K(эксп) =K(ист)· С(I-)· C(H+)
V = K(эксп) ·C(H2O2)