Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение атома
Содержание
- 1. Строение атома
- 2. ТЕМЫ:Современные представления о строении атомов Закономерности изменения
- 3. Строение атомаЗадание А1: число нейтронов в ядре
- 4. Строение атомаАтом (от греч. atomos - неделимый)
- 5. Атомные частицы и их свойстваАтом состоит из
- 6. Строение атомаЯдро атома - образование из протонов
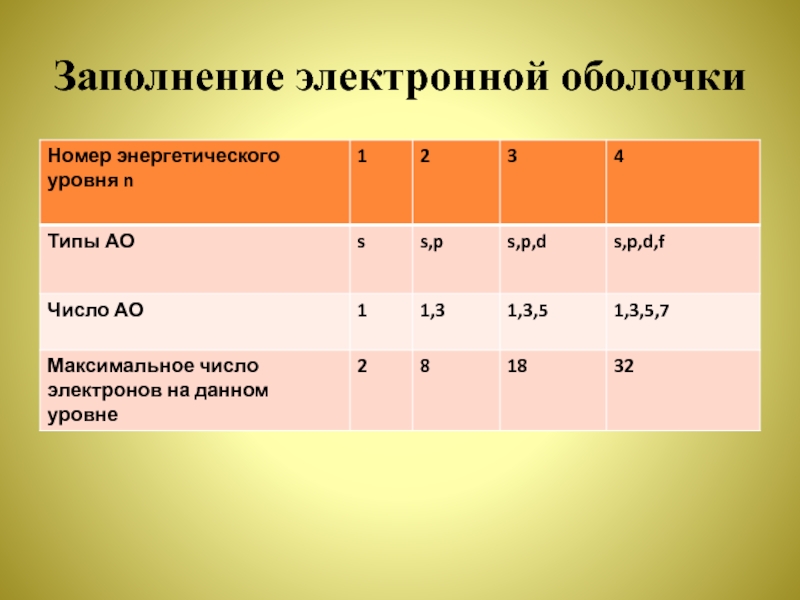
- 7. Заполнение электронной оболочки
- 8. Строение атомаЗадание А1: число нейтронов в ядре
- 9. Строение атомаЯдро любого химического элемента состоит из
- 10. Строение атомаСоставьте электронную формулу химического элемента № 17
- 11. Строение атома1. Элемент № 17 называется хлор
- 12. Строение атома11. На втором энергетическом уровне атома
- 13. Строение атома18. На третьем энергетическом уровне в
- 14. Строение атомаэлектронная формула иона Br-1)… 2)…. 3)… 4)…
- 15. Строение атомаэлектронная формула атома брома Br0 1s22s22p63s23p63d104s24p5атома
- 16. Строение атомаАтом металла имеет электронную конфигурацию 1s2
- 17. Строение атома1s2 2s2 2p6 3s2Э+21)Э+2О-2; Э+2 (ОН)-2;Э+2SO4-2
- 18. ХИМИЧЕСКАЯ СВЯЗЬЗадание :Укажите соединение с ионной связью1) CaCl2; 2)SO2; 3)Br2 4)H2O
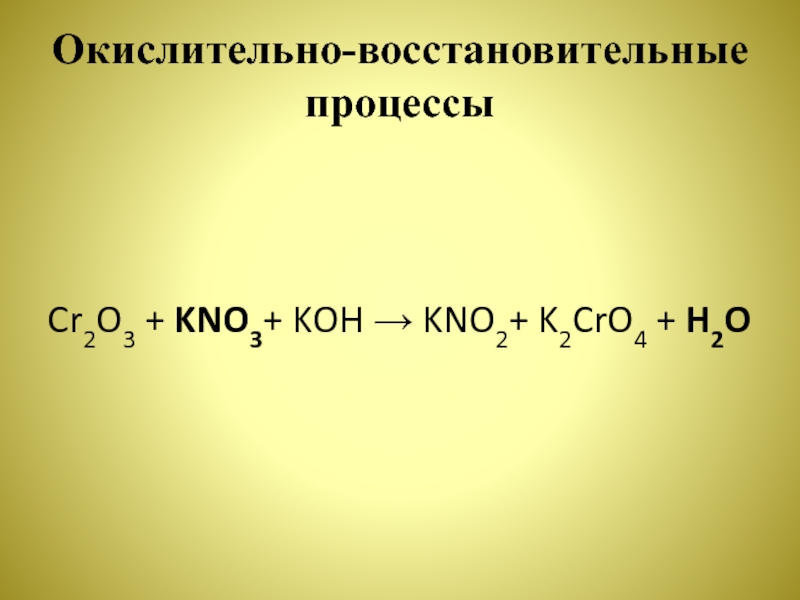
- 19. Окислительно-восстановительные процессыИспользуя метод электронного баланса, составьте уравнение
- 20. Окислительно-восстановительные процессыCr2O3 + KNO3+ KOH → KNO2+ K2CrO4 + H2O
- 21. Окислительно-восстановительные процессы1) Составлен электронный баланс:N+5 + 2ē → N+3 32Cr+3– 6ē → 2Cr+6 1
- 22. Окислительно-восстановительные процессыCr2O3 + 3KNO3+ 4KOH → 3KNO2+
- 23. Скачать презентанцию
ТЕМЫ:Современные представления о строении атомов Закономерности изменения химических свойств элементов и их соединений по периодам и группам периодической системы химических элементов Д.И. Менделеева Химическая связь
Слайды и текст этой презентации
Слайд 1
Единый государственный экзамен по ХИМИИ (консультация 2)
О.П. Костенко,
проректор
ГОУ РК «ИПК РО»
Слайд 2ТЕМЫ:
Современные представления о строении атомов
Закономерности изменения химических свойств элементов
и их соединений по периодам и группам периодической системы химических
элементов Д.И. МенделееваХимическая связь
Слайд 3Строение атома
Задание А1: число нейтронов в ядре атома изотопа углерода
с относительной атомной массой равной 12
1) 4; 2)12; 3)6;
4)2Слайд 4Строение атома
Атом (от греч. atomos - неделимый) - наименьшая химическая
частица, состоящая из массивного положительно заряженного ядра и движущихся в
электрическом поле ядра отрицательно заряженных электроновСлайд 5Атомные частицы и их свойства
Атом состоит из трёх видов частиц:
Электрон
- (е) - заряд отрицательный,
. q=-1,6 . 10-19Кл. Масса mе =9,1.10-31кгПротон – (р)- заряд положительный .
q = 1,6 . 10-19Кл, Масса mр = 1840 mе
Нейтрон –(n)- не заряжен, . Масса mn≈ mр
Слайд 6Строение атома
Ядро атома - образование из протонов и нейтронов, находящееся
в центральной части атома. Содержит в себе весь положительный заряд
и большую часть массы атома (>99,95%).Количество протонов в ядре, которое равно порядковому номеру элемента в Периодической системе Д.И.Менделеева и поэтому называется атомным номером элемента, определяет благодаря электронейтральности атома число электронов, а следовательно, электронное строение и определяемые им химические свойства элемента.
Количество нейтронов в ядрах атомов одного элемента может различаться; такие атомы называются изотопами этого элемента
Слайд 8Строение атома
Задание А1: число нейтронов в ядре атома изотопа углерода
с относительной атомной массой равной 12
1) 4; 2)12; 3)6;
4)2Слайд 9Строение атома
Ядро любого химического элемента состоит из нуклонов.
2. Относительная масса
одного нуклона равна 1
3. Масса ядра изотопа углерода составляет 12
атомных единиц массы, следовательно, в составе его ядра 12 нуклонов.4. В ядре химического элемента имеется два вида нуклонов, одни имеют заряд +1, другие 0.
5. Элементарная частица, имеющая массу 1 и заряд +1, называется протон.
6. В ядре атома изотопа углерода 12С находится 6 протонов
7. Элементарная частица, имеющая массу 1 и заряд 0, называется нейтрон.
8. Определим число нейтронов в ядре изотопа углерода 12С. С этой целью из числа нуклонов вычтем число протонов.
Число нейтронов = число нуклонов - число протонов.
В ядре атома изотопа углерода 12С находится нейтронов.
Ответ: в составе ядра изотопа углерода 12С имеется 6 протонов и 6 нейтронов
Слайд 11Строение атома
1. Элемент № 17 называется хлор и имеет химический
символ Cl.
2. Элемент хлор находится в третьем периоде.
3. Внешним энергетическим
уровнем в атоме хлора является уровень под номером 3.4. Элемент хлор находится в группе номер VII.
5. Хлор входит в подгруппу А.
6. На внешнем электронном уровне атома хлора имеется 7 электронов.
7. Заряд ядра атома элемента хлора равен +17.
8. На трёх энергетических уровнях атома хлора располагаются 17 электронов.
9. На первом энергетическом уровне атома хлора располагаются 2 электрона.
10. Первый электронный уровень любого атома периодической системы, кроме атома водорода, можно представить так: 1s2.
Слайд 12Строение атома
11. На втором энергетическом уровне атома хлора находится 8
электронов.
17 - (2 + 7) = 8
12. На втором энергетическом
уровне имеются два подуровня s и р.13. Число электронов в атоме хлора на втором s - подуровне равняется 2.
14. Число электронов в атоме хлора на втором р - подуровне равняется 6.
8 - 2 = 6
15. Число электронов находящихся на одной р -орбитали не может быть больше чем 2.
16. На втором энергетическом уровне в атоме хлора имеется три р - орбитали, расположенных перпендикулярно друг-другу.
17. Расположение электронов на втором энергетическом уровне можно записать так: 2s22p6. Если прибавить эту запись к ранее сделанной записи первого энергетического уровня, то получится:
1s22s22p6
Слайд 13Строение атома
18. На третьем энергетическом уровне в атоме хлора имеется
три подуровня s, р, d. Из них заполняется семью электронами
только два s и р, d - подуровень остаётся пустым.19. Расположение электронов на третьем энергетическом уровне можно записать так: 3s23p5. Если добавить эту запись к ранее сделанной записи первого и второго энергетического уровней, то получится электронная формула атома хлора:
1s22s22p63s23p5
Ответ: электронная формула атома хлора 1s22s22p63s23p5.
Слайд 15Строение атома
электронная формула атома брома Br0 1s22s22p63s23p63d104s24p5
атома брома Br0 превращается
в ион брома Br – присоединяя 1 e
электронная формула иона
брома Br- 1s22s22p63s23p63d104s24p6Слайд 16Строение атома
Атом металла имеет электронную конфигурацию 1s2 2s2 2p6 3s2,
формула оксида, гидроксида и сульфата этого элемента
1)ЭО; Э(ОН)2;ЭSO4 2) Э2О;
ЭОН;Э2SO4 3)ЭО; ЭОН;ЭSO4 4)Э 2 О 2; Э(ОН)2;Э 2 SO4