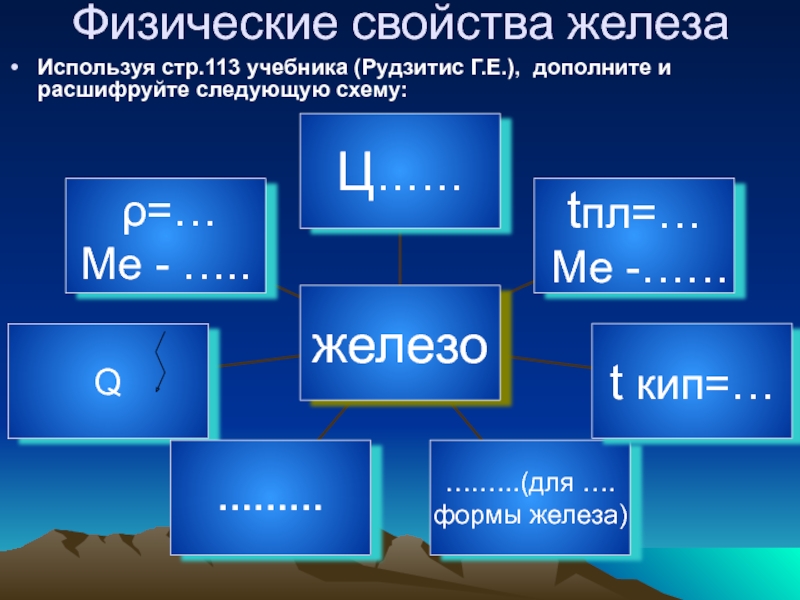
простом веществе: его свойствах, применении, биороли; изучить химические свойства соединений
железа;развивать умения прогнозировать свойства вещества, составлять уравнения химических реакций, работать с тестами, проводить эксперимент; развивать понятийное и теоретическое мышление.
Цели урока:





![Железо и его соединения Получение железаРазложение …………железа: [Fe(CO)5 ] → Fe + 5CO Получение железаРазложение …………железа: [Fe(CO)5 ] → Fe + 5CO](/img/thumbs/9f96a2ada0e4d29e46075684d6c3e123-800x.jpg)











![Железо и его соединения Проверь себя на «4»В-1Fe→ Fe2O3 → FeCl3 → Fe2(SO4)3→Fe(OH)3 →K3[Fe(OH)6]В-2Fe→ Проверь себя на «4»В-1Fe→ Fe2O3 → FeCl3 → Fe2(SO4)3→Fe(OH)3 →K3[Fe(OH)6]В-2Fe→ FeCl3 → FeCl2 → Fe(OН)2→Fe(OH)3 →](/img/thumbs/7c91d4ece47bc97da287338b48e79be0-800x.jpg)