Слайд 1КИСЛОТЫ
Выполнила учитель химии МБОУ СОШ
№ 79 г.о. Самара
Язрикова Л.М.
Слайд 2УДИВИТЕЛЬНЫЕ ФАКТЫ
Ботаникам известно более восьмисот видов растений, вырабатывающих синильную
кислоту и использующих ее как оружие межвидовой борьбы.
И муравьи,
и крапива содержат муравьиную кислоту, которая при соприкосновении сильно обжигают кожу.
Некоторые жуки выстреливают парами серной кислоты.
Мухоморы в качестве ядовитых токсинов «используют» иботеновую кислоту
Тропический паук педипальпида стреляет во врагов струйкой жидкости, содержащей 84% уксусной кислоты.
Слайд 3КИСЛОТЫ В НАШЕЙ ПИЩЕ
Фрукты, овощи, молочные продукты, лекарства поставляют целый
букет кислот: яблочную, щавелевую, лимонную, миндальную, молочную, масляную, кофейную, уксусную,
аскорбиновую и другие.
Даже синильная кислота (сильнейший яд) знакома каждому, кто лакомился ядрышками косточек слив, вишен или миндаля. Количество ее мизерно, но ощутить вкус и запах можно. Так что ядрышками увлекаться не следует, особенно если они взяты из недозрелых плодов или прошлогодних компотов.
Слайд 4КИСЛОТЫ В НАШЕЙ ЖИЗНИ
Аскорбиновая, фолиевая, оротовая, пангамовая, никотиновая и
другие кислоты являются витаминами.
Аминокислоты, соединяясь друг с другом в самых
причудливых сочетаниях, образуют великое множество белков.
Фосфорная кислота в виде своих кальциевых, магниевых и стронциевых солей – основной «конструкционный материал» костей, зубов, ногтей.
В желудке соляная кислота активирует фермент пепсиноген, разлагающий чужие белки, попавшие с пищей, на составные части.
Соляная кислота - сильный бактерицид. Большинство бактерий, попавших в желудок с пищей, погибают под ее действием.
Слайд 5Если воспалительные процессы в желудке больного человека текут на фоне
повышенной кислотности, раковых поражений, как правило, не бывает.
Гиалуровая кислота
основной компонент смазки всех трущихся частей в наших суставах.
Интересно, что у птиц, питающихся падалью, кислотность желудочного сока огромна. И это помогает им расправляться с теми миллиардами микробов, которые буквально кишат в падали.
Слайд 7СИЛА КИСЛОРОДОСОДЕРЖАЩИХ КИСЛОТ
По периоду для кислородосодержащих
кислот слева направо возрастает
сила кислот.
H2SiO3→H3PO4→ H2SO4→HClO4
Чем выше степень окисления
кислотообразующего элемента, тем
сильнее
кислота:
+6 +4
H2SO4→H2SO3
По группе кислородосодержащих
кислот сверху вниз сила кислот уменьшается.
H2CO3 →H2SiO3
Слайд 8СИЛА БЕСКИСЛОРОДНЫХ КИСЛОТ
По периоду слева направо сила
бескислородных кислот возрастает.
H2S→HCl
По группе cила бескислородных кислот
с ростом атомного номера
элемента
возрастает:
HF→HCl→HBr→HI
Слайд 92) Какое из утверждений не верно?
А) Основность кислоты определяется числом
атомов водорода в молекуле;
Б) Взаимодействие растворов кислоты и щёлочи называется
реакцией нейтрализации;
В) Существуют неорганические кислоты, не содержащие атома кислорода в молекуле;
Г) Существуют органические кислоты, не содержащие карбоксильной группы.
Слайд 104) Какая из перечисленных кислот способна к ступенчатой диссоциации
А) хлорная
б) бензойная
в) азотистая г) Щавелевая
3) Какое из веществ, формулы которых приведены ниже, не проявляют кислотных свойств?
А) H2SeO4 Б)C6H5OH
В) CH3COH Г) H2Te
Слайд 115) Соотнесите:
6) Как изменяется сила кислот хлора в ряду
HClO4 →HClO3
→HClO → HClO2
Слайд 127) Какая из кислот, формулы которых перечислены, имеет наибольшую константу
диссоциации
А) CH2Br COOH Б) CBr3
COOH
В) CHBr2COOH Г) CH3 COOH
8) Какая из кислот проявляет более выраженные кислотные свойства, расположите кислоты в порядке возрастания кислотных свойств
H2SeO3, H2SO3, HClO4, H2SO4
Слайд 13Действие растворов кислот на индикаторы. Практически все кислоты (кроме кремниевой)
хорошо растворимы в воде.
http://files.school-collection.edu.ru/dlrstore/273e6145-6cc8-fe8a-376e-9765c4e8a054/index.htm
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
2. Взаимодействие кислот с
основаниями.
http://www.youtube.com/watch?v=EL9xOrvPHiw
Слайд 143. Взаимодействие кислот с основными оксидами.
http://files.school-collection.edu.ru/dlrstore/52f55b81-2186-f7fb-e965-75186329579b/index.htm
4. Взаимодействие кислот
с металлами
http://files.school-collection.edu.ru/dlrstore/432f464f-1f22-5224-e016-91243ab1f09c/index.htm
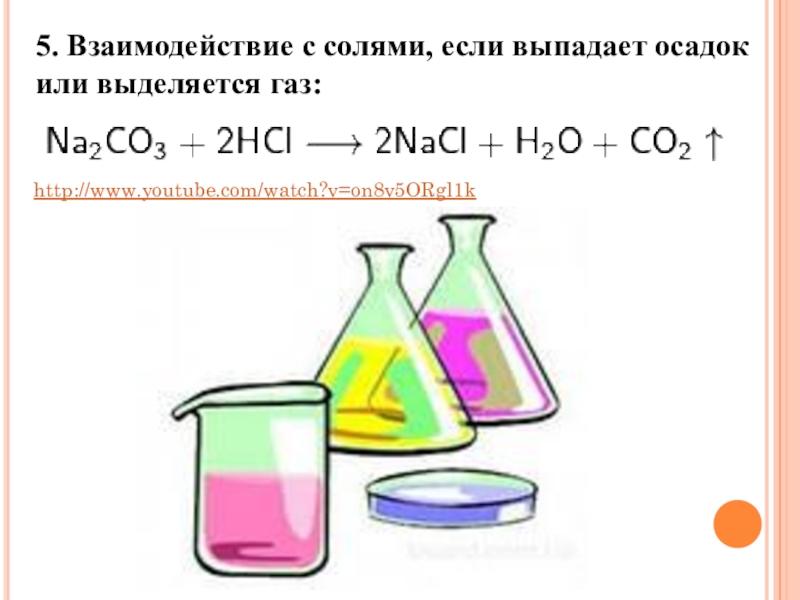
Слайд 155. Взаимодействие с солями, если выпадает осадок или выделяется газ:
http://www.youtube.com/watch?v=on8v5ORgl1k
Слайд 16http://www.youtube.com/watch?v=ic0ZS1zqn9Q
6. Взаимодействие кислот со спиртами
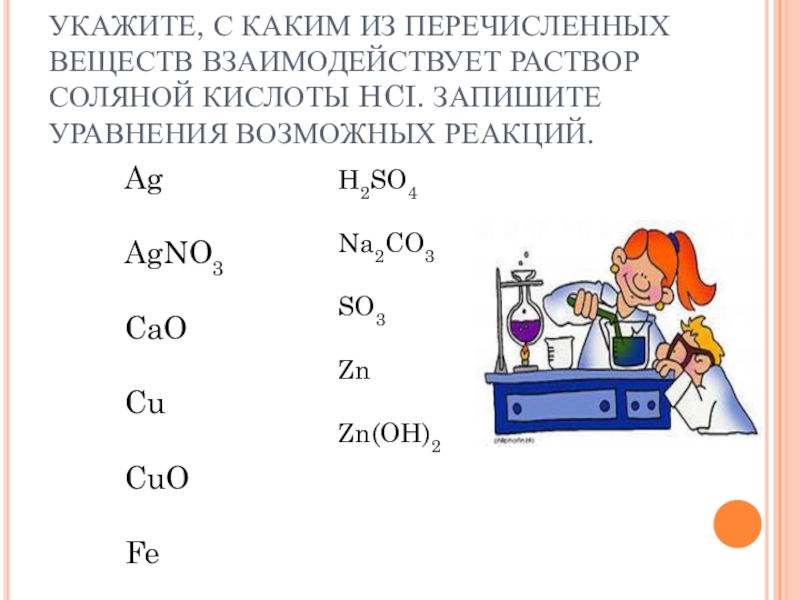
Слайд 17УКАЖИТЕ, С КАКИМ ИЗ ПЕРЕЧИСЛЕННЫХ ВЕЩЕСТВ ВЗАИМОДЕЙСТВУЕТ РАСТВОР СОЛЯНОЙ КИСЛОТЫ
HCI. ЗАПИШИТЕ УРАВНЕНИЯ ВОЗМОЖНЫХ РЕАКЦИЙ.
Ag
AgNO3
CaO
Cu
CuO
Fe
H2SO4
Na2CO3
SO3
Zn
Zn(OH)2
Слайд 18Ag
CI2
CO2
C6H5OH
Fe2O3
CH3OH
KOH
УКАЖИТЕ, С КАКИМИ ИЗ ПЕРЕЧИСЛЕННЫХ ВЕЩЕСТВ РЕАГИРУЕТ РАСТВОР УКСУСНОЙ КИСЛОТЫ
CH3COOH. ЗАПИШИТЕ УРАВНЕНИЯ ВОЗМОЖНЫХ РЕАКЦИЙ.
Слайд 22http://files.school-collection.edu.ru/dlrstore/94bc9644-96dc-f72e-f414-61f8dca00994/index.htm
Слайд 24Допишите схемы уравнений реакций, расставьте коэффициенты
а) Zn + HCl→
б)
HBr + Al →
в) H2SO4(р-р) + Fe→
г) Cu + HCl
→
д) Hg + H2SO4(конц.)→
е) H2SO4(конц.) + Ba →
ж) HNO3(разб.) + Ag →
з) HCl + Au →
и) CaO + H2SO4 →
й) Сu + H2O →
к) H2SO4(р-р) + Cu→
л) H2SO4(конц.) + Cu →
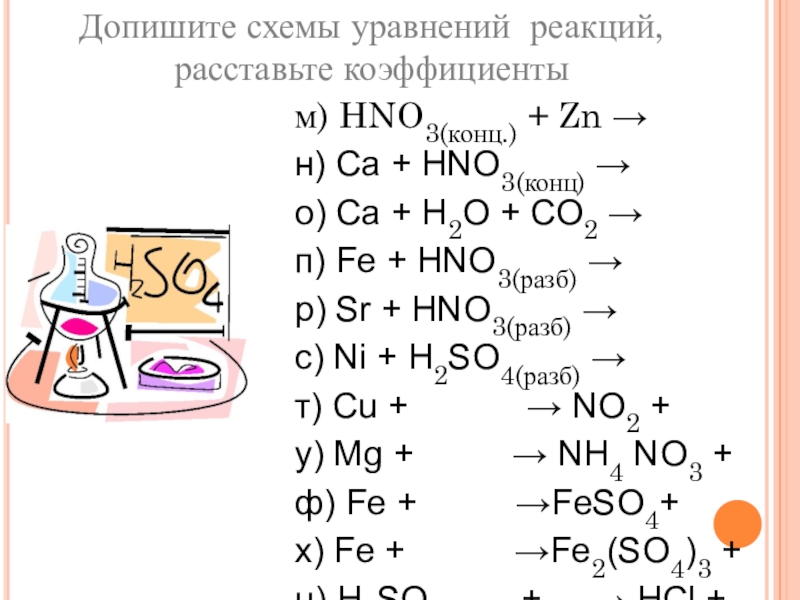
Слайд 25Допишите схемы уравнений реакций, расставьте коэффициенты
м) HNO3(конц.) + Zn
→
н) Ca + HNO3(конц) →
о) Ca + H2O + CO2
→
п) Fe + HNO3(разб) →
р) Sr + HNO3(разб) →
с) Ni + H2SO4(разб) →
т) Cu + → NO2 +
у) Mg + → NH4 NO3 +
ф) Fe + →FeSO4+
х) Fe + →Fe2(SO4)3 +
ц) H2SO4(конц.)+ → HCl +
ч) Ag + → Ag2SO4 +
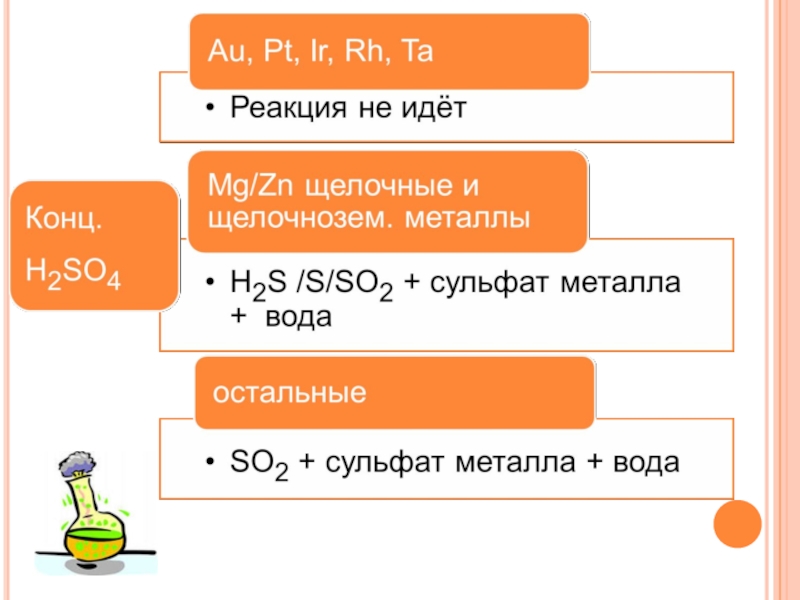
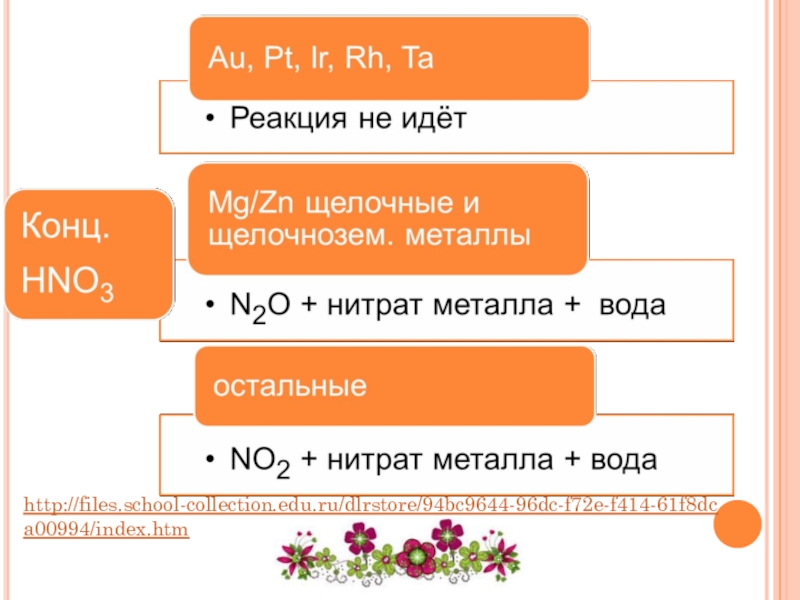
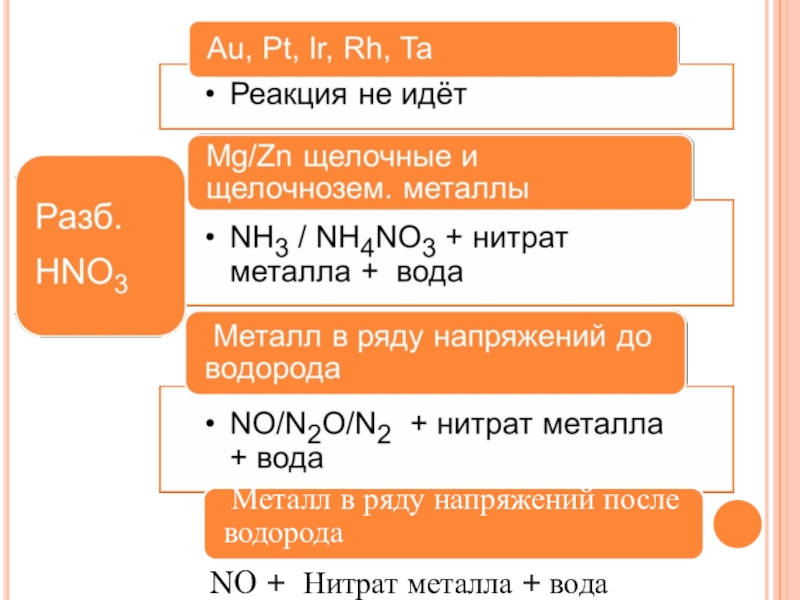
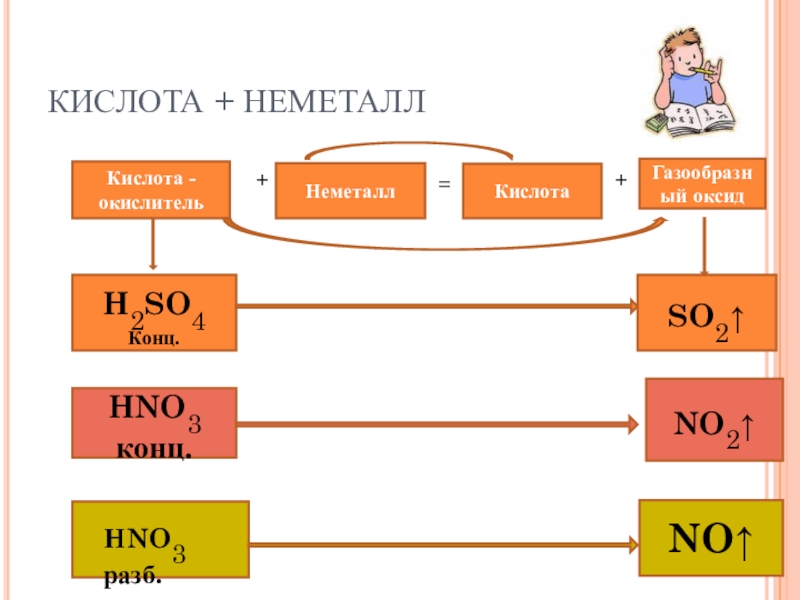
Слайд 26КИСЛОТА + НЕМЕТАЛЛ
Кислота - окислитель
+
Неметалл
=
Кислота
+
Газообразный оксид
H2SO4
Конц.
SO2↑
HNO3 конц.
NO2↑
HNO3 разб.
NO↑
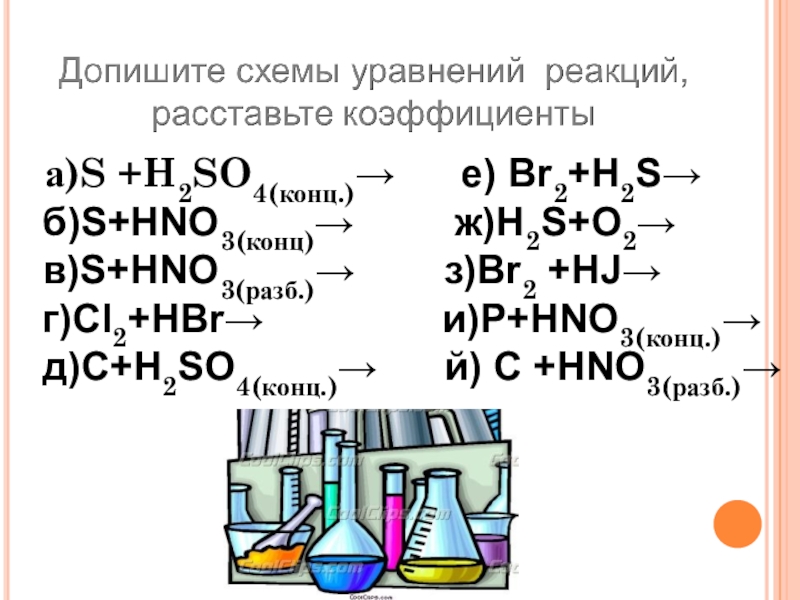
Слайд 27 а)S +H2SO4(конц.)→ е) Br2+H2S→
б)S+HNO3(конц)→ ж)H2S+O2→
в)S+HNO3(разб.)→
з)Br2 +HJ→
г)Cl2+HBr→ и)P+HNO3(конц.)→
д)C+H2SO4(конц.)→ й) C +HNO3(разб.)→
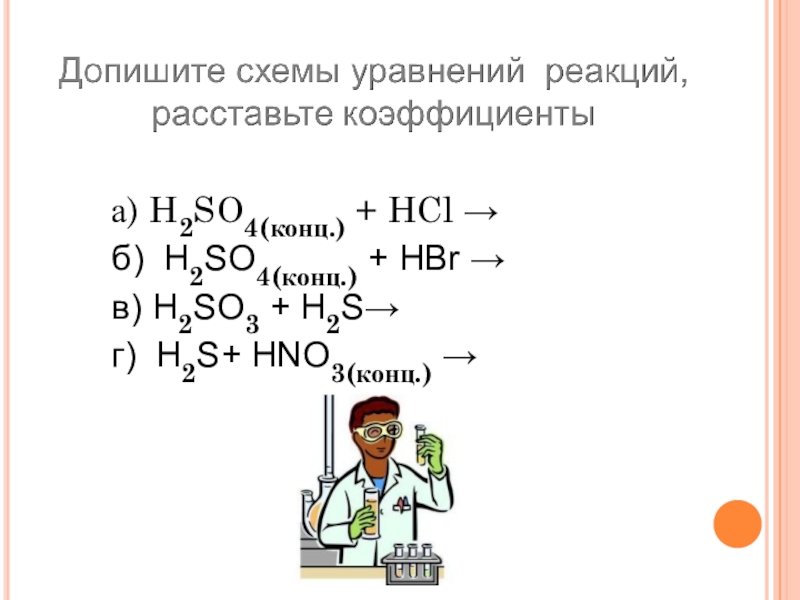
Слайд 29а) H2SO4(конц.) + HCl →
б) H2SO4(конц.) + HBr →
в) H2SO3
+ H2S→
г) H2S+ HNO3(конц.) →
Слайд 30ИСПОЛЬЗОВАННЫЕ ИСТОЧНИКИ ИНФОРМАЦИИ
http://images.yandex.ru/#!/yandsearch?source=wiz&p=9&text=картинки химия&noreask=1&pos=277&lr=51&rpt=simage&img_url=http%3A%2F%2Fkaifolog.ru%2Fuploads%2Fposts%2F2012-10%2F1349507696_015_2.jpg
Дерябина Н.Е. Химия. Основные классы неорганических веществ,
ИПО «У Никитских ворот», Москва, 2011
О.С. Габриелян, И.Г. Остроумов и
др. Общая химия в тестах, задачах, упражнениях, Дрофа, Москва, 2003
4)http://yandex.ru/images/search?img_url=http%3A%2F%2Fdir.coolclips.com%2FScience%2FChemistry%2FBeakers_Flasks_and_Test_Tubes%2Fchemical_industry_CoolClips_vc010033.jpg&uinfo=sw-1366-sh-768-ww-1349-wh-620-pd-1-wp-16x9_1366x768&text=%D1%80%D0%B8%D1%81%D1%83%D0%BD%D0%BE%D0%BA%20%D1%85%D0%B8%D0%BC%D0%B8%D1%8F&noreask=1&pos=16&lr=51&rpt=simage&pin=1