Слайд 1ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
1.ОВР.Классификация ОВР.
2.Метод электронного баланса.
3.Метод полуреакций.
Слайд 2Цели и задачи:
Закрепить умения учащихся применять понятие «степень окисления» на
практике.
Обобщать и дополнять знания учащихся об опорных понятиях теории
ОВР.
Совершенствовать умение учащихся применять эти понятия к объяснению фактов.
Слайд 3Цели и задачи:
Познакомить учащихся с сущностью метода полуреакций.
Сформировать умение выражать
сущность окислительно-восстановительных реакций, протекающих в растворах, ионно-электронным методом.
Слайд 4Окислитель и восстановитель
Окислителем называют реагент, который принимает электроны в ходе
окислительно-восстановительной реакции.
Восстановителем называют реагент, который отдает электроны в ходе окислительно-восстановительной
реакции.
Слайд 5ПРОЦЕСС ОКИСЛЕНИЯ И ВОССТАНОВЛЕНИЯ
Окислением называют процесс отдачи электронов атомом, молекулой
или ионом, который сопровождается повышением степени окисления.
Восстановлением называют процесс присоединения
электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
Слайд 9Правила определения функции соединения в окислительно-восстановительных реакциях.
1. Если элемент проявляет
в соединении высшую степень окисления, то это соединение может быть
окислителем.
2. Если элемент проявляет в соединении низшую степени окисления, то это соединение может быть восстановителем.
3. Если элемент проявляет в соединении промежуточную степень окисления, то это соединение может быть как воcстановителем, так и окислителем.
Задание:
Предскажите функции веществ в окислительно-восстановительных реакциях:
Слайд 16Важнейшие окислители и восстановители
Слайд 17Опорные понятия теории ОВР
Вопросы:
1. Что называется процессом восстановления?
2. Как изменяется
степень окисления элемента при восстановлении?
3. Что называется процессом окисления?
4. Как
изменяется степень окисления элемента при окислении?
5. Определите понятие «восстановитель».
6. Определите понятие «окислитель».
7. Как предсказать функцию вещества по степени окисления элемента?
8. Назовите важнейшие восстановители и окислители.
9.Какие реакции называются окислительно-восстановительными?
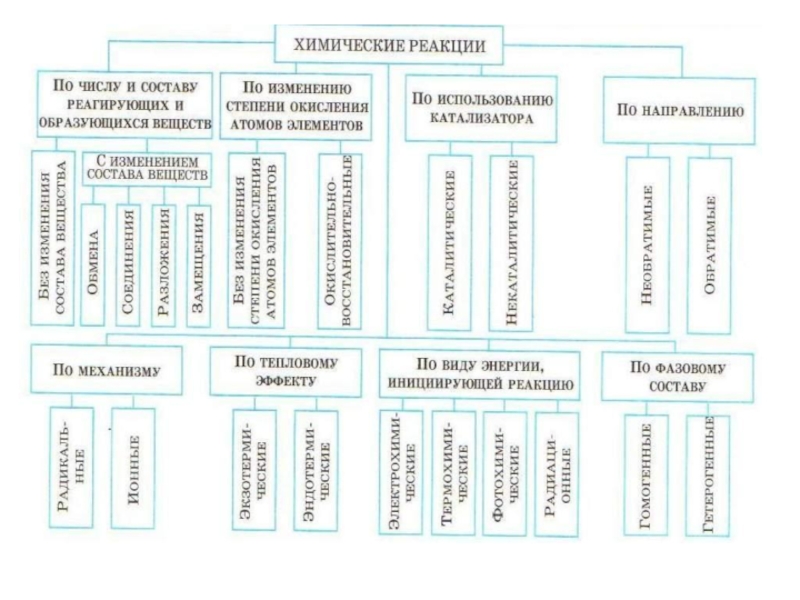
Слайд 19Химические реакции
По изменению степени окисления атомов элементов
Окислительно-восстановительные
Без изменения степени окисления
атомов элементов
К ним относятся все реакции ионного обмена, а также
многие реакции соединения
Слайд 20ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительными
называют реакции, которые сопровождаются изменением степеней
окисления химических элементов, входящих в состав реагентов.
Слайд 21Классификация ОВР
ОВР
реакции межмолекулярного окисления-восстановления
реакции внутримолекулярного окисления-восстановления,
реакции диспропорционирования, дисмутации или самоокисления-самовосстановления
Слайд 22Межмолекулярные реакции:
Частицы- доноры электронов (восстановители) – и частицы-
акцепторы электронов (окислители) – находятся в разных веществах.
К этому типу
относится большинство ОВР.
Слайд 23Внутримолекулярные реакции
Донор электронов - восстановитель- и акцептор электронов – окислитель
– находятся в одном и том же веществе.
Слайд 24Реакции дисмутации, или диспропорционирования, или самоокисления-самовосстановления
Атомы одного и того же
элемента в веществе выполняют одновременно функции и доноров электронов (восстановителей)
и акцепторов электронов (окислителей).
Эти реакции возможны для веществ, содержащих атомы химических элементов в промежуточной степени окисления.
Слайд 25Составление окислительно-восстановительных реакций
Для составления окислительно-восстановительных реакций используют:
1) метод электронного баланса
2)
Составление уравнений окислительно-восстановительных реакций методом полуреакций, или ионно-электронным методом
Слайд 26Составление окислительно-восстановительных реакций методом электронного баланса
Метод основан на сравнении степеней
окисления атомов в исходных веществах и продуктах реакции и на
балансировании числа электронов, смещаемых от восстановителя к окислителю.
Метод применяют для составления уравнений реакций, протекающих в любых фазах. В этом универсальность и удобство метода.
Недостаток метода — при выражении сущности реакций, протекающих в растворах, не отражается существование реальных частиц.
Слайд 27Алгоритмическое предписание для составления уравнений окислительно-восстановительных реакций
методом электронного баланса
1.Составить схему реакции.
2. Определить степени окисления элементов в
реагентах и продуктах реакции.
3. Определить, является реакция окислительно-восстановительной или она протекает без изменения степеней окисления элементов. В первом случае выполнить все последующие операции.
4. Подчеркнуть элементы, степени, окисления которых изменяются.
Слайд 28Алгоритмическое предписание для составления уравнений окислительно-восстановительных реакций
методом электронного баланса
5. Определить, какой элемент окисляется (его степень окисления
повышается) и какой элемент восстанавливается (его степень окисления понижается) в процессе реакции.
6. В левой части схемы обозначить с помощью стрелок процесс окисления (смещения электронов от атома элемента) и процесс восстановления (смещения электронов к атому элемента)
7. Определить восстановитель (атом элемента, от которого смещаются электроны) и окислитель (атом элемента, к которому смещаются электроны).
Слайд 29Алгоритмическое предписание для составления уравнений окислительно-восстановительных реакций
методом электронного баланса
8. Сбалансировать число электронов между окислителем и восстановителем.
9.
Определить коэффициенты для окислителя и восстановителя, продуктов окисления и восстановления.
10. Записать коэффициент перед формулой вещества, определяющего среду раствора.
11. Проверить уравнение реакции.
Слайд 30
Составление уравнений окислительно-восстановительных реакций методом полуреакций, или ионно-электронным методом
Метод основан
на составлении ионно-электронных уравнений для процессов окисления и восстановления с
учетом реально существующих частиц и последующим суммированием их в общее уравнение.
Метод применяется для выражения сущности окислительно-восстановительных реакций, протекающих только в растворах.
Достоинства метода.
1. В электронно-ионных уравнениях полуреакций записываются ионы, реально существующие в водном растворе, а не условные частицы. (Например, ионы а не атом азота со степенью окисления +3 и атом серы со степенью окисления +4.)
2. Понятие «степень окисления» не используется.
3. При использовании этого метода не нужно знать все вещества: они определяются при выводе уравнения реакции.
4. Видна роль среды как активного участника всего процесса.
Слайд 31Основные этапы составления уравнений окислительно-восстановительных реакций ионно-электронным методом
(на примере взаимодействия
цинка с концентрированной азотной кислотой)
1. Записываем ионную схему процесса, которая
включает только восстановитель и продукт его окисления, и окислитель и продукт его восстановления:
Слайд 34Источник
ЕГЭ. ХИМИЯ: Универсальный справочник/ О.В.Мешкова .- М.: ЭКСМО, 2010.- 368с.