теории
Координационная теория А.Вернера
Основы номенклатуры комплексных соединений
Строение комплексных соединений
Растворы комплексных соединений
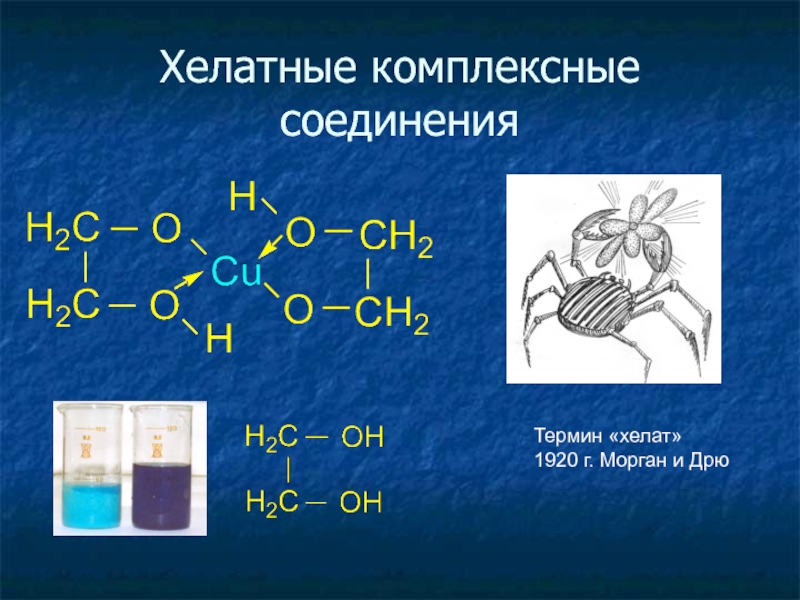
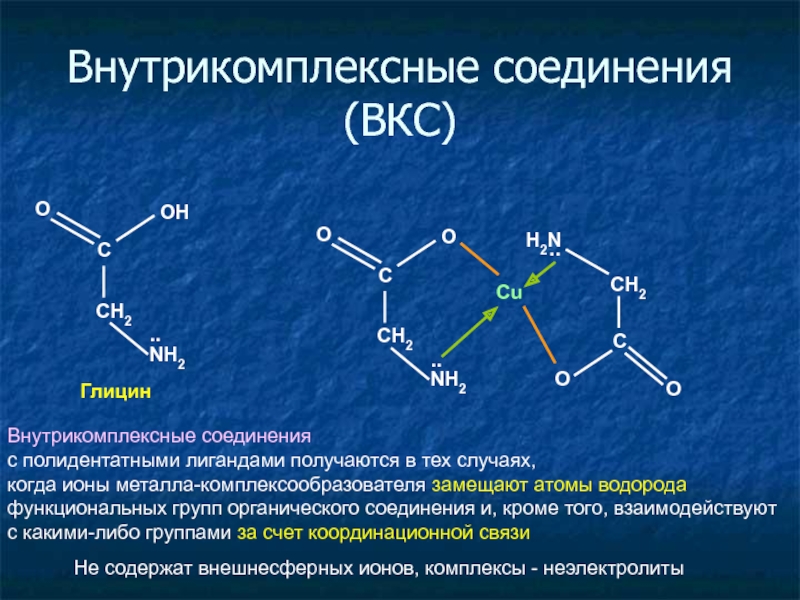
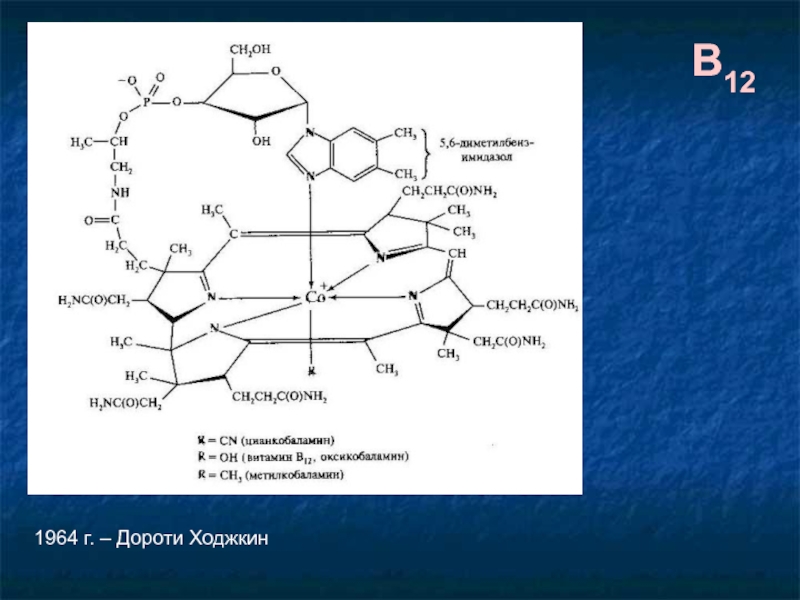
Хелатные
комплексыАльфред Вернер
Na3[Co(NO2)6]
K3[Fe(CN)6]
[Cu(NH3)4]2+






![Комплексные соединения Строение комплексного соединенияK3 [Fe(CN)6]Ион-Комплексо-образовательЛигандыКоординационное числоВнутренняя сфераВнешняя сфера[Cu(NH3)4]Cl2Внутренняя сфераВнешняя сфера Строение комплексного соединенияK3 [Fe(CN)6]Ион-Комплексо-образовательЛигандыКоординационное числоВнутренняя сфераВнешняя сфера[Cu(NH3)4]Cl2Внутренняя сфераВнешняя сфера](/img/thumbs/d20905c2088a9acc55231947f6537dbf-800x.jpg)
![Комплексные соединения Номенклатура комплексных соединенийK3 [Fe(CN)6]Гексацианоферрат(III) калия[Cu(NH3)4]Cl2Хлорид тетраамминмеди(II)+3+2Порядок перечисления лиганд:Анионные: H-, O2-, OH-, Номенклатура комплексных соединенийK3 [Fe(CN)6]Гексацианоферрат(III) калия[Cu(NH3)4]Cl2Хлорид тетраамминмеди(II)+3+2Порядок перечисления лиганд:Анионные: H-, O2-, OH-, простые анионы, многоатомные анионы, органические в](/img/thumbs/59cd33c7e2a4c9da65c17f9659e632f9-800x.jpg)
2Соль Чугаева [Pt(NH3)5Cl]Cl3Соль Цейзе K[PtCl3C2H4]Пурпуреосоль [Co(NH3)5Cl]Cl2 Кроцеосоль [Co(NH3)4(NO2)2]Cl Упражнение 1Первое основание Рейзе [Pt(NH3)4](OH)2Соль Чугаева [Pt(NH3)5Cl]Cl3Соль Цейзе K[PtCl3C2H4]Пурпуреосоль [Co(NH3)5Cl]Cl2 Кроцеосоль [Co(NH3)4(NO2)2]Cl](/img/thumbs/0225843c9dda27278e7e78030b208aa5-800x.jpg)
![Комплексные соединения Упражнение 2Гексанитрокобальтат(III) натрия Na3[Co(NO2)6]Гидроксид диаммминсеребра(I) [Ag(NH3)2]OH реактив ТолленсаТетраиодомеркурат(II) калия K2[HgI4] реактив НесслераТетрароданомеркурат(II) аммония (NH4)2[Hg(SCN)4] Упражнение 2Гексанитрокобальтат(III) натрия Na3[Co(NO2)6]Гидроксид диаммминсеребра(I) [Ag(NH3)2]OH реактив ТолленсаТетраиодомеркурат(II) калия K2[HgI4] реактив НесслераТетрароданомеркурат(II) аммония (NH4)2[Hg(SCN)4]](/img/tmb/4/381226/c26210458afe81edf9e49cc7224fe79f-800x.jpg)

![Комплексные соединения Ряды Вернера - Миолати1 [Pt(NH3)6]Cl42 [Pt(NH3)5Cl]Cl33 [Pt(NH3)4Cl2]Cl24 [Pt(NH3)3Cl3]Cl5 [Pt(NH3)2Cl4]6 K[Pt(NH3)Cl5]7 K2[PtCl6]Диаграмма молярной электропроводности соединений μ, Ом-1.см2.моль-1В 1893 г. Ряды Вернера - Миолати1 [Pt(NH3)6]Cl42 [Pt(NH3)5Cl]Cl33 [Pt(NH3)4Cl2]Cl24 [Pt(NH3)3Cl3]Cl5 [Pt(NH3)2Cl4]6 K[Pt(NH3)Cl5]7 K2[PtCl6]Диаграмма молярной электропроводности соединений μ, Ом-1.см2.моль-1В 1893 г. А.Вернер совместно с А. Миолати, используя](/img/thumbs/0d34c9855896aa0f6e794da33c74fe90-800x.jpg)
![Комплексные соединения Изомерия комплексовPtCl2.2NH3PtPtClClClClNH3NH3NH3NH3Соль ПейронеХлорид второго основания РейзеПротивоопухолевая активность!1844 г. М. Пейроне[Pt(NH3)2Cl2]Цис-изомерТранс-изомерОранжево-желтыйСветло-желтый Изомерия комплексовPtCl2.2NH3PtPtClClClClNH3NH3NH3NH3Соль ПейронеХлорид второго основания РейзеПротивоопухолевая активность!1844 г. М. Пейроне[Pt(NH3)2Cl2]Цис-изомерТранс-изомерОранжево-желтыйСветло-желтый](/img/thumbs/d19bafffa193ff8940f084fe0523c35e-800x.jpg)
![Комплексные соединения Механизм образования комплексного иона[Al(OH)4]- Механизм образования комплексного иона[Al(OH)4]-](/img/thumbs/eaa958b761e33066d66251fa62368130-800x.jpg)
![Комплексные соединения Комплексные соединения в растворахПервичная диссоциация комплексных соединенийK3[Fe(CN)6] = 3K+ + [Fe(CN)6]3-[Cu(NH3)4]SO4 Комплексные соединения в растворахПервичная диссоциация комплексных соединенийK3[Fe(CN)6] = 3K+ + [Fe(CN)6]3-[Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42-[Ag(NH3)2]Cl = [Ag(NH3)2]+](/img/thumbs/17531af92d11721ccfc3206917ae9d89-800x.jpg)
![Комплексные соединения Вторичная диссоциация комплексов[Ag(NH3)2]+ [Ag(NH3)]+ + NH3[Ag(NH3)]+ Ag+ + NH3 Вторичная диссоциация комплексов[Ag(NH3)2]+ [Ag(NH3)]+ + NH3[Ag(NH3)]+ Ag+ + NH3](/img/thumbs/eefea147bd9af841aec759f0aec8065b-800x.jpg)