Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химия. 11 класс. Урок по теме: "Обратимые химические реакции".
Содержание
- 1. Химия. 11 класс. Урок по теме: "Обратимые химические реакции".
- 2. Цель Углубить и обобщить знания об обратимых
- 3. Химические реакции (по направлению протекания)ОбратимыехимическиереакцииНеобратимыехимическиереакции
- 4. Необратимые химические реакции - это химические
- 5. Условия протекания химических реакций до конца:Выделяется газ
- 6. Обратимые химические реакциихимические реакции, которые протекают
- 7. Какие из химических реакций являются обратимымиNaOH +
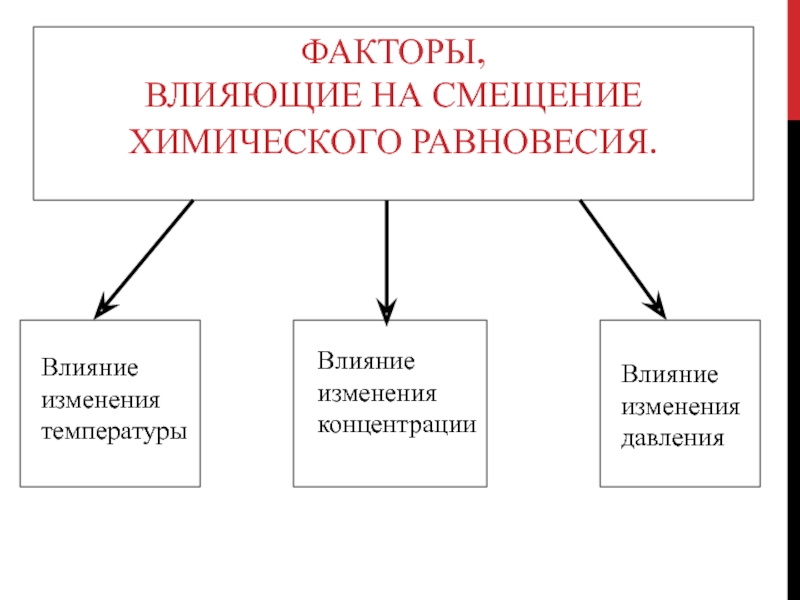
- 8. Факторы, влияющие на смещение химического равновесия.
- 9. Влияние изменения температурыПри повышении температуры равновесие смещается
- 10. Влияние изменения давленияПри увеличении давления равновесие смещается
- 11. Влияние изменения концентрации веществПри увеличении концентрации реагирующих
- 12. Слайд 12
- 13. Скачать презентанцию
Цель Углубить и обобщить знания об обратимых химических реакциях, о состоянии химического равновесия, условиях его смещения.
Слайды и текст этой презентации
Слайд 1Тема урока
«Обратимые
химические
Реакции».
Автор: учитель химии МБОУ СОШ №4
Хмелева Наталья Юрьевна
Слайд 2Цель
Углубить и обобщить знания об обратимых химических реакциях,
о
состоянии химического равновесия,
условиях его смещения.
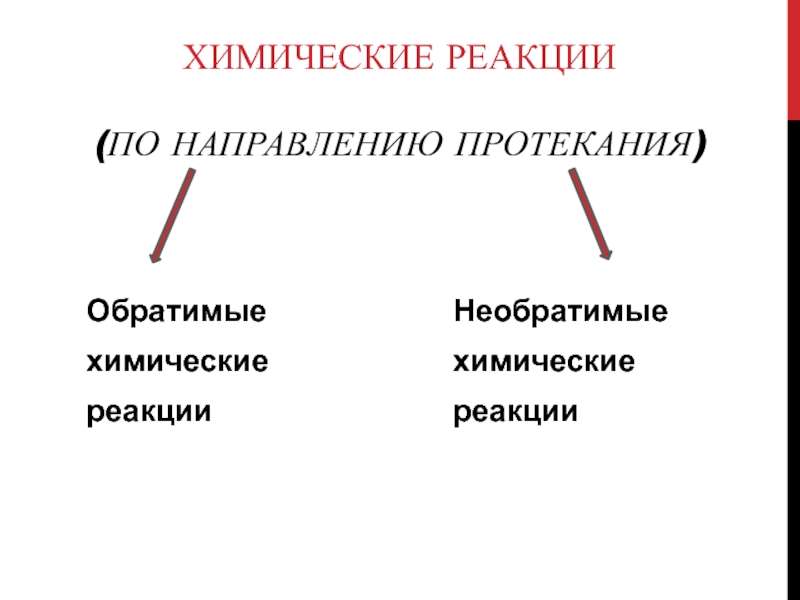
Слайд 3Химические реакции
(по направлению протекания)
Обратимые
химические
реакции
Необратимые
химические
реакции
Слайд 4Необратимые
химические реакции
- это химические реакции, в результате которых
исходные вещества практически полностью превращаются в конечные продукты.
Слайд 5Условия протекания химических реакций до конца:
Выделяется газ
Na2CO3 + 2HCI
= 2NaCI + CO2 + H2O
Выпадает осадок
AqNO3 +NaCI =
AqCI + NaNO3Образуется малодиссоциирующее вещество (например, вода)
HCI + NaOH = NaCI + H2O
Слайд 6Обратимые
химические реакции
химические реакции, которые протекают одновременно в двух противоположных
направления - прямом и обратном .
Большинство реакций
являются обратимыми.Слайд 7Какие из химических реакций являются обратимыми
NaOH + HCl NaCl
+ H2O
2. N2 + 3H2 2NH3
3. AgNO3 + NaCl
AgCl + NaNO34. SO3 + H2O H2SO4
5. 2SO2 + O2 2SO3
6. HCOOH + CH3OH HCOOCH3 + H2O
Слайд 9Влияние изменения температуры
При повышении температуры равновесие смещается в сторону эндотермичной
реакции (- Q)
При понижении температуры равновесие смещается в сторону экзотермичной
реакции( +Q)2SO2 + O2 2SO3 + Q
При увеличении температуры равновесие смещается
в сторону исходных веществ
Слайд 10Влияние изменения давления
При увеличении давления равновесие смещается в сторону меньшего
объема.
При уменьшении давления равновесие смещается в сторону большего объема.
2SO2 +
O2 2SO3 + QПри увеличении давления равновесие
смещается в сторону продуктов реакции
Слайд 11Влияние изменения концентрации веществ
При увеличении концентрации реагирующих веществ или уменьшение
концентрации продукта реакции химическое равновесие смещается в сторону продуктов реакции.
При увеличении концентрации продуктов реакции или уменьшение концентрации реагирующих веществ химическое равновесие смещается в сторону исходных веществ.
2SO2 + O2 2SO3 + Q
При увеличении концентрации кислорода равновесие
смещается в сторону продуктов реакции;
при увеличении концентрации оксида серы (VI) равновесие
смещается в сторону исходных веществ
2SO2 + O2 2SO3 + Q