Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Тест для подготовки к ЕГЭ по химии А23 Реакции ионного обмена 10 класс
Содержание
- 1. Тест для подготовки к ЕГЭ по химии А23 Реакции ионного обмена 10 класс
- 2. Цели:Ознакомиться с вопросами задания А23 «Реакции ионного
- 3. Инструкции и рекомендации:В презентации представлены 20 заданий
- 4. ВерноНеверно1) сульфата калия и азотной кислотыНеверно2) хлороводородной
- 5. ВерноНеверно1) КОН(р-р) и Н3РО4(р-р)4) Са(ОН)2 (р-р) и СО2Неверно2)
- 6. ВерноНеверно1) К+, Н+, NO3-, SO42- Неверно2) Ва2+, Ag+, ОН-, F-Неверно4) Mg2+, Н3O+, Вr-, Сl-
- 7. ВерноНеверно1) ZnCl2 + 2NaOH = Zn(OH)2 + 2NaClНеверно2) H2SO4 +
- 8. НеверноВерноНеверно2) хлороводородной кислоты и гидроксида бария1) сульфата
- 9. НеверноНеверно ВерноНеверно1) Fe3+, К+, Сl-, S042-3) Са2+, Li+, NO3-, Сl-2)
- 10. НеверноВерно2) К2СОз и Ва(ОН)21) А1С13 и NaOHНеверно3) Н3РО4 и КОННеверно4)
- 11. ВерноНеверно1) гидроксида калия и хлорида алюминияНеверно2)
- 12. ВерноНеверно3) FeCl3 и Ва(ОН)21) Н3РO4 и КОННеверно2) Na2SO3 и H2SO4Неверно4) Cu(NO3)2 и MgSO4 ТМТМТР9. Осадок выпадет при взаимодействии растворов
- 13. ВерноНеверно1) Fe(NO3)3 и КОННеверно2) FeSO4 и LiOHНеверно4) Ва(ОН)2 и FeCl3 ТМТМТР3)
- 14. НеверноВерноНеверно2) FeCl31) А1С133) CuSO4 Неверно4) KNO3 ТМТМТР11.
- 15. НеверноВерноНеверно1) Сu(ОН)2 и H2S4) CuCl2 и H2SНеверно2) CuCl2 и Na2S3) Cu3(P04)2 и Na2S ТМТМТР12. Краткое ионное уравнение Cu2++ S2-= CuS соответствует реакции между:
- 16. НеверноНеверноВерноНеверно1) сернистый газ, вода и сульфат натрия4)
- 17. ВерноНеверно1) ВаС122) FeCl3 Неверно3) CuSO4 Неверно4) KNO3 ТМТМТР14.
- 18. НеверноВерноНеверно1) HI и КОН3) H2SiO3 и КОН2) H2S и NaOHНеверно4) НС1
- 19. НеверноВерноНеверно1) гидроксидом натрия и хлоридом калия3) нитратом
- 20. НеверноВерноНеверно1) вода и фосфат натрия3) сероводород и
- 21. ВерноНеверно1) ВаСl23) CuSO4 Неверно2) FeSO4Неверно4) AgNO3 ТМТМТР18. При
- 22. НеверноВерноНеверно1) Н+ + ОН- = Н2O3) Cu2+ + 2НС1 = CuCl2 +
- 23. НеверноВерноНеверно1) K2SO4 и HC13) Na2SO4 и КОННеверно2) NaCl и CuSO44) BaCl2 и CuSO4 ТМТМТР20. Практически необратимо протекает реакция между:
- 24. Слайд 24
- 25. Слайд 25
- 26. Источники:http://www.maratakm.ru/index2.files/a23.htm
- 27. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Работу выполнил ученик 10 А класса
Сиваков Николай
Тест для подготовки к
ЕГЭ по химии
А23 «Реакции ионного обмена»
Слайд 2Цели:
Ознакомиться с вопросами задания А23 «Реакции ионного обмена»
Проверить свои знания
по реакциям ионного обмена.
Расширить опыт выполнения тестовых заданий по химии.
Слайд 3Инструкции и рекомендации:
В презентации представлены 20 заданий вопроса А23 по
теме «Реакции ионного обмена»
При выполнении заданий А23, из четырех
предложенных вариантов ответов выбрать один верный. Для этого курсором кликнуть по выбранному ответу. Если выбран правильный ответ - появится слово "ВЕРНО", при неправильном ответе - «Неверно». ТМТМ
ТР
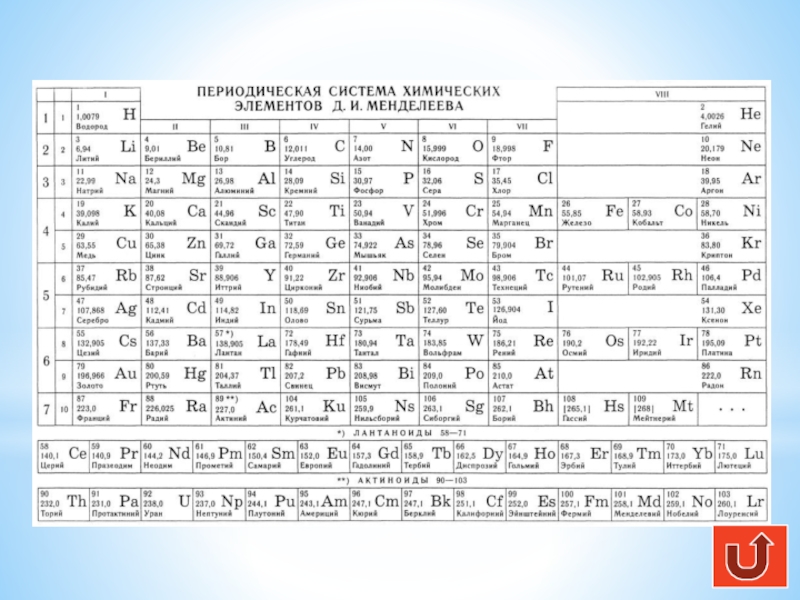
Ссылка на таблицу Менделеева
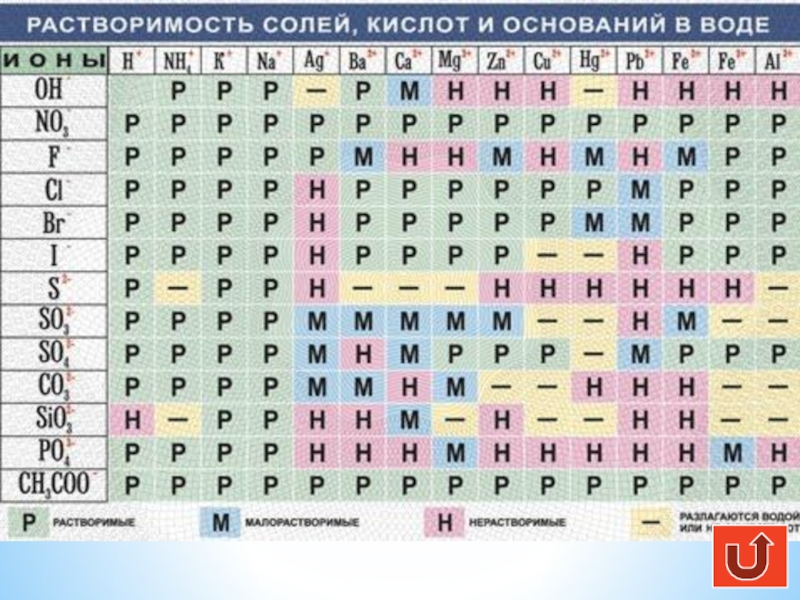
Ссылка на таблицу растворимости
Слайд 4Верно
Неверно
1) сульфата калия и азотной кислоты
Неверно
2) хлороводородной кислоты и гидроксида
калия
Неверно
4) карбоната натрия и гидроксида бария
ТМТМ
ТР
1. Газ выделяется
при взаимодействии растворов.3) серной кислоты и сульфита калия
Слайд 5Верно
Неверно
1) КОН(р-р) и Н3РО4(р-р)
4) Са(ОН)2 (р-р) и СО2
Неверно
2) HNО3(р-р) и СuО
Неверно
3)
НСl(р-р) и Mg(NO3)2(р-р)
ТМТМ
ТР
2. Нерастворимая соль образуется при взаимодействии.
Слайд 6Верно
Неверно
1) К+, Н+, NO3-, SO42-
Неверно
2) Ва2+, Ag+, ОН-, F-
Неверно
4) Mg2+, Н3O+, Вr-, Сl-
ТМТМ
ТР
3. Одновременно не
могут находиться в растворе группы:
3) Н3O+, Са2+ Сl-, NO3-
Слайд 7Верно
Неверно
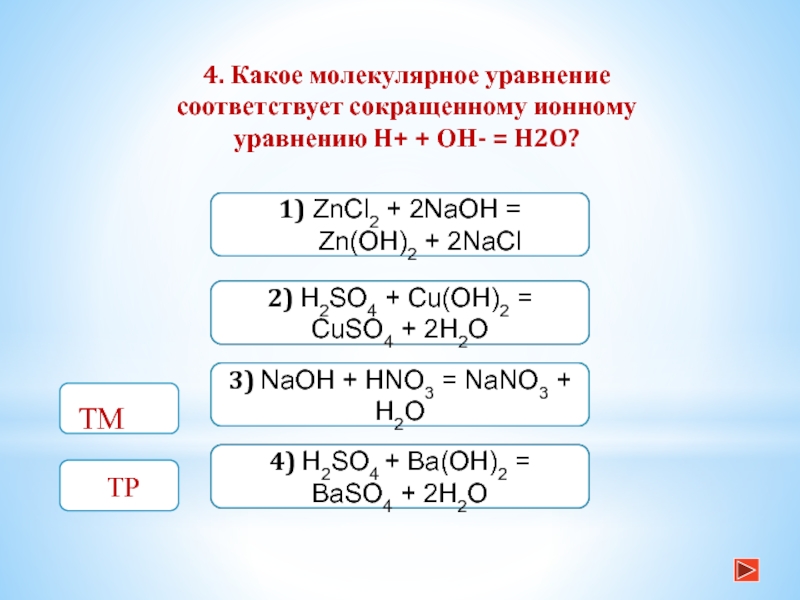
1) ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
Неверно
2) H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
Неверно
3)
NaOH + HNO3 = NaNO3 + H2O
4. Какое молекулярное уравнение соответствует сокращенному
ионному уравнению H+ + ОН- = H2O? ТМТМ
ТР
4) H2SO4 + Ba(OH)2 = BaSO4 + 2H2O
Слайд 8Неверно
Верно
Неверно
2) хлороводородной кислоты и гидроксида бария
1) сульфата калия и азотной
кислоты
3) азотной кислоты и сульфида натрия
Неверно
4) карбоната натрия и гидроксида
бария ТМТМ
ТР
5. Газ выделяется при взаимодействии растворов
Слайд 9Неверно
Неверно
Верно
Неверно
1) Fe3+, К+, Сl-, S042-
3) Са2+, Li+, NO3-, Сl-
2) Fe3+, Na+, NO3-, SO42-
4)
Ba2+, Cu2+, OH-, F-
ТМТМ
ТР
6. Одновременно не могут находиться
в растворе все ионы рядаСлайд 10Неверно
Верно
2) К2СОз и Ва(ОН)2
1) А1С13 и NaOH
Неверно
3) Н3РО4 и КОН
Неверно
4) MgBr2 и Na3PO4
ТМТМ
ТР
7.
Соль и щелочь образуются при взаимодействии растворов
Слайд 11
Верно
Неверно
1) гидроксида калия и хлорида алюминия
Неверно
2) сульфата меди(II) и сульфида
калия
Неверно
4) карбоната натрия и хлороводородной кислоты
ТМТМ
ТР
3) серной кислоты
и гидроксида лития8. Нерастворимая соль образуется при сливании водных растворов
Слайд 12Верно
Неверно
3) FeCl3 и Ва(ОН)2
1) Н3РO4 и КОН
Неверно
2) Na2SO3 и H2SO4
Неверно
4) Cu(NO3)2 и MgSO4
ТМТМ
ТР
9. Осадок
выпадет при взаимодействии растворов
Слайд 13Верно
Неверно
1) Fe(NO3)3 и КОН
Неверно
2) FeSO4 и LiOH
Неверно
4) Ва(ОН)2 и FeCl3
ТМТМ
ТР
3) Na2S и Fe(NO)3
10. Сокращенное ионное
уравнение Fe2+ + 2OH- = Fe(OH)2
соответствует взаимодействию веществ:
Слайд 14Неверно
Верно
Неверно
2) FeCl3
1) А1С13
3) CuSO4
Неверно
4) KNO3
ТМТМ
ТР
11. При добавлении раствора
гидроксида натрия к раствору неизвестной соли образовался, а затем исчез
бесцветный студенистый осадок. Формула неизвестной соли:Слайд 15Неверно
Верно
Неверно
1) Сu(ОН)2 и H2S
4) CuCl2 и H2S
Неверно
2) CuCl2 и Na2S
3) Cu3(P04)2 и Na2S
ТМТМ
ТР
12. Краткое ионное уравнение
Cu2++
S2-= CuS соответствует реакции между:
Слайд 16Неверно
Неверно
Верно
Неверно
1) сернистый газ, вода и сульфат натрия
4) нитрат натрия и
карбонат калия
2) карбонат кальция и хлорид натрия
3) вода и нитрат
бария ТМТМ
ТР
13. Продуктами необратимо протекающей реакции ионного не могут быть:
Слайд 17Верно
Неверно
1) ВаС12
2) FeCl3
Неверно
3) CuSO4
Неверно
4) KNO3
ТМТМ
ТР
14. При добавлении раствора
гидроксида натрия к раствору неизвестной соли образовался бурый осадок. Формула
неизвестной соли:Слайд 18Неверно
Верно
Неверно
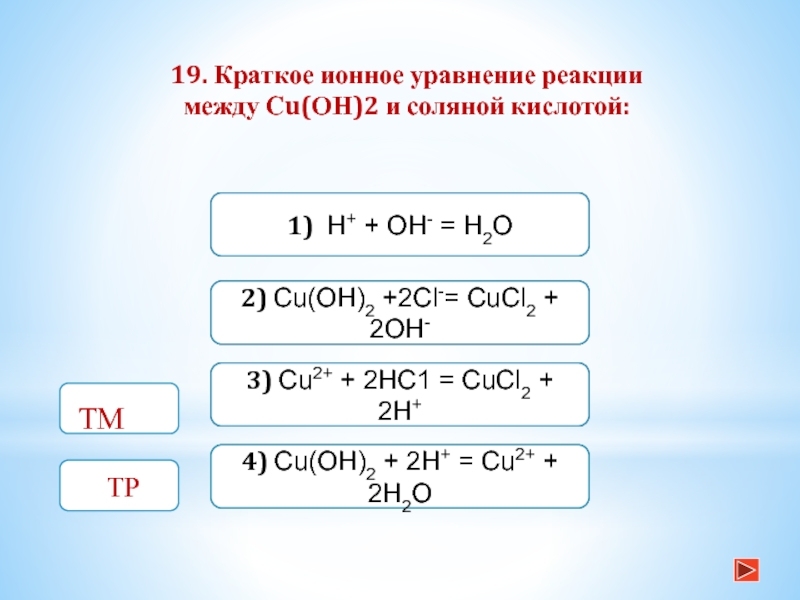
1) HI и КОН
3) H2SiO3 и КОН
2) H2S и NaOH
Неверно
4) НС1 и Сu(ОН)2
ТМТМ
ТР
15. Краткое ионное уравнение
H+ + ОН- = Н2O соответствует реакции
между:Слайд 19Неверно
Верно
Неверно
1) гидроксидом натрия и хлоридом калия
3) нитратом натрия и хлоридом
серебра
2) сульфатом натрия и хлоридом бария
Неверно
4) хлоридом меди(II) и нитратом натрия
ТМТМТР
16. Хлорид натрия может быть получен в реакции ионного обмена в растворе между:
Слайд 20Неверно
Верно
Неверно
1) вода и фосфат натрия
3) сероводород и хлорид железа(II)
2) фосфат
натрия и сульфат калия
Неверно
4) хлорид серебра и нитрат натрия
ТМТМТР
17. Продуктами необратимо протекающей реакции ионного обмена не могут быть: