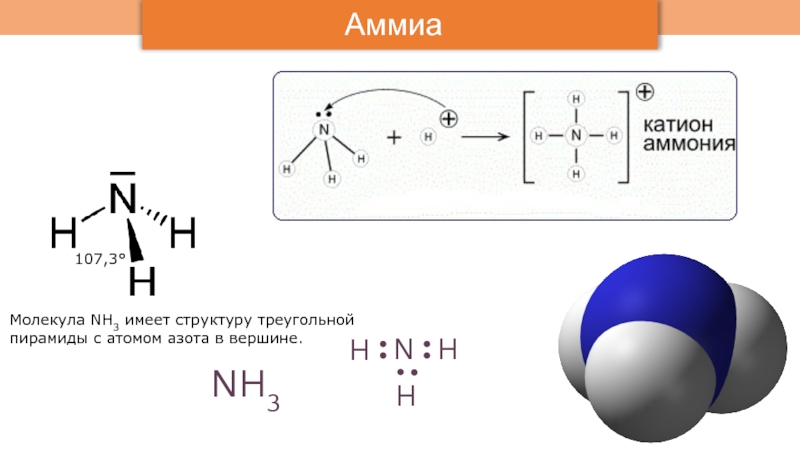
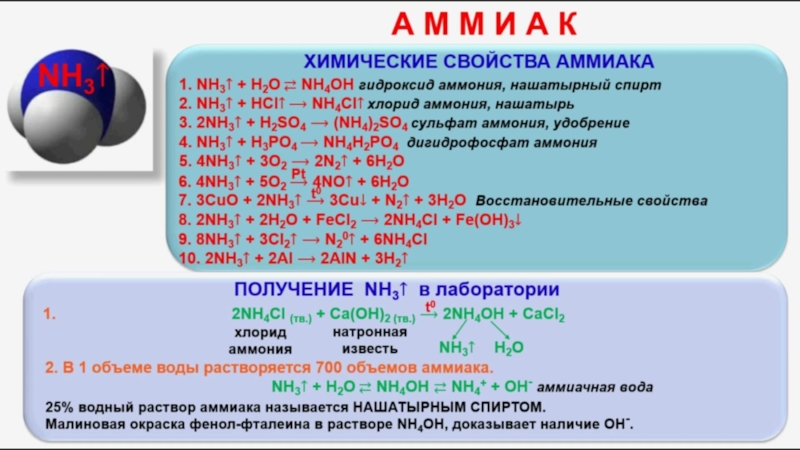
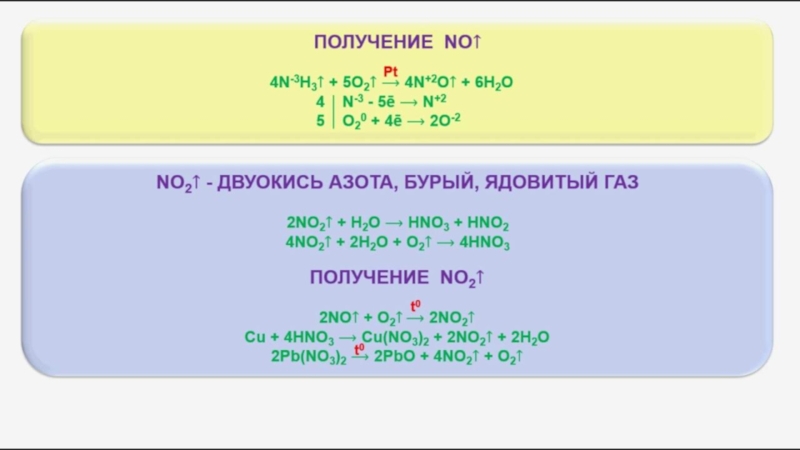
В чистом виде аммиак впервые был собран в конце XVIII
в. англичанином Дж. Пристли. Однако несмотря на то, что ученый смог описать свойства аммиака, ему не удалось определить состав соединения из-за несовершенства существовавших в то время экспериментальных методик. Заслуга в этом принадлежит К. Л. Бертолле. Он разложил аммиак действием электрической искры и получил точные данные о его количественном составе.
Дж. Пристли
13.03.1733 – 6.02.1804 гг.