объем в случае атомов электроотрицательных элементов, чем электроположительных.
Модель отталкивания электронных
пар была принята химиками-неорганиками, хотя теоретическая база этой модели не получила одобрения исследователей, занимающихся квантово-механическими расчетами.
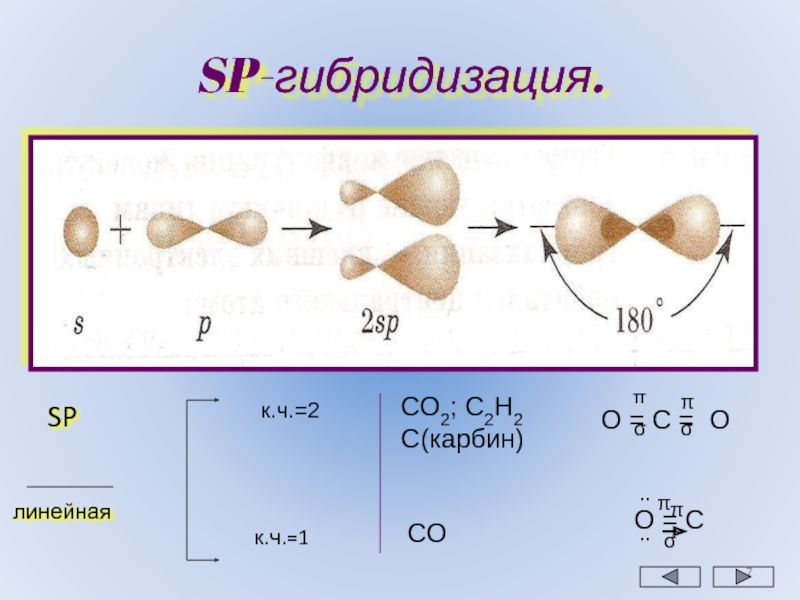
Сформулировано еще одно правило, позволившее включить в рассмотрение и углы, наблюдающиеся в фосфинах, арсинах, сероводороде и т.п.
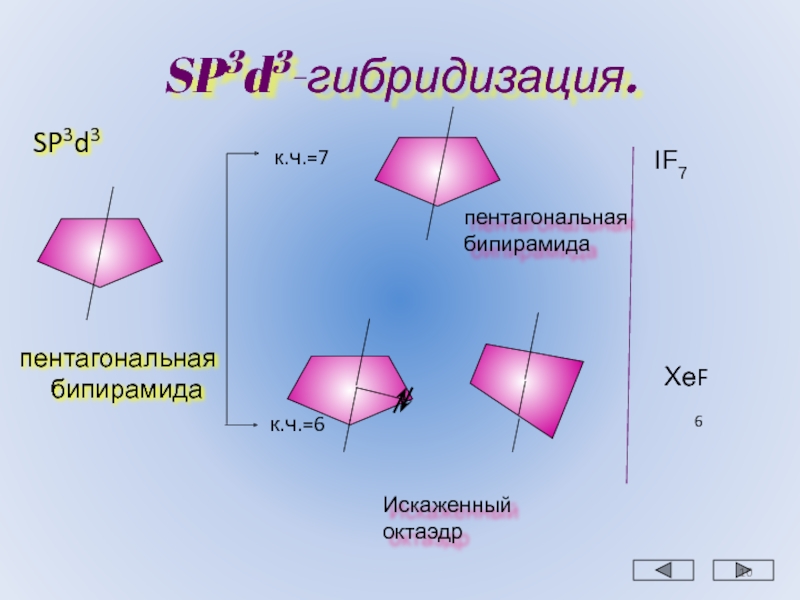
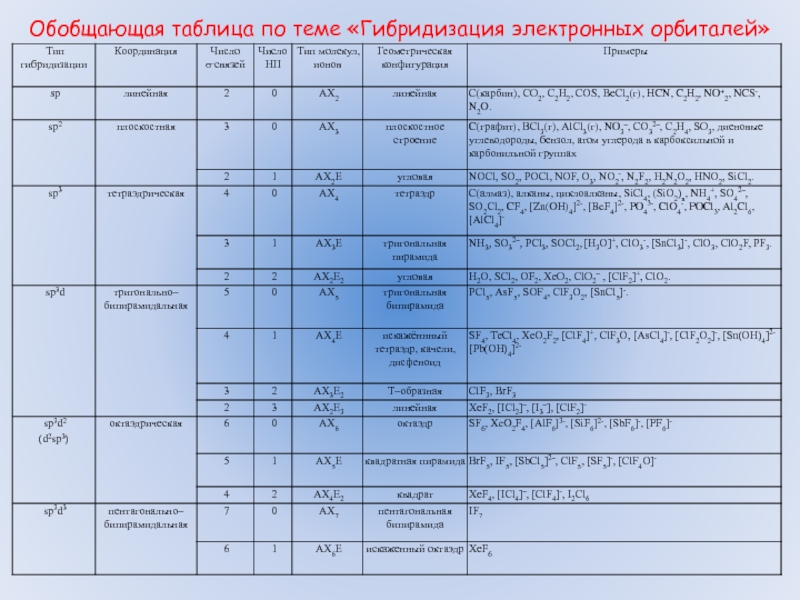
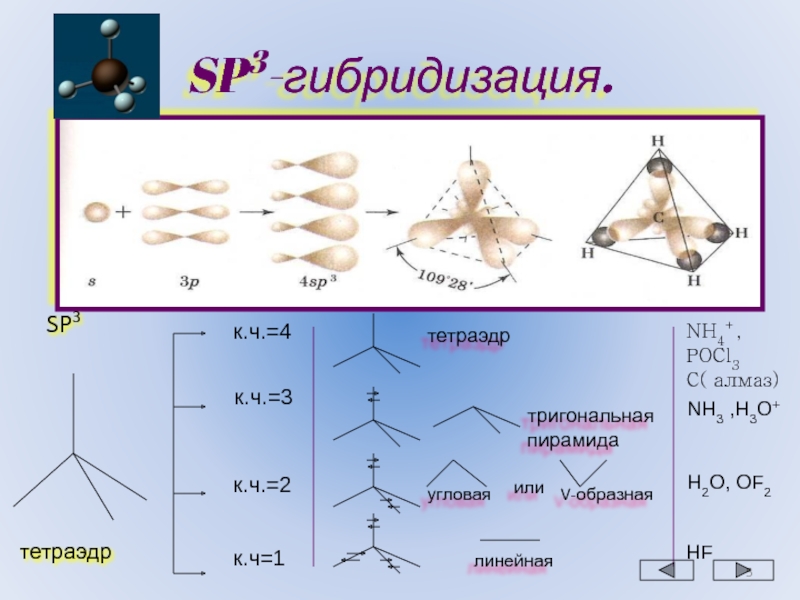
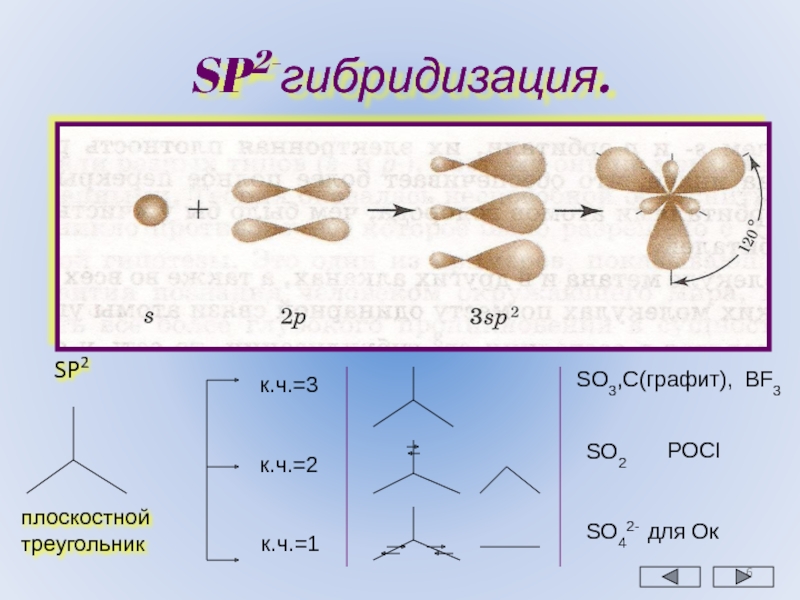
Правило 5. Если центральный атом относится к элементам третьего или последующих периодов, а концевыми атомами являются атомы кислорода или галогенов, приведенные выше правила применимы. Если же концевые атомы принадлежат менее электроотрицательным элементам, чем галогены, неподеленная пара будет занимать несвязывающую s-орбиталь, связывание осуществляется через чистые p-орбитали и валентные углы составляют приблизительно 90о.
Так, в фосфине и сероводороде угол между связями равен 93,3 и 92о соответственно (xн меньше, чем у галогенов), тогда как в Cl-S-S-Cl и PI3 валентные углы равны 104 и 102о соответствено.





![Гибридизация электронных орбиталей и геометрия молекул SP3d2-гибридизация.SP3d2.октаэдрк.ч.=6.октаэдрSF6к.ч.=5..тетрагональная пирамидак.ч.=4..плоский квадрат[SbСl5]2– ,IF5XeF4,ICI4- SP3d2-гибридизация.SP3d2.октаэдрк.ч.=6.октаэдрSF6к.ч.=5..тетрагональная пирамидак.ч.=4..плоский квадрат[SbСl5]2– ,IF5XeF4,ICI4-](/img/thumbs/c32d190a0919a079251095659e23bc41-800x.jpg)