Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основные положения теории электролитической диссоциации
Содержание
- 1. Основные положения теории электролитической диссоциации
- 2. .Проверка электропроводности раствора: Электропроводность раствора хлорида натрия
- 3. NaCl = Na+ + Cl-CaCl2 = Ca2 + + 2Cl-
- 4. это положительно или отрицательно заряженные
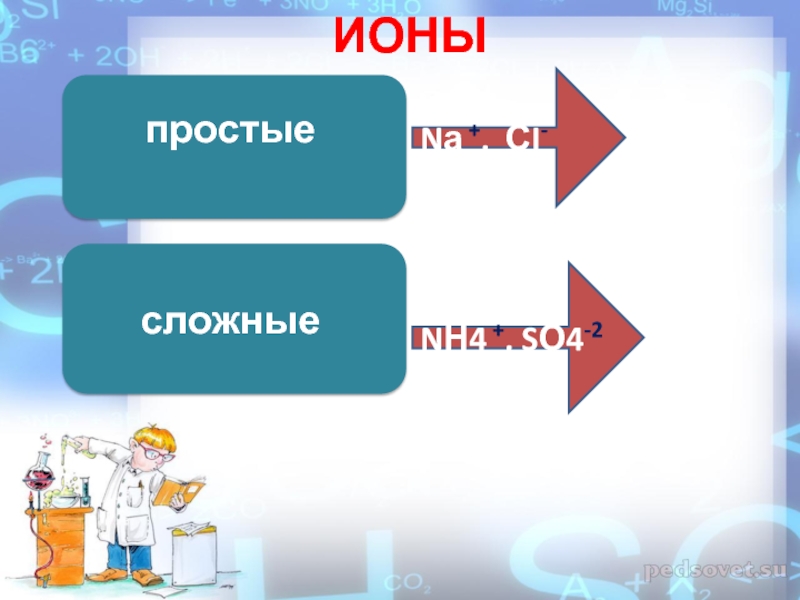
- 5. ИОНЫпростыеNа +, СI-NН4 +, SО4-2 сложные
- 6. Натрия
- 7. 2. Причиной диссоциации электролита является его гидратация
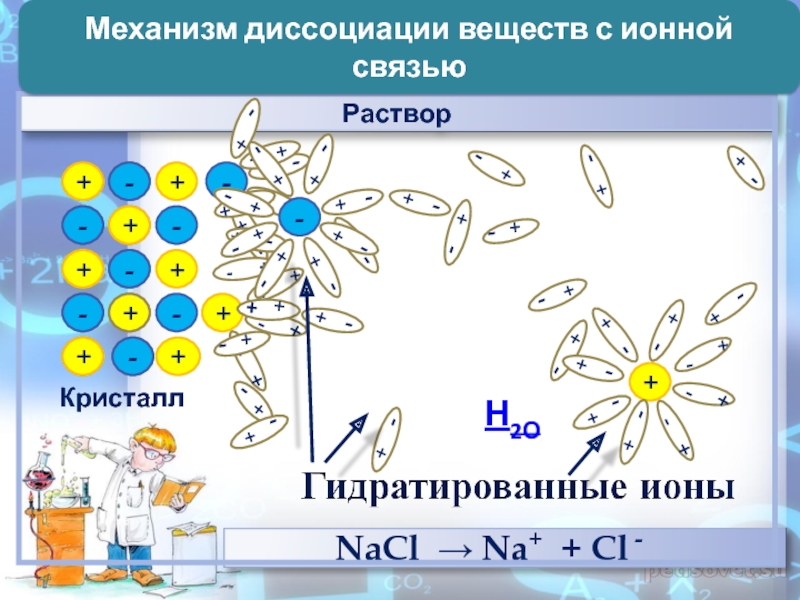
- 8. ++--++--Кристалл-+++--++---+Н2ОМеханизм диссоциации веществ с ионной связью
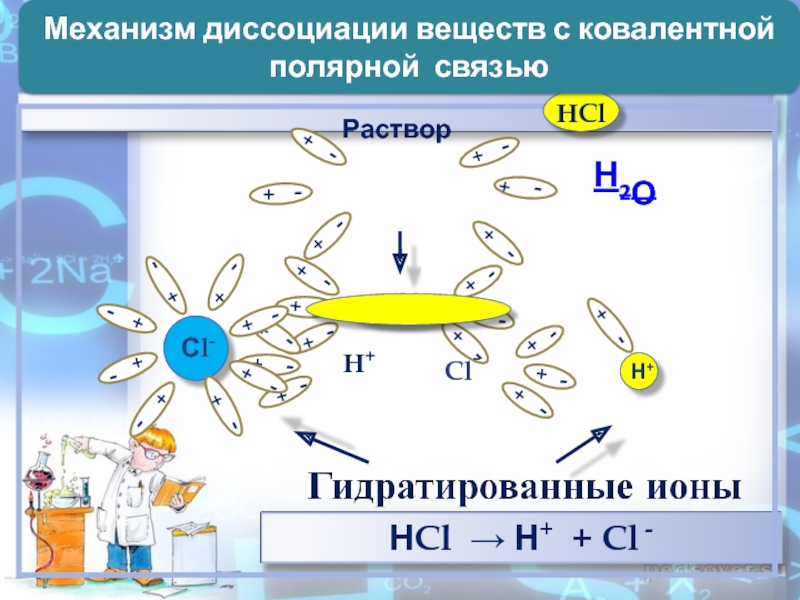
- 9. Н2ОМеханизм диссоциации веществ с ковалентной полярной связью
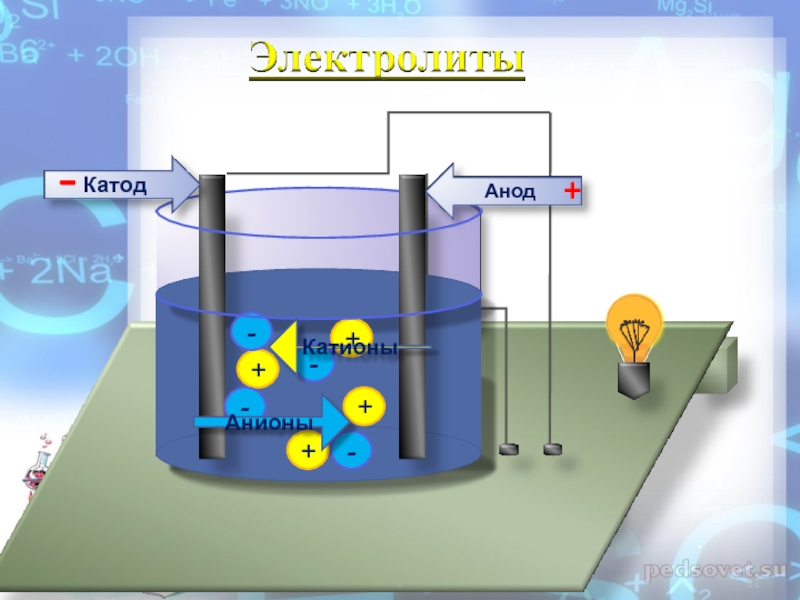
- 10. 3. Под действием электрического тока положительно заряженные
- 11. ++++----АнионыКатионы-+..
- 12. -+25.11.10Русецкая О.П.
- 13. 4. Процесс диссоциации- обратимый процесс для слабых
- 14. ЭЛЕКТРОЛИТЫ(по степени диссоциации)
- 15. Количественная характеристика процесса диссоциацииОтношение числа распавшихся молекул к общему числу молекул в раствореСила электролита
- 16. ЭЛЕКТРОЛИТЫ (по характеру образующихся ионов)КИСЛОТЫ
- 17. КИСЛОТЫэлектролиты, которые при диссоциации образуют катионы водорода
- 18. Слайд 18
- 19. Многоосновные кислоты диссоциируют ступенчатоH3PO4 (фосфорная кислота)1) Образование
- 20. ОСНОВАНИЯэлектролиты, которые при диссоциации образуют катионы металла
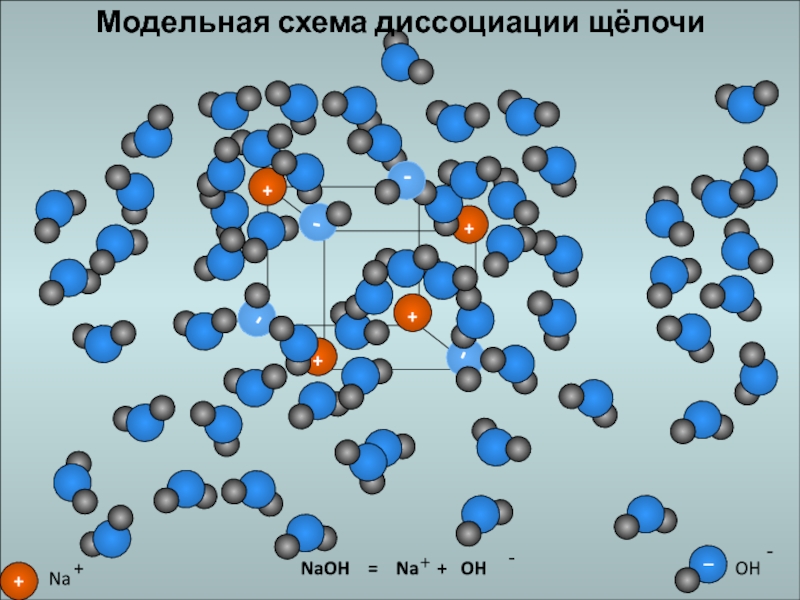
- 21. Модельная схема диссоциации щёлочи
- 22. Многокислотные основания диссоциируют ступенчатоCa(OH)2 (гидроксид кальция)1)
- 23. СОЛИ электролиты, которые при диссоциации образуют
- 24. Модельная схема диссоциации солиNaCl = + Na+
- 25. СПАСИБО ЗА ВНИМАНИЕ!
- 26. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2.
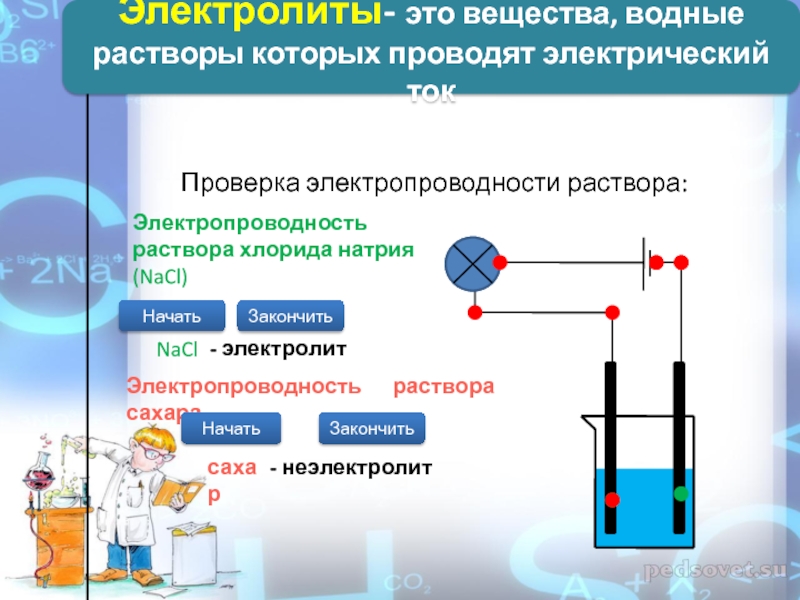
Проверка электропроводности раствора:
Электропроводность раствора хлорида натрия (NaCl)
Начать
Закончить
NaCl
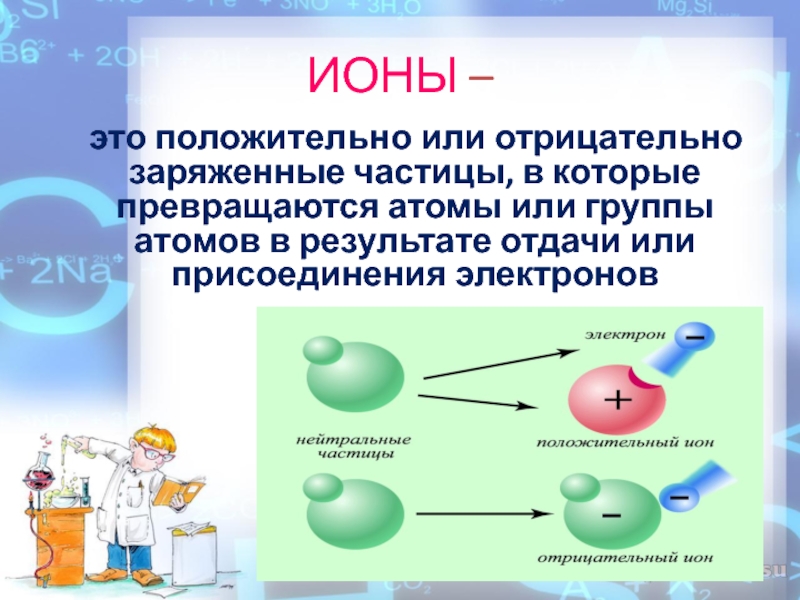
растворы которых проводят электрический токСлайд 4 это положительно или отрицательно заряженные частицы, в которые
превращаются атомы или группы атомов в результате отдачи или присоединения
электроновИОНЫ –
Слайд 6
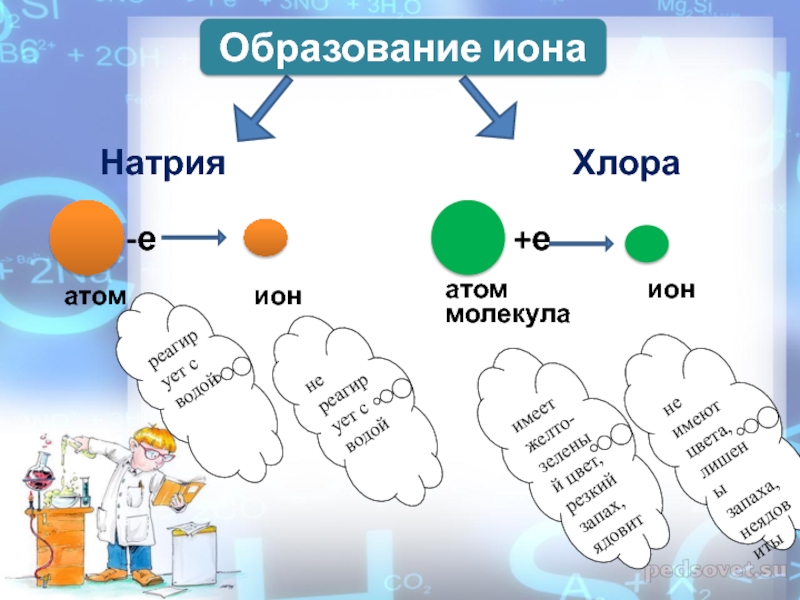
Натрия
Хлора
-е
атом ион
Образование иона
+е
атом ион
реагирует с водой
имеет желто-зеленый цвет, резкий запах, ядовит
не реагирует с водой
не имеют цвета, лишены запаха, неядовиты
молекула
Слайд 72. Причиной диссоциации электролита является его гидратация с молекулами воды
и разрыв химической связи в нем
ИОНЫ (по наличию водной оболочки)ГИДРАТИРОВАННЫЕ
Например:
В растворах и кристаллогидратах CuSO4 * 5H2O
Na2SO4* 10H2O
НЕГИДРАТИРОВАННЫЕ
Например:
В безводных солях
Cu2+SO42-
Na+NO3-
Слайд 103. Под действием электрического тока положительно заряженные ионы движутся к
положительно заряженному источнику тока – к катоду, поэтому их называют
катионами, а отрицательно заряженные ионы движутся к аноду, поэтому их называют анионами.Сумма положительных ионов равна сумме отрицательных ионов, поэтому эти растворы электронейтральны
Слайд 134. Процесс диссоциации- обратимый процесс для слабых электролитов
Наряду с процессом
диссоциации в растворах слабых электролитов протекает обратный процесс -ассоциация, т.е.
соединение ионов, поэтому, при диссоциации слабых электролитов в уравнении ставят не знак равенства, а знак обратимостиНNО2 Н + + NО2-
Слайд 14
ЭЛЕКТРОЛИТЫ
(по степени диссоциации)
СИЛЬНЫЕ
СЛАБЫЕ
5. Не все электролиты в одинаковой мере диссоциируют на ионы.
Слайд 15Количественная характеристика процесса диссоциации
Отношение числа распавшихся молекул к общему числу
молекул в растворе
Сила электролита
Слайд 16ЭЛЕКТРОЛИТЫ
(по характеру образующихся ионов)
КИСЛОТЫ
ОСНОВАНИЯ
СОЛИ6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
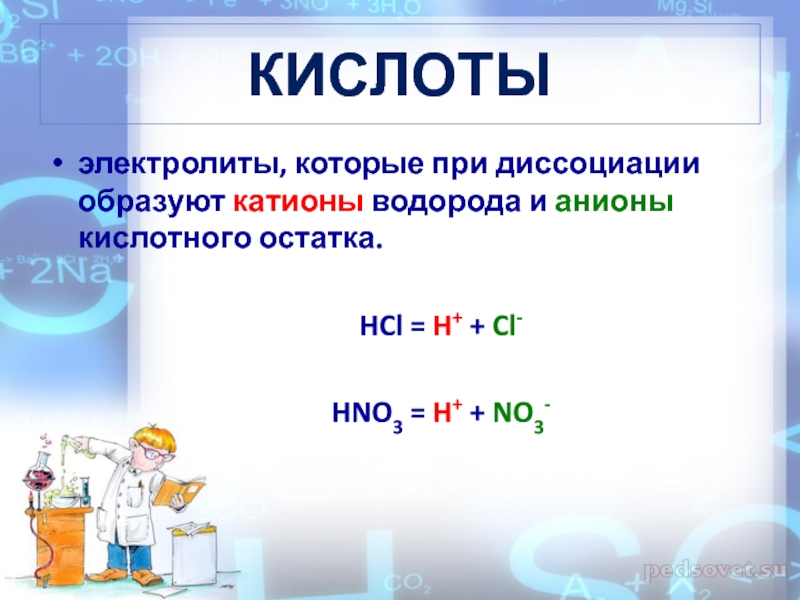
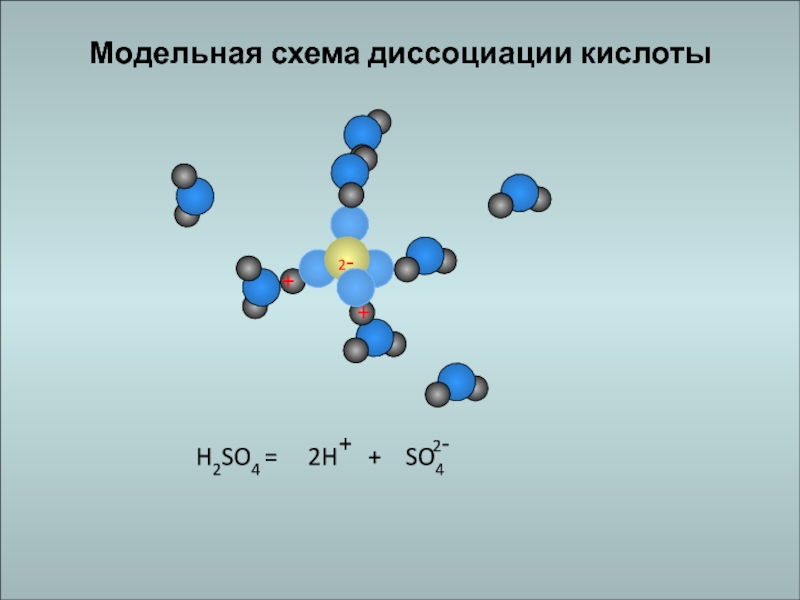
Слайд 17КИСЛОТЫ
электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного
остатка.
HCl = H+ + Cl-
HNO3 = H+ + NO3-Слайд 19Многоосновные кислоты диссоциируют ступенчато
H3PO4 (фосфорная кислота)
1) Образование дигидрофосфат-ионов
H3PO4 ↔ H+
+ H2PO4-
2) Образование гидрофосфат-ионов
H2PO4- ↔ H+ + HPO42-
3) Образование фосфат-ионов
HPO42- ↔ H+ + PO43-
Слайд 20ОСНОВАНИЯ
электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы.
NaOH
= Na+ + OH-
KOH = K+ + OH-
Слайд 22 Многокислотные основания диссоциируют ступенчато
Ca(OH)2 (гидроксид кальция)
1) Образование гидроксо-ионов кальция
Ca(OH)2
↔ OH- + СaOH+
2) Образование ионов кальция
CaOH+ ↔ Ca2+
+ OH-Слайд 23СОЛИ
электролиты, которые при диссоциации образуют катионы металла (или
аммония NH4) и анионы кислотных остатков.
Сa3PO4 = 3Сa+ +
PO43-NaСI= Na+ + СI-
NH4Cl = NH4+ + Cl-