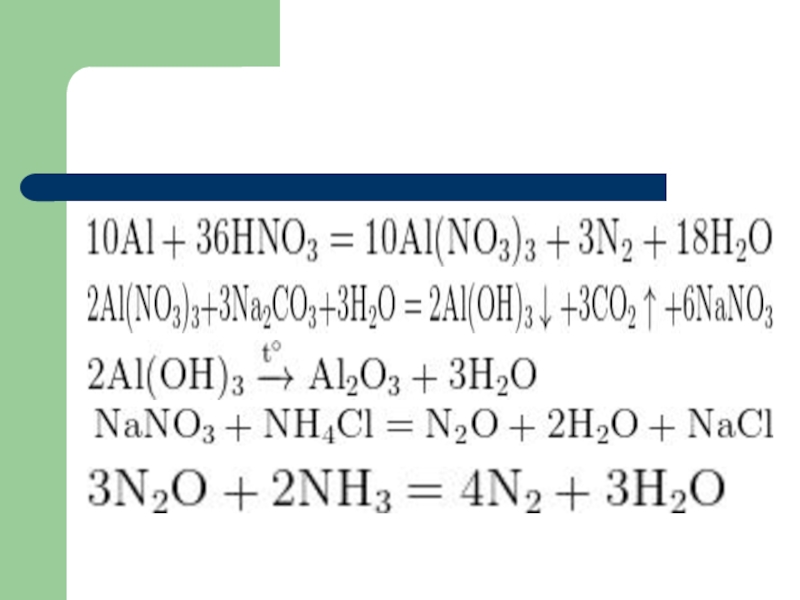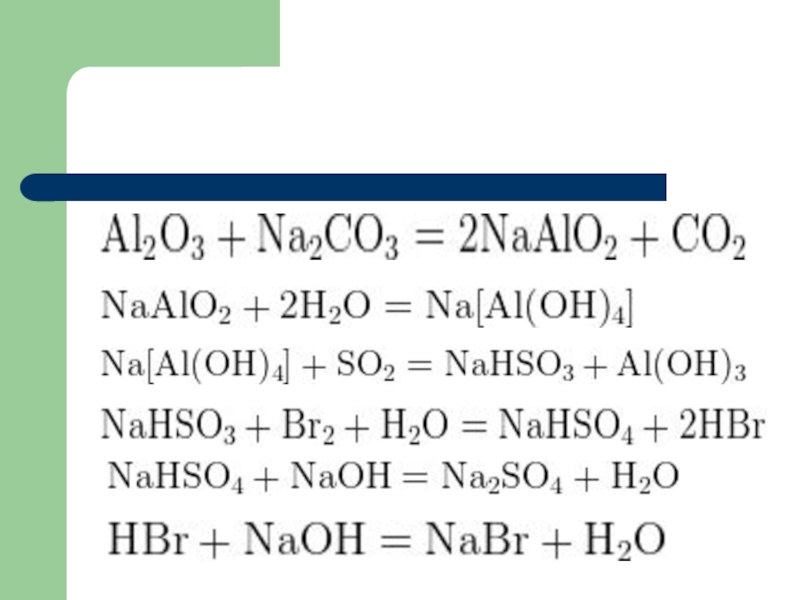Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Задания С2 на ЕГЭ по химии
Содержание
- 1. Задания С2 на ЕГЭ по химии
- 2. Условие задачи С2 на ЕГЭ по химии
- 3. Словарь непонятных терминов
- 4. Для того, чтобы решать такие задачи, надо
- 5. Необходимо иметь представление о цвете и агрегатном состоянии большинства изучаемых веществ — металлов, неметаллов, оксидов, солей.
- 6. Пример 1: Продукт взаимодействия лития с азотом обработали
- 7. Литий реагирует с азотом при комнатной температуре, образуя твёрдый нитрид лития:
- 8. При взаимодействии нитридов с водой образуется аммиак:
- 9. Аммиак реагирует с кислотами, образуя средние и
- 10. Обменная реакция между сульфатом аммония и хлоридом бария протекает с образованием осадка сульфата бария:
- 11. После удаления осадка фильтрат содержит хлорид аммония,
- 12. Пример 2: Навеску алюминия растворили в разбавленной азотной кислоте,
- 13. Слайд 13
- 14. Пример 3: Оксид алюминия сплавили с карбонатом натрия,
- 15. Слайд 15
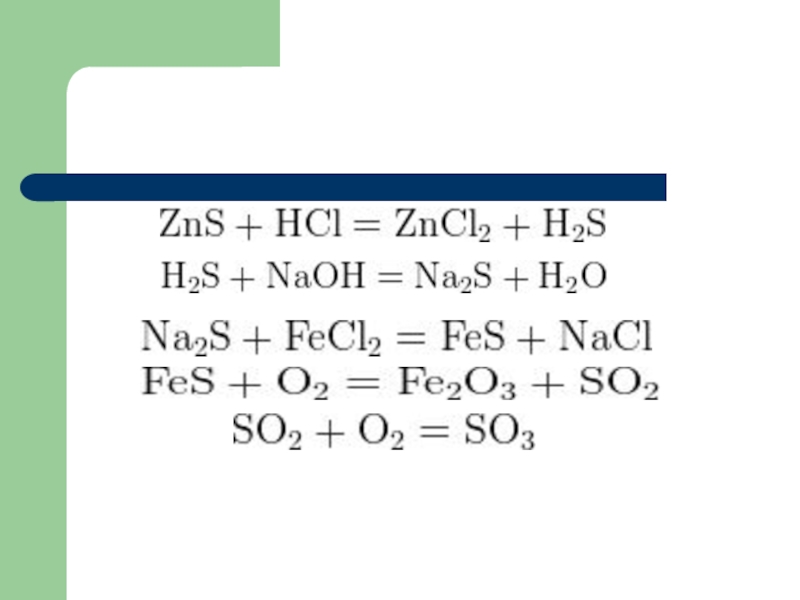
- 16. Пример 4: Сульфид цинка обработали раствором соляной кислоты,
- 17. Слайд 17
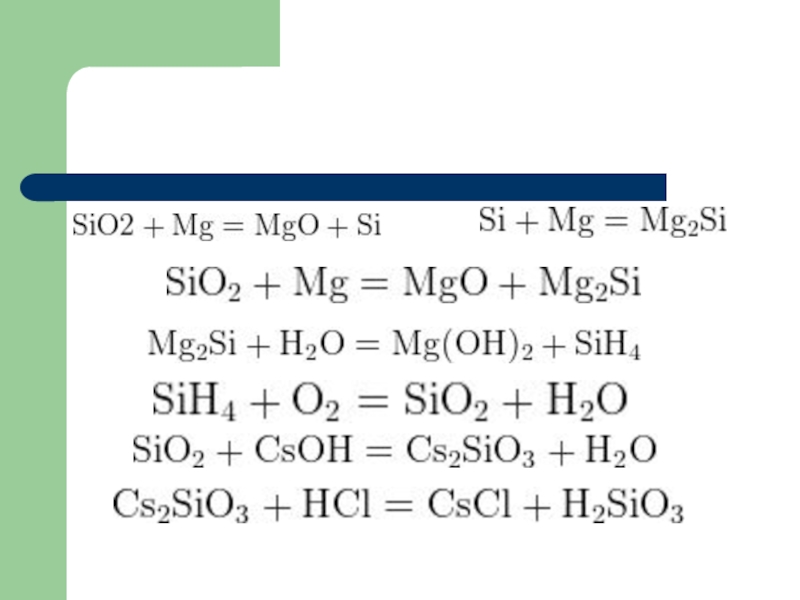
- 18. Пример 5: Оксид кремния прокалили с большим избытком
- 19. Слайд 19
- 20. Скачать презентанцию
Условие задачи С2 на ЕГЭ по химии — это текст, описывающий последовательность экспериментальных действий. Данный текст нужно превратить в уравнения реакций.