Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Периодической системе химических элементов Д.И. Менделеева - 150 лет
Содержание
- 1. Периодической системе химических элементов Д.И. Менделеева - 150 лет
- 2. Генеральная ассамблея ООН объявила 2019
- 3. Слайд 3
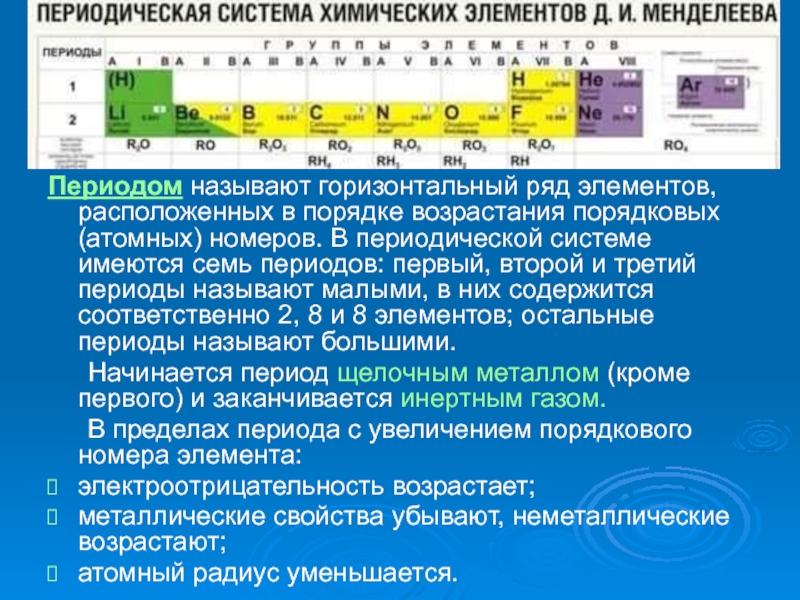
- 4. Периодом называют горизонтальный ряд элементов, расположенных в
- 5. Группами называют вертикальные ряды в периодической системе. Каждая
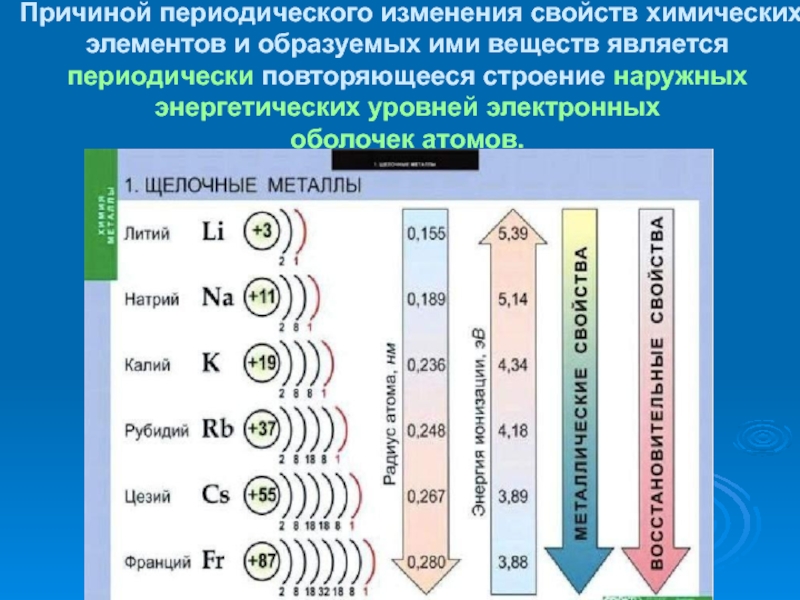
- 6. Причиной периодического изменения свойств химических элементов и
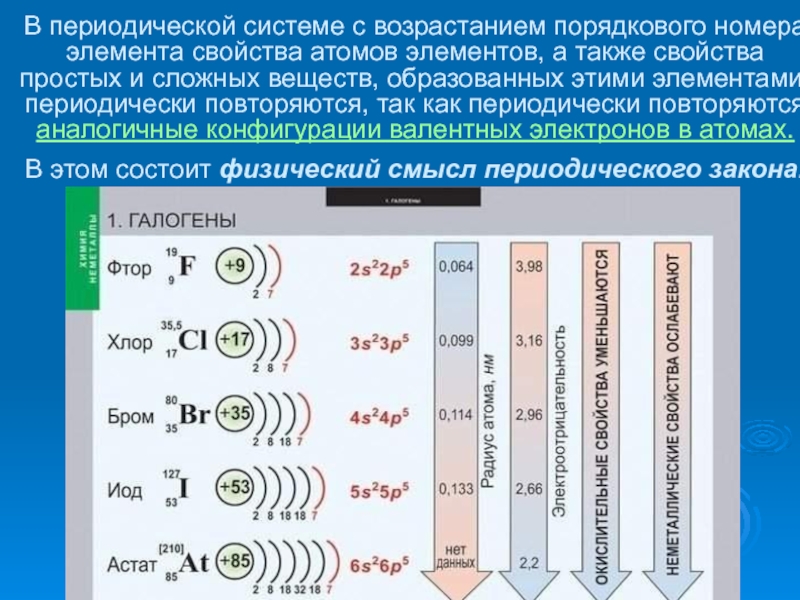
- 7. В периодической системе с возрастанием
- 8. «Гениальный химик, первоклассный физик, плодотворный исследователь в
- 9. Родился Дмитрий Менделеев 27 января (8 февраля) 1834 г. в
- 10. Вот что писал Менделеев , посвящая памяти
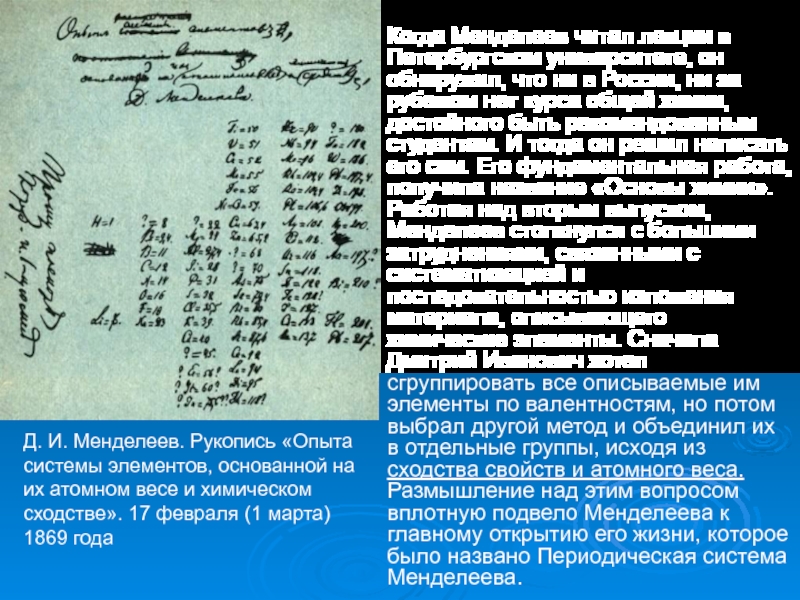
- 11. Когда Менделеев читал лекции в Петербургском университете,
- 12. То, что некоторые химические элементы проявляют черты
- 13. Легенду, будто бы Периодическая таблица приснилась ему
- 14. 1 марта 1869 года считается днем открытия периодического
- 15. Первый, еще несовершенный набросок таблицы в следующие
- 16. Статья была переведена на немецкий язык и
- 17. До конца жизни он продолжал развивать и
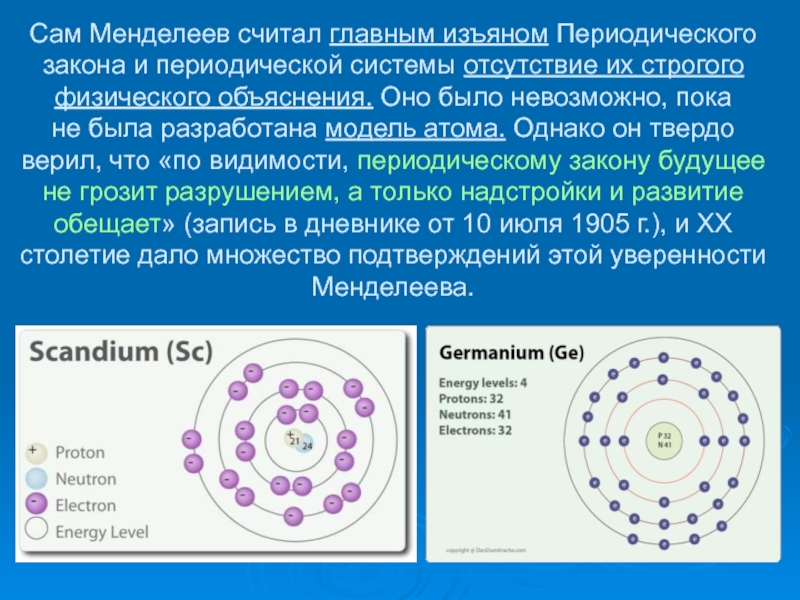
- 18. Сам Менделеев считал главным изъяном
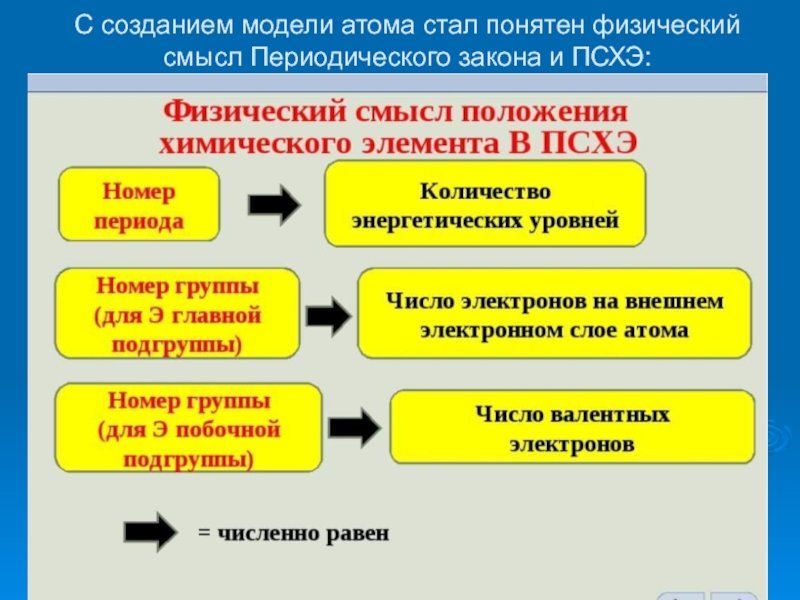
- 19. С созданием модели атома стал понятен физический смысл Периодического закона и ПСХЭ:
- 20. Слайд 20
- 21. Свяжем строение атома углерода с его положением в ПСХЭ
- 22. Как часто это случается, осознание величайшего открытия
- 23. Слайд 23
- 24. Традиции отечественной химической школы не иссякают и
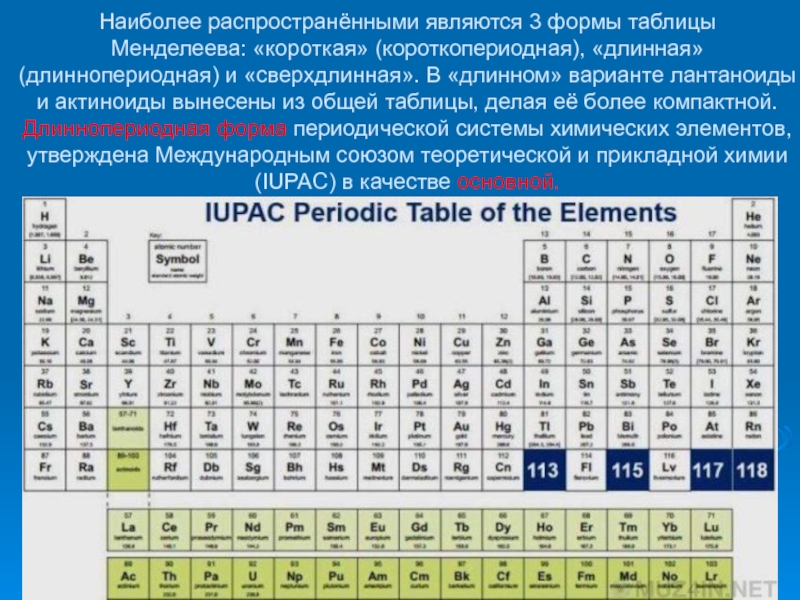
- 25. Наиболее распространёнными являются 3 формы
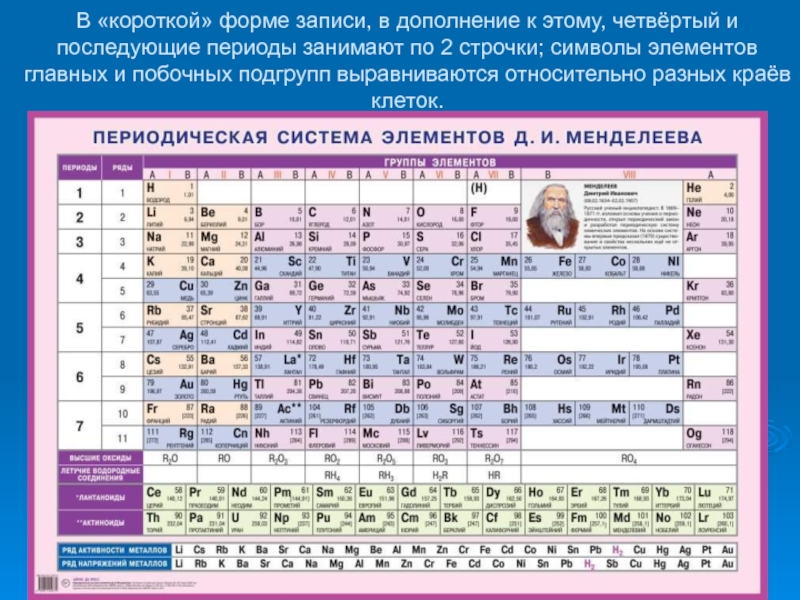
- 26. В «короткой» форме записи, в дополнение
- 27. Современная длиннопериодная Периодическая таблица содержит 118 известных химических
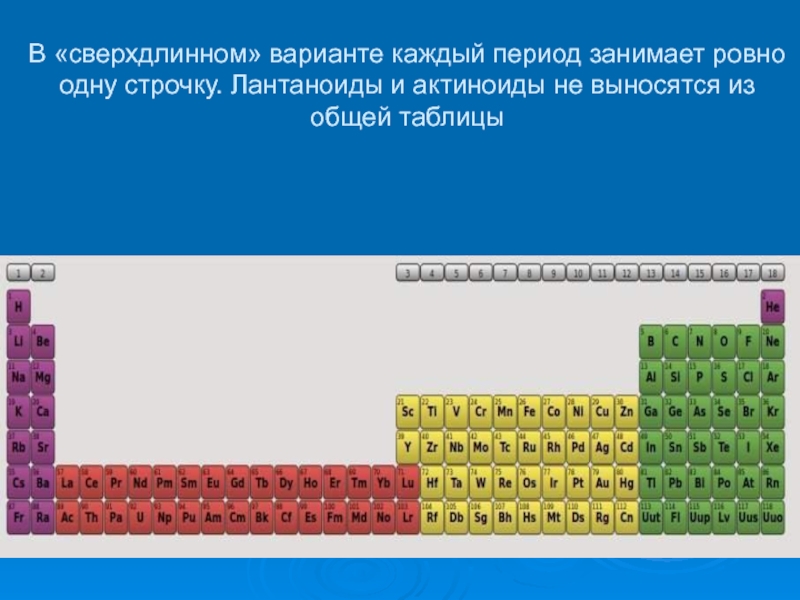
- 28. В «сверхдлинном» варианте каждый период занимает
- 29. В этом году Лаборатория ядерных реакций
- 30. Именно в Дубне на ускорительном комплексе У-400
- 31. «Границ научному познанию и предсказанию предвидеть невозможно»Д.И.Менделеев
- 32. «Какова химия – такова и
- 33. ?
- 34. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2 Генеральная ассамблея ООН объявила 2019 год Международным годом периодической таблицы
химических элементов в честь периодического закона, открытого Дмитрием Ивановичем Менделеевым
в 1869 г.Илья Репин. Портрет Д. И. Менделеева в мантии доктора права Эдинбургского университета. 1885; акварель
«Всего более четыре предмета составили моё имя, периодический закон, исследование упругости газов, понимание растворов как ассоциации и „Основы химии". Тут моё богатство. Оно не отнято у кого-нибудь, а произведено мною» Д.. Менделеев
Слайд 3 Периодический закон в формулировке Д.И. Менделеева: Свойства простых тел, а
также формы и свойства соединений элементов находятся в периодической зависимости
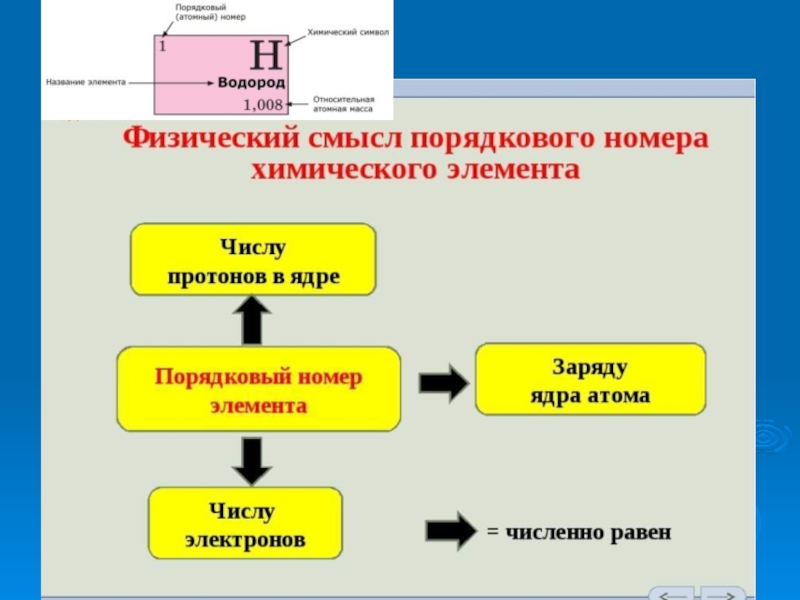
от величин атомных весов элементов. Современная формулировка ПЗ Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера) Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов в зависимости от зарядов их атомов (положения в ПСХЭ)
Слайд 4
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных)
номеров. В периодической системе имеются семь периодов: первый, второй и
третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими.Начинается период щелочным металлом (кроме первого) и заканчивается инертным газом.
В пределах периода с увеличением порядкового номера элемента:
электроотрицательность возрастает;
металлические свойства убывают, неметаллические возрастают;
атомный радиус уменьшается.
Слайд 5
Группами называют вертикальные ряды в периодической системе. Каждая группа состоит из
главной и побочной подгрупп. Главные подгруппы включают в себя элементы
малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.Свойства элементов в подгруппах закономерно изменяются сверху вниз:
усиливаются металлические свойства и ослабевают неметаллические;
возрастает атомный радиус;
возрастает сила образованных элементом оснований и бескислородных кислот;
электроотрицательность падает.
Слайд 6Причиной периодического изменения свойств химических элементов и образуемых ими веществ
является периодически повторяющееся строение наружных энергетических уровней электронных
оболочек атомов.
Слайд 7 В периодической системе с возрастанием порядкового номера элемента свойства атомов
элементов, а также свойства простых и сложных веществ, образованных этими
элементами, периодически повторяются, так как периодически повторяются аналогичные конфигурации валентных электронов в атомах. В этом состоит физический смысл периодического закона.Слайд 8«Гениальный химик, первоклассный физик, плодотворный исследователь в области гидродинамики, метеорологии,
геологии, в различных отделах химической технологии и других сопредельных с химией
и физикой дисциплинах, глубокий знаток химической промышленности и промышленности вообще, особенно русской, оригинальный мыслитель в области учения о народном хозяйстве, государственный ум, которому, к сожалению, не суждено было стать государственным человеком, но который видел и понимал задачи и будущность России лучше представителей нашей официальной власти». Такую оценку Менделееву дает Лев Александрович Чугаев - русский советский химик и биохимик, профессор Петербургского технологического института и Петербургского университета.Н. А. Ярошенко. Д. И. Менделеев. 1886. Масло.
Слайд 9Родился Дмитрий Менделеев 27 января (8 февраля) 1834 г. в Тобольске, семнадцатым и
последним ребенком в семье Ивана Павловича Менделеева, в то время занимавшего
должность директора Тобольской гимназии и училищ Тобольского округа. Отец умер рано. Воспитанием детей занималась мать. Очень много внимания она уделяла младшему сыну, в котором смогла разглядеть его необыкновенные способности.Иван Павлович Менделеев —
отец Д. И. Менделеева
Слайд 10Вот что писал Менделеев , посвящая памяти матери свое сочинение
«Исследование водных растворов по удельному весу»: «Это исследование посвящается памяти
матери ее последышем. Она могла его возрастить только своим трудом, ведя заводское дело; воспитывала примером, исправляла любовью и, чтобы отдать науке, вывезла из Сибири, тратя последние средства и силы. Умирая, завещала: избегать латинского самообольщения, настаивать в труде, а не в словах, и терпеливо искать божескую или научную правду, ибо понимала, сколь часто диалектика обманывает, сколь многое еще должно узнать, и как при помощи науки, без насилия, любовно, но твердо устраняются предрассудки и ошибки, а достигаются: охрана добытой истины, свобода дальнейшего развития, общее благо и внутреннее благополучие. Заветы матери считает священными Д. Менделеев».23 лет от роду он становится доцентом Петербургского университета, где читает сначала теоретическую, потом органическую химию.
Мария Дмитриевна Менделеева,
мать Д. И. Менделеева
Слайд 11Когда Менделеев читал лекции в Петербургском университете, он обнаружил, что
ни в России, ни за рубежом нет курса общей химии,
достойного быть рекомендованным студентам. И тогда он решил написать его сам. Его фундаментальная работа, получила название «Основы химии». Работая над вторым выпуском, Менделеев столкнулся с большими затруднениями, связанными с систематизацией и последовательностью изложения материала, описывающего химические элементы. Сначала Дмитрий Иванович хотел сгруппировать все описываемые им элементы по валентностям, но потом выбрал другой метод и объединил их в отдельные группы, исходя из сходства свойств и атомного веса. Размышление над этим вопросом вплотную подвело Менделеева к главному открытию его жизни, которое было названо Периодическая система Менделеева.Д. И. Менделеев. Рукопись «Опыта системы элементов, основанной на их атомном весе и химическом сходстве». 17 февраля (1 марта) 1869 года
Слайд 12То, что некоторые химические элементы проявляют черты явного сходства, для
химиков тех лет не было секретом. Были сделаны даже попытки составить
таблицы элементов. Однако ни одна из предложенных систем не охватывала всю совокупность известных химических элементов. Хотя существование отдельных групп и отдельных семейств можно было считать установленным фактом, связь этих групп между собой оставалась непонятной.Менделееву удалось найти ее, расположив все элементы в порядке возрастания их атомной массы. Установление периодической закономерности потребовало от него огромного напряжения мысли. Написав на отдельных карточках элементы с их атомными весами и коренными свойствами, Менделеев стал раскладывать их в разнообразных комбинациях, переставляя и меняя местами. Дело осложнялось тем, что многие элементы в то время еще не были открыты, а атомные веса уже известных определены с большими неточностями. Тем не менее искомая закономерность вскоре была обнаружена.
Слайд 13Легенду, будто бы Периодическая таблица приснилась ему во сне, Менделеев
придумал сам, для настырных поклонников науки, не понимающих, что такое озарение.
Менделеев, будучи химиком, за основу своей системы взял химические свойства элементов, решив расположить химически похожие элементы друг под другом, при этом соблюдая принцип возрастания атомных весов. Ничего не вышло! Тогда ученый просто взял и произвольно изменил атомные веса нескольких элементов (например, он присвоил урану атомный вес 240 вместо принятого 60, т. е. увеличил в четыре раза!), переставил местами кобальт и никель, теллур и йод, поставил три пустые карточки, предсказав существование трех неизвестных элементов. Опубликовав в 1869 г. первый вариант своей таблицы (63 элемента), он открыл закон, что «свойства элементов стоят в периодической зависимости от их атомного веса».Слайд 14
1 марта 1869 года считается днем открытия периодического закона.
Суть открытия
Менделеева состояла в том, что свойства элементов с ростом атомной
массы изменяются не монотонно, а периодически.Это было самое главное в открытии Менделеева, позволявшее связать воедино все казавшиеся до этого разрозненными группы элементов. Неожиданные сбои в этом периодическом ряду Менделеев совершенно правильно объяснил тем, что науке известны еще не все химические элементы. В своей таблице он оставил незаполненные клеточки, однако предсказал атомный вес и химические свойства предполагаемых элементов. Он также поправил ряд неточно определенных атомных масс элементов, и дальнейшие исследования полностью подтвердили его правоту.
Золотая медаль АН СССР
(ныне — РАН) имени Д. И. Менделеева
Слайд 15 Первый, еще несовершенный набросок таблицы в следующие годы подвергся переконструированию.
Уже в 1869 г. Менделеев поместил галогены и щелочные металлы не в
центре таблицы, как раньше, а по ее краям (как это делается теперь). В следующие годы Менделеев исправил атомные веса одиннадцати элементов и изменил местоположение двадцати. В итоге в 1871 г. появилась статья «Периодическая законность для химических элементов», в которой периодическая таблица приняла вполне современный вид.Слайд 16Статья была переведена на немецкий язык и оттиски ее были
разосланы многим известным европейским химикам. Но, увы, никто не оценил важности
сделанного открытия. Отношение к Периодическому закону изменилось только в 1875 г., когда Ф. Лекокде Буабодран открыл новый элемент — галлий, свойства которого поразительно совпадали с предсказаниями Менделеева (он назвал этот неизвестный еще элемент экаалюминием). Новым триумфом Менделеева стало открытие в 1879 г. скандия, а в 1886 г. германия, свойства которых также полностью соответствовали описаниям Менделеева.Слайд 17До конца жизни он продолжал развивать и совершенствовать учение о
периодичности. Открытия в 1890-х явления радиоактивности и благородных газов поставили
периодическую систему перед серьезными трудностями. Проблема размещения в таблице гелия, аргона и их аналогов успешно разрешилась лишь в 1900 г.: они были помещены в самостоятельную нулевую группу.Слайд 18 Сам Менделеев считал главным изъяном Периодического закона и периодической системы
отсутствие их строгого физического объяснения. Оно было невозможно, пока не была
разработана модель атома. Однако он твердо верил, что «по видимости, периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает» (запись в дневнике от 10 июля 1905 г.), и XX столетие дало множество подтверждений этой уверенности Менделеева.Слайд 22Как часто это случается, осознание величайшего открытия пришло к научному
миру не сразу. Только через несколько лет, когда были открыты
предсказанные Менделеевым ранее неизвестные элементы, весь мир взорвался рукоплесканиями, и русского химика стали выбирать почетным членом различных мировых академий и научных обществ.Слайд 23 Право дать имя новому элементу принадлежит тем, кто его открыл.
Девять первых трансурановых элементов впервые получены американскими физиками. «Для нового
элемента было предложено наименование «менделевий»... в знак признания заслуг великого русского химика Д.И. Менделеева, который первый использовал для предсказания химических свойств неоткрытых элементов периодическую систему элементов, принципы которой явились ключом для открытия большинства трансурановых элементов». Это слова из книги Э. Хайда, И. Перлмана, Г. Сиборга «Трансурановые элементы».Слайд 24Традиции отечественной химической школы не иссякают и сегодня. При участии
наших учёных происходят открытия новых химических элементов Этому свидетельствуют публикации
Ю.Ц. Оганесяна и С.Н. Дмитриева об открытии новых сверхтяжелых элементов с атомными номерами 113 – 118 периодической таблицы Д.И. Менделеева. В ближайшие годы возможно и открытие химических элементов, не вписывающихся в таблицу Менделеева, что, несомненно, заставит расширить границы познания. Недавно, наконец, был решен вопрос, и один из вновь открытых элементов теперь будет носить имя Оганесяна. Так же решен вопрос о присвоении имени одному из новых элементов – московий (в честь Московского региона (г. Дубна)Слайд 25 Наиболее распространёнными являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и
«сверхдлинная». В «длинном» варианте лантаноиды и актиноиды вынесены из общей
таблицы, делая её более компактной. Длиннопериодная форма периодической системы химических элементов, утверждена Международным союзом теоретической и прикладной химии (IUPAC) в качестве основной.Слайд 26 В «короткой» форме записи, в дополнение к этому, четвёртый и
последующие периоды занимают по 2 строчки; символы элементов главных и
побочных подгрупп выравниваются относительно разных краёв клеток.Слайд 27Современная длиннопериодная Периодическая таблица содержит 118 известных химических элементов. Они разбиты
на 7 периодов и 18 групп
Слайд 28 В «сверхдлинном» варианте каждый период занимает ровно одну строчку. Лантаноиды
и актиноиды не выносятся из общей таблицы
Слайд 29 В этом году Лаборатория ядерных реакций имени Г.Н. Флерова в
Объединённом институте ядерных исследований (ОИЯИ) в Дубне запустят новый ускорительный
комплекс — Фабрику сверхтяжёлых элементов. Этот комплекс станет базой для синтеза новых химических элементов.Ускорительный комплекс У-400М
Слайд 30Именно в Дубне на ускорительном комплексе У-400 были открыты 113-й
элемент (нихоний, Nh), 115-й (московий, Mc), 117-й (теннесин, Ts) и
118-й (оганесон, Og).«Мы готовимся к синтезу первых двух элементов восьмого периода — 119-го и 120-го. Планируем начать соответствующие эксперименты в 2019 году», — сказал «Известиям» учёный секретарь Лаборатории ядерных реакций ОИЯИ Александр Карпов. Разумеется, искусственно синтезированный радиоактивный элемент 118 не встречается в природе. Вообще, в природе не встречаются элементы, атомные числа которых превышают 94. Трансурановые элементы производятся искусственно. Элемент 119 сейчас носит временное предварительное название унуннений (Uue), а элемент 120 — унбинилий (Ubn). Синтез унуннения (он же эка-франций) станет значительным событием для науки. Дело в том, что элемент с атомным номером 119 и прогнозированной атомной массой 316 а. е. м. после его синтеза станет первым элементом в восьмом периоде периодической таблицы химических элементов.
Слайд 32 «Какова химия – такова и жизнь»
Леонид Костандов – глава советского химпрома
ЖИВИТЕ
ЯРКО
С ХИМИЕЙ!!!
Учитель химии МБОУ
Урывской СОШ Каменского района Ростовской областиСкачкова Лариса Николаевна