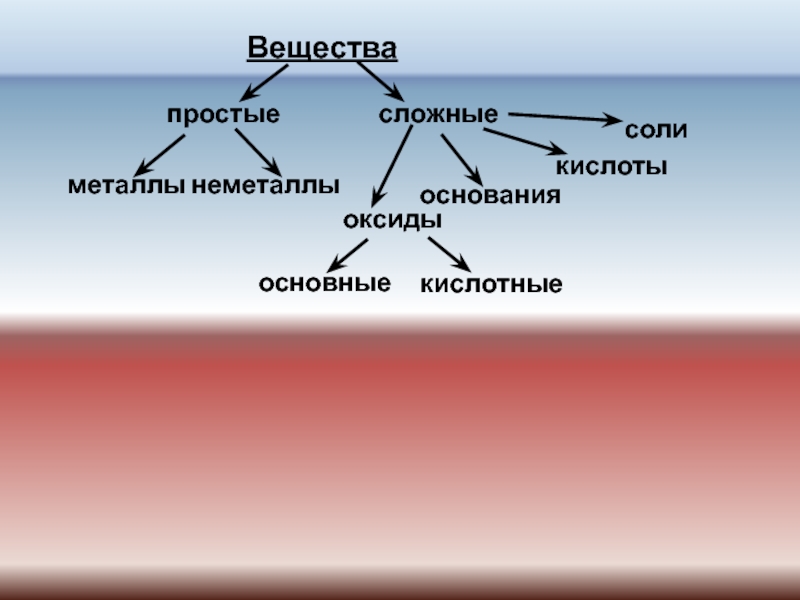
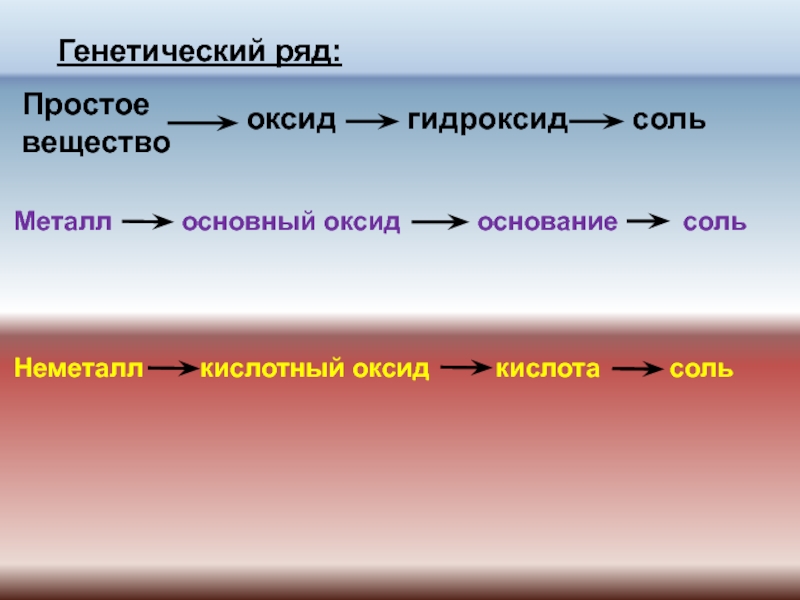
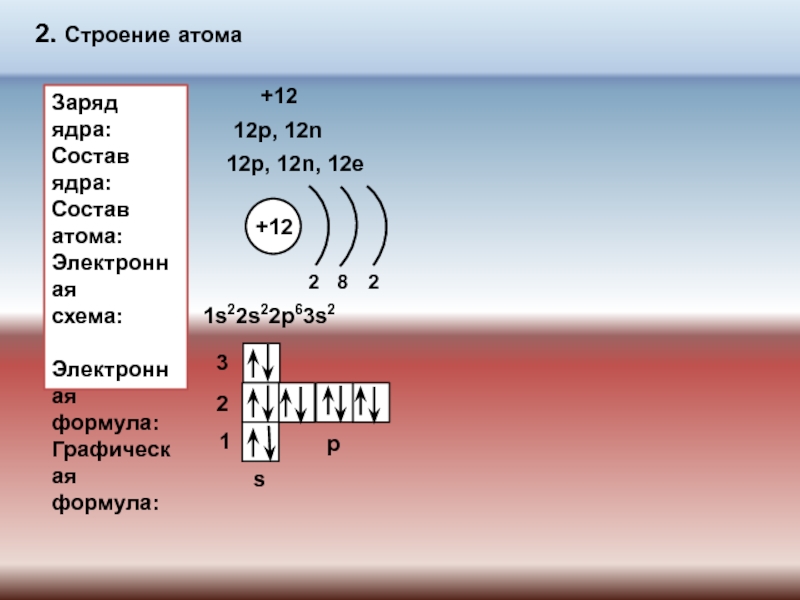
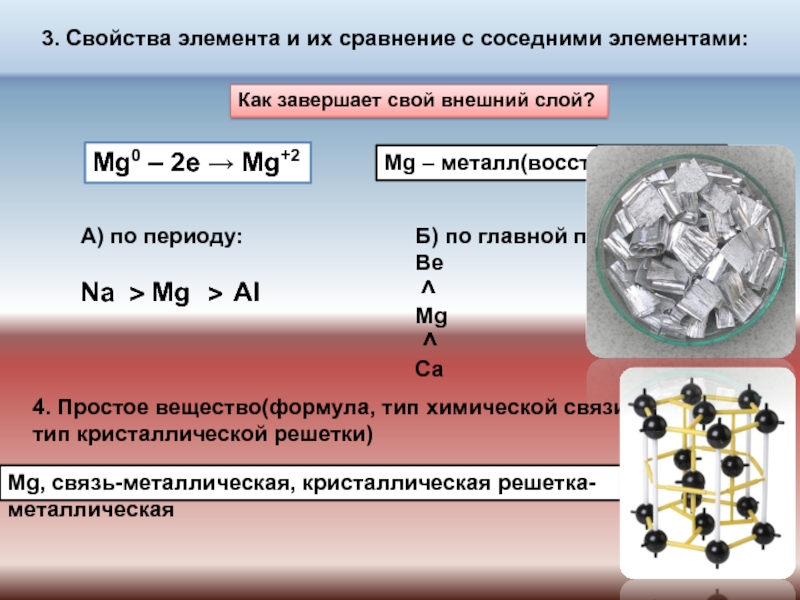
№ 518
Выборгского района Санкт-Петербурга
Характеристика химического
элемента по его положению
в ПСХЭ Д.И.МенделееваЯкубенок Мария Львовна
учитель химии
koba299@yandex.ru
2015 год