Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
АЛКЕНЫ
Содержание
- 1. АЛКЕНЫ
- 2. Номенклатура и изомерия
- 3. ИзомерияСтруктурная изомерия: а) изомерия
- 4. ИзомерияПространственная геометрическая изомерия
- 5. Физические свойства Их
- 6. Химические свойства H – C =
- 7. || пропанCH3 – CH2 –
- 8. ||Реакции присоединения CH3 – CH
- 9. пропанол-2Реакции присоединения CH3 –
- 10. пропил-2-серная кислотаРеакции присоединения пропанолCH2 –
- 11. Реакции присоединения Алкилирование
- 12. Реакции присоединения Взаимное алкилирование (обратный процесс крекинга
- 13. Реакции присоединения Реакции полимеризации.
- 14. Реакции окисленияГорение2 H2O+2 CO2 ↑2 CO ↑+2
- 15. Частичное окисление кислородом воздуха с образованием
- 16. Реакции окисленияОкисление кислородом окислителя (KMnO4, K2Cr2O7 и
- 17. Реакции окисленияЖесткое окисление кислородом более энергичного окислителя
- 18. Реакции окисления
- 19. Реакции изомеризации
- 20. до алкадиенов
- 21. Обобщение II. Реакции окисленияIII. Реакции замещенияIV. Реакции
- 22. Крекинг нефтепродуктовC C
- 23. Получение алкеновВнутримолекулярная дегидратация спиртов
- 24. Получение алкеновДегалогенирование дигалогенпроизводных алканов
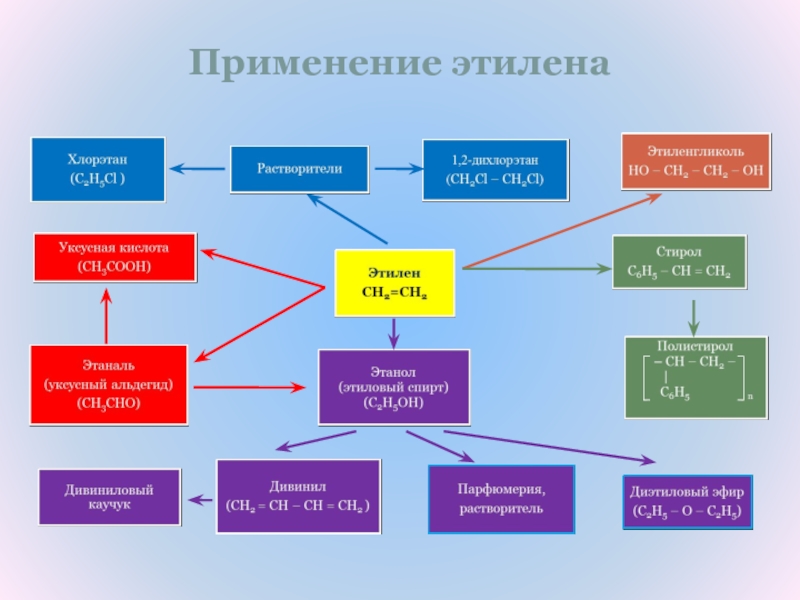
- 25. Применение этилена
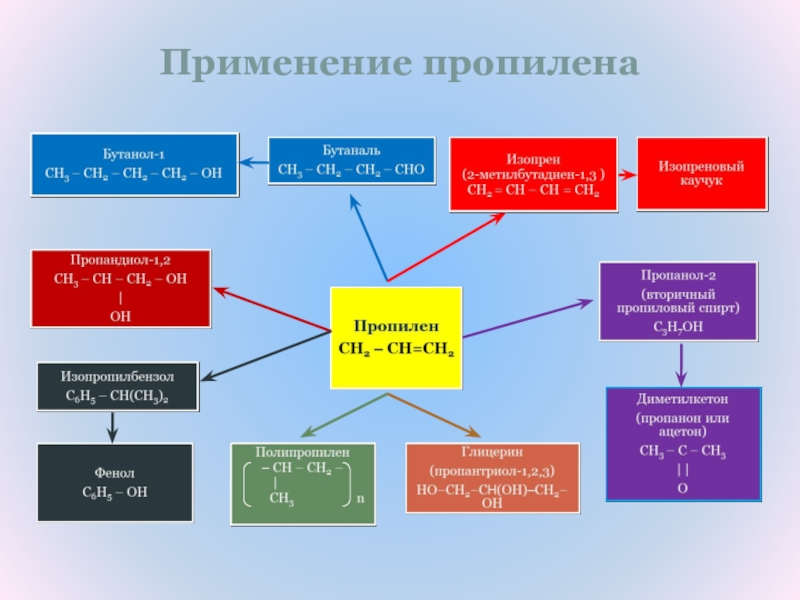
- 26. Применение пропилена
- 27. Применение изомеров бутилена
- 28. Домашнее задание
- 29. Используемая литература«Репетитор по химии (издание 15-ое)», под
- 30. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ДМИТРИЕНКО К. Е., УЧИТЕЛЬ ХИМИИ
МОУ
КАЙГОРОДСКАЯ СОШ
КРАСНОЗЕРСКОГО РАЙОНА
НОВОСИБИРСКОЙ ОБЛАСТИ
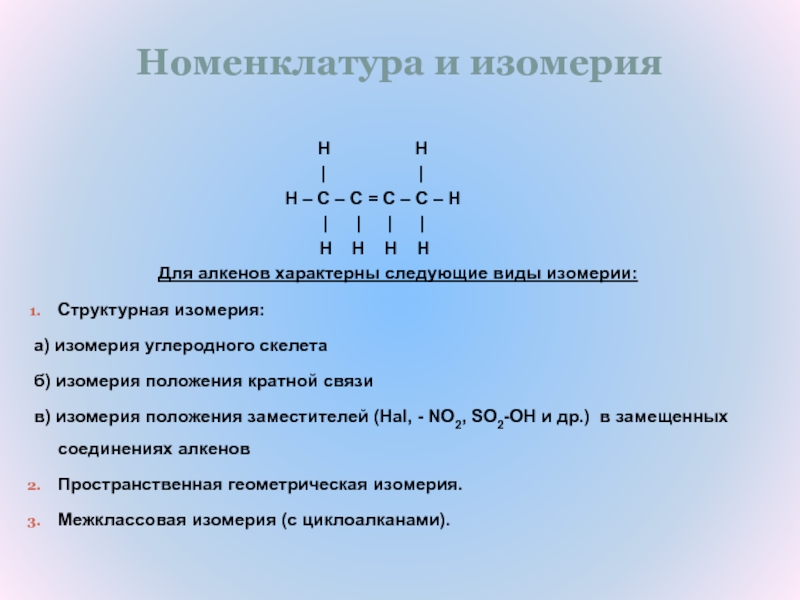
Слайд 2Номенклатура и изомерия
H H
| |
H – C – C = C – C – H
| | | |
H H H H
Для алкенов характерны следующие виды изомерии:
Структурная изомерия:
а) изомерия углеродного скелета
б) изомерия положения кратной связи
в) изомерия положения заместителей (Hal, - NO2, SO2-OH и др.) в замещенных соединениях алкенов
Пространственная геометрическая изомерия.
Межклассовая изомерия (с циклоалканами).
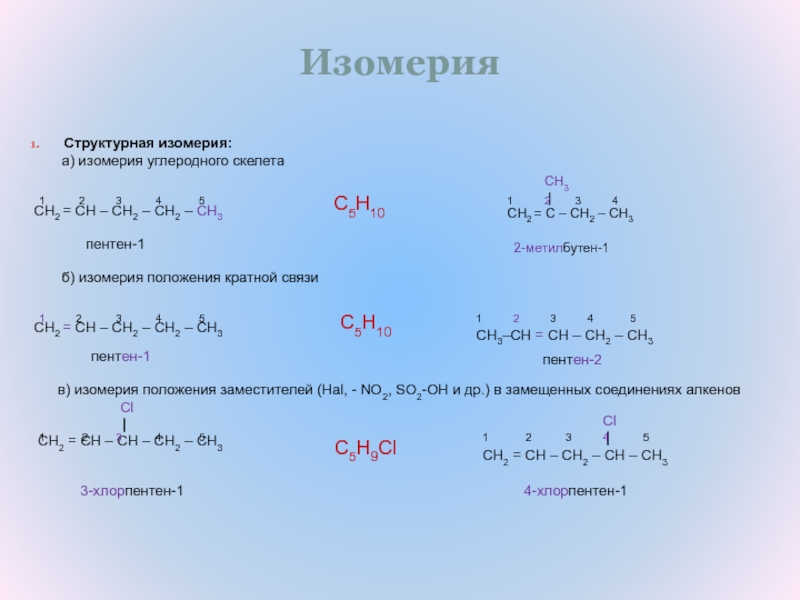
Слайд 3Изомерия
Структурная изомерия:
а) изомерия углеродного скелета
CH2 = CH – CH2 – CH2 – CH3
пентен-1
б) изомерия положения кратной связи
CH2 = CH – CH2 – CH2 – CH3
пентен-1
в) изомерия положения заместителей (Hal, - NO2, SO2-OH и др.) в замещенных соединениях алкенов
Cl
|
CH2 = CH – CH – CH2 – CH3
CH3
|
CH2 = C – CH2 – CH3
1 2 3 4 5
1 2 3 4
2-метилбутен-1
C5H10
пентен-2
CH3–CH = CH – CH2 – CH3
1 2 3 4 5
C5H10
1 2 3 4 5
1 2 3 4 5
3-хлорпентен-1
4-хлорпентен-1
Cl
|
CH2 = CH – CH2 – CH – CH3
1 2 3 4 5
C5H9Cl
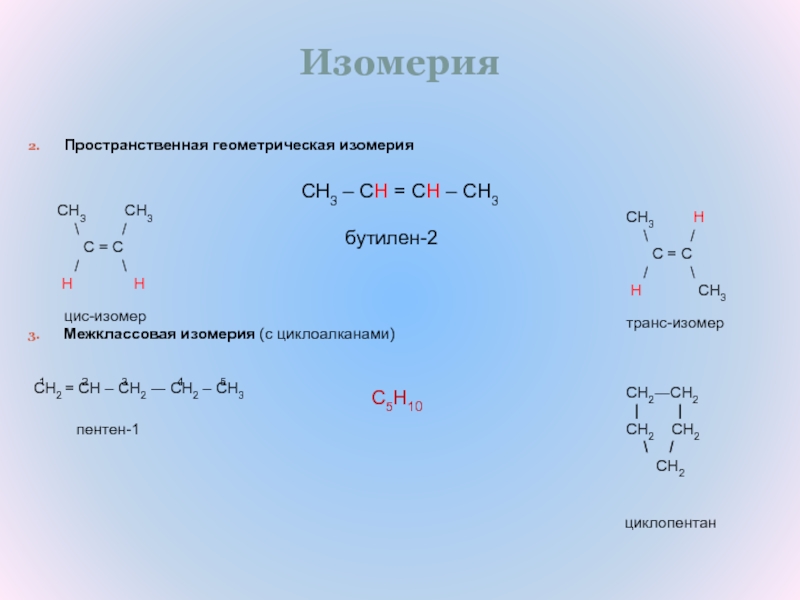
Слайд 4Изомерия
Пространственная геометрическая изомерия
Межклассовая изомерия (с циклоалканами)
CH2 = CH – CH2 ― CH2 – CH3
пентен-1
бутилен-2
CH3 – CH = CH – CH3
транс-изомер
цис-изомер
CH3 CH3
\ /
C = C
/ \
H H
CH3 H
\ /
C = C
/ \
H CH3
1 2 3 4 5
CH2―CH2
| |
CH2 CH2
\ /
CH2
циклопентан
C5H10
Слайд 5Физические свойства
Их температуры плавления
и кипения, также как у алканов , закономерно повышаются при
увеличении молекулярной массы соединения. Алкены с разветвленной углеродной цепью имеют более низкие температуры кипения, чем изомеры с нормальной (неразветвленной) цепью.По принципу «подобное растворяется в подобном» алкены должны быть растворимы в неполярных растворителях и плохо растворимы в полярных. Действительно, они хорошо растворяются в бензоле, тетрахлорометане, петролейном и диэтиловом эфирах, но практически не растворяются в воде.
C2H4 – C4H8
газы
C5H10 – C16H32
жидкости
C17H34 – …
твердые вещества
Слайд 6Химические свойства
H – C = C – H
| |
H H
Реакции присоединения
Реакции окисления
Реакции замещения
Реакции изомеризации
Реакции элиминирования (отщепления)
+
+
-
+
+
Слайд 7
|
|
пропан
CH3 – CH2 – CH3
Реакции присоединения
CH2
– CH – CH3
| |
Br
Br1,2-дибромпропан
CH2 – CH – CH3
–
+
H
H
–
1 2 3
|
|
Br
H
H
пропен
(пропилен)
–
Гидрирование (в присутствии металлических катализаторов –
Pt, Pd, Ni):
Галогенирование
Br
CH2 – CH – CH3
–
пропен
(пропилен)
–
–
Br
Br
+
–
–
Реакция с бромной водой – качественная реакция на алкены
(бромная вода обесцвечивается).
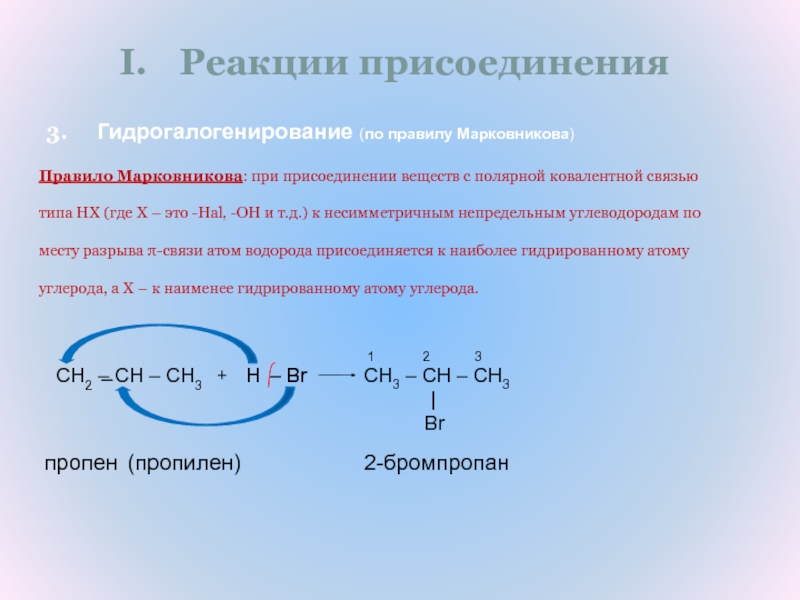
Слайд 8
|
|
Реакции присоединения
CH3 – CH – CH3
|
Br2-бромпропан
1 2 3
H
Гидрогалогенирование (по правилу Марковникова)
Br
CH2 – CH – CH3
–
пропен
(пропилен)
–
–
Br
H
+
–
Правило Марковникова: при присоединении веществ с полярной ковалентной связью
типа HX (где X – это -Hal, -OH и т.д.) к несимметричным непредельным углеводородам по
месту разрыва π-связи атом водорода присоединяется к наиболее гидрированному атому
углерода, а X – к наименее гидрированному атому углерода.
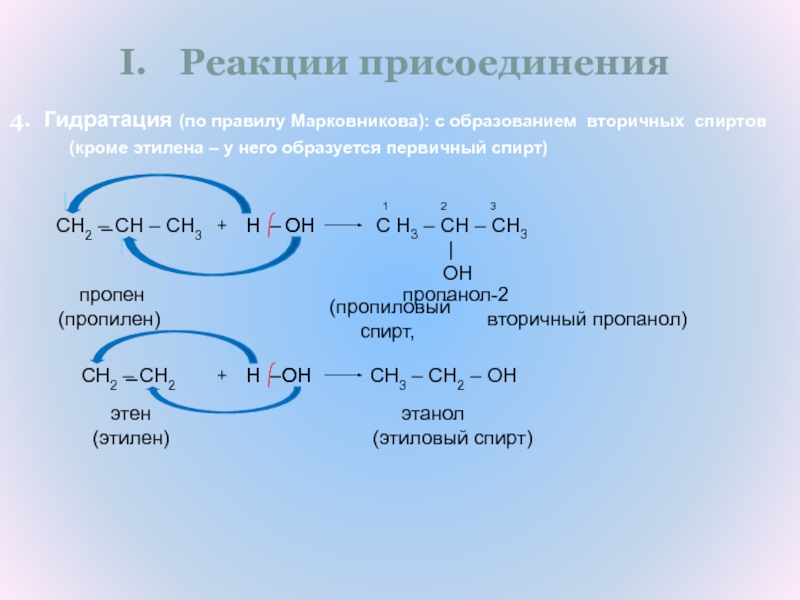
Слайд 9
пропанол-2
Реакции присоединения
CH3 – CH2 – OH
этанол
CH2
– CH – CH3
–
+
H
OH
–
|
|
H
H
OH
пропен
(пропилен)
–
Гидратация (по правилу Марковникова): с
образованием вторичных спиртов (кроме этилена – у него образуется первичный спирт)
OH
CH2 – CH2
–
этен
(этилен)
–
–
OH
H
+
–
–
C H3 – CH – CH3
|
OH
–
(пропиловый спирт,
(этиловый спирт)
1 2 3
вторичный пропанол)
Слайд 10
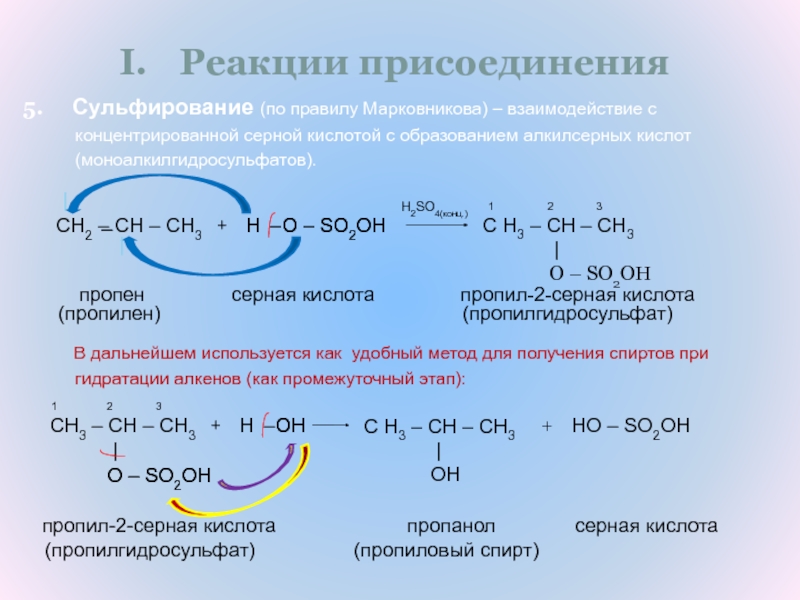
пропил-2-серная кислота
Реакции присоединения
пропанол
CH2 – CH – CH3
–
+
H
O – SO2OH
–
|
|
H
H
O – SO2OH
пропен
(пропилен)
–
Сульфирование (по правилу Марковникова) –
взаимодействие с концентрированной серной кислотой с образованием алкилсерных кислот
OH
–
пропил-2-серная кислота
(пропилгидросульфат)
OH
+
–
C H3 – CH – CH3
|
O – SO2OH
(пропилгидросульфат)
(пропиловый спирт)
1 2 3
(моноалкилгидросульфатов).
серная кислота
H2SO4(конц.)
CH3 – CH – CH3
|
O – SO2OH
+
HO – SO2OH
C H3 – CH – CH3
|
OH
серная кислота
В дальнейшем используется как удобный метод для получения спиртов при
гидратации алкенов (как промежуточный этап):
O – SO2OH
1 2 3
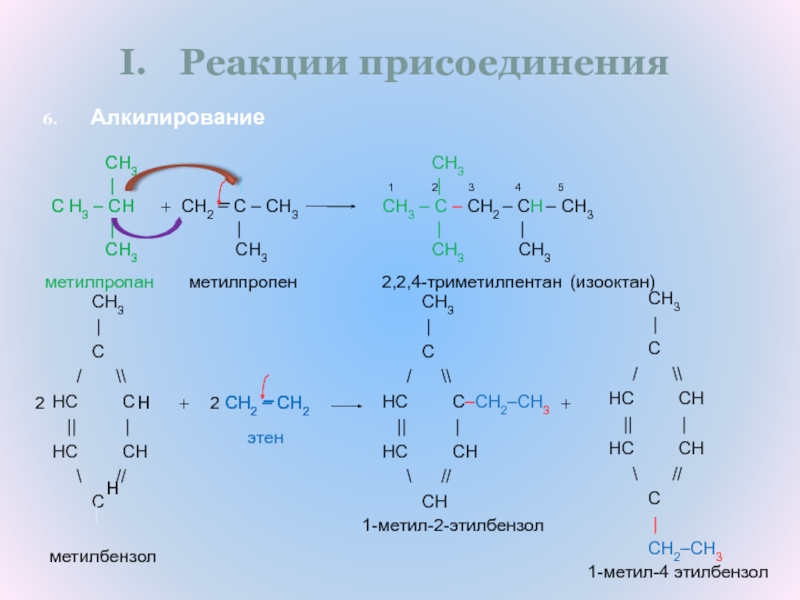
Слайд 11Реакции присоединения
Алкилирование
CH3
|
C H3 – C
|CH3
H
+
CH2 – C – CH3
|
CH3
–
|
–
CH3
|
C H3 – C
|
CH3
CH3
|
CH3 – C – CH2 – CH – CH3
| |
CH3 CH3
метилпропан
метилпропен
2,2,4-триметилпентан
(изооктан)
1 2 3 4 5
H
CH3
|
C
/ \\
HC C
|| |
HC CH
\ //
C
+
CH2 – CH2
CH2 – CH2
H
H
H
H
–
–
|
–
–
–
CH3
|
C
/ \\
HC C–CH2–CH3
|| |
HC CH
\ //
CH
+
CH3
|
C
/ \\
HC CH
|| |
HC CH
\ //
C
|
CH2–CH3
метилбензол
1-метил-2-этилбензол
1-метил-4 этилбензол
CH2 – CH2
этен
2
2
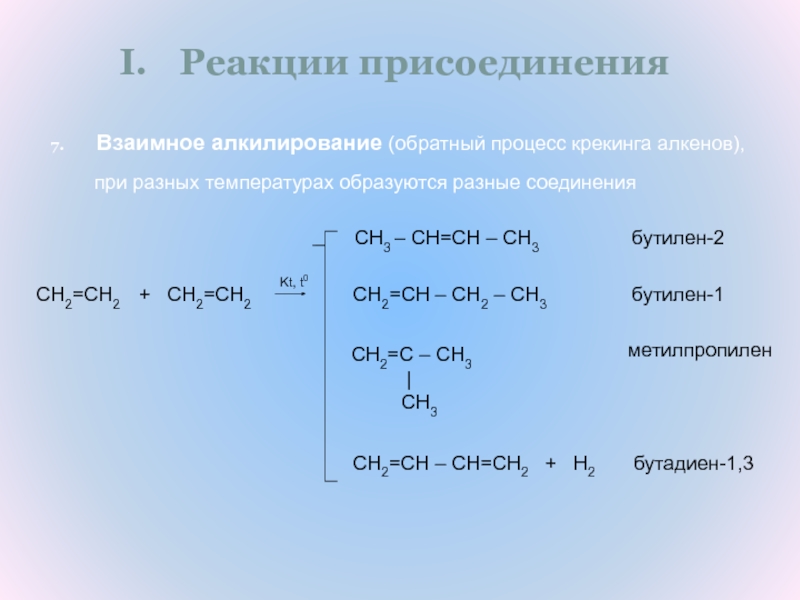
Слайд 12Реакции присоединения
Взаимное алкилирование (обратный процесс крекинга алкенов),
CH2=CH2
+
CH2=CH2
Kt,
t0
CH3 – CH=CH – CH3
бутилен-2
CH2=CH – CH2 – CH3
бутилен-1
CH2=C – CH3
|
CH3
метилпропилен
CH2=CH – CH=CH2
+
H2
бутадиен-1,3
при разных температурах образуются разные соединения
Слайд 13Реакции присоединения
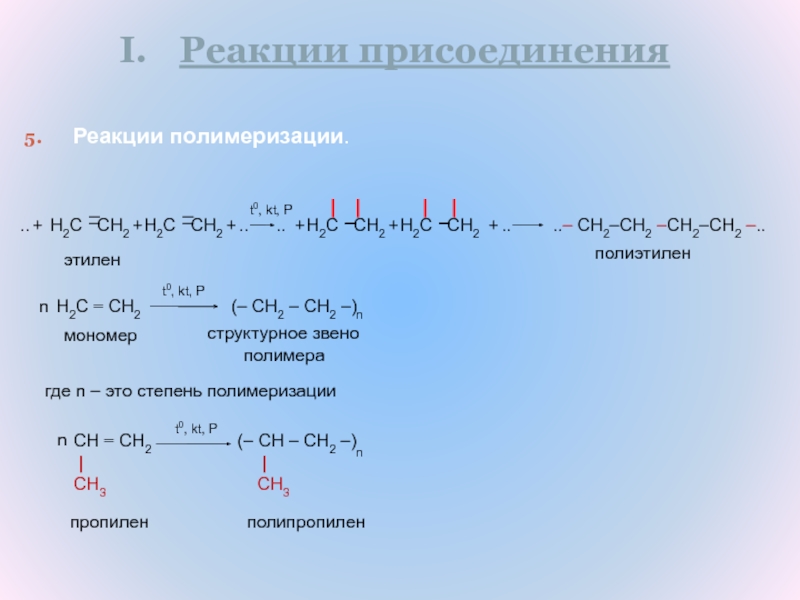
Реакции полимеризации.
..– CH2–CH2 –CH2–CH2 –..
полиэтилен
(– CH2 – CH2 –)
структурное звено
полимера
(– CH – CH2 –)
|
CH3
полипропилен
пропилен
H2C CH2
–
–
..
+
+
H2C CH2
t0, kt, P
+
..
–
–
..
+
H2C CH2
+
H2C CH2
+
..
–
–
|
|
|
|
–
–
–
–
этилен
t0, kt, P
t0, kt, P
H2C = CH2
n
n
мономер
где n – это степень полимеризации
CH = CH2
|
CH3
n
n
–
Слайд 14Реакции окисления
Горение
2 H2O
+
2 CO2 ↑
2 CO ↑
+
2 H2O
2 C
+
2 H2O
Этилен
при смешивании с воздухом образует взрывоопасную смесь.
C2H4 + 3 O2
(избыток) C2H4 + 2 O2 (недостаток)
C2H4 + O2 (сильный недостаток)
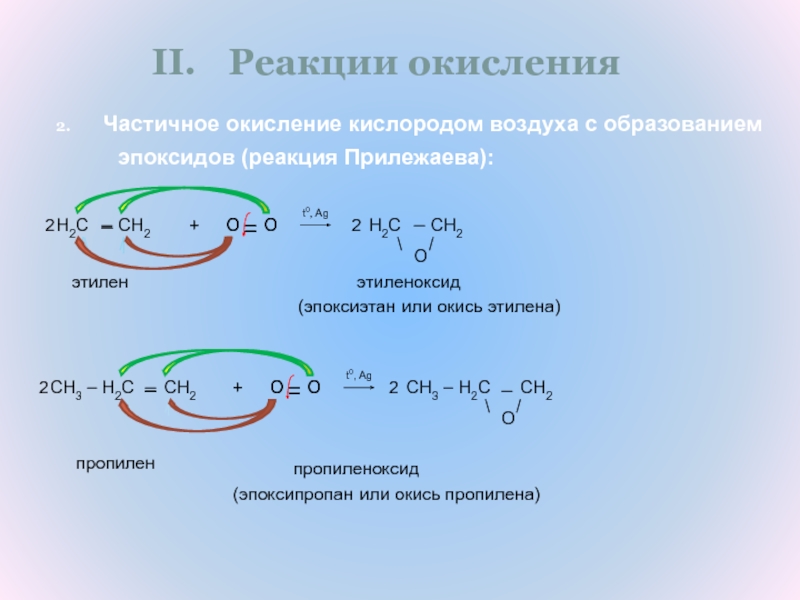
Слайд 15Частичное окисление кислородом воздуха с образованием
H2C CH2
Реакции окисления
\
/
O
2
2
t0, Ag
этиленоксид
(эпоксиэтан
этилен
пропиленоксид
(эпоксипропан
–
–
–
+
–
\
/
|
|
H2C CH2
O
O
O
O
–
–
+
–
–
–
–
–
или окись этилена)
эпоксидов (реакция Прилежаева):
CH3 – H2C CH2
2
2
CH3 – H2C CH2
+
+
t0, Ag
пропилен
или окись пропилена)
–
O
\
/
O
O
O
O
–
–
–
–
–
–
–
–
–
–
|
\
|
/
Слайд 16Реакции окисления
Окисление кислородом окислителя (KMnO4, K2Cr2O7 и др.) в
CH2=CH2
C H2=C H2
+ [O] + H – OH
– CH2 – CH2 –
HO
1 2
OH
из KMnO4
––––––––?
(этандиол-1,2)
этиленгликоль
3
| |
3
-2
2
KOH
––?
H2O
KMn O4
+
4
+
-2
+7
OH OH
C H2 – C H2
-1
-1
+
2
KOH
Mn O2
+
2
+4
3 C2-2
→
C2-1
3
→
3
2
2 Mn+7
–6ē
Mn+4
2
6
+ 6ē
C
-2ē
+ 3ē
-2
-1
+7
+4
2
→
C
2
Mn
Mn
→
качественная реакция на этиленовые углеводороды.
щелочной среде (реакция Вагнера)
Обесцвечивание щелочного раствора KMnO4 без нагревания – это
Слайд 17Реакции окисления
Жесткое окисление кислородом более энергичного окислителя в кислой среде
(кислый раствор KMnO4, HNO3, хромовая смесь) при нагревании
(обесцвечивание раствора KMnO4 – это качественная реакция на непредельные углеводороды ).R – CH=CH – R′ + 4 [O]
CH3 – CH2 – CH=CH – CH3 + 4 [O]
-1
+7
+2
2
R′ - COOH
5 4 3 2 1
+
+
R – COOH
CH3 – CH2 – COOH
этановая кислота
CH3 – COOH
+H3O+, t°
пропановая кислота
+H3O+, t°
пентен-2
H2SO4
4
KMn O4
8
CH3–CH2–C H=C H–CH3
Mn SO4
8
K2SO4
12
?
+
12
H2O
+
+
+
+
5
этановая кислота
CH3–C OOH
5
+
пентен-2
пропановая кислота
5
CH3–CH2–C OOH
+
-1
-40ē
→
8
+ 40ē
Mn
C
10
C
5
→
+3
-1
8
Mn
+2
+7
C
40
8
5
-8ē
→
2
Mn
C
Mn
+5ē
→
2
-1
+3
+7
+2
+3
+3
8
5
Слайд 18Реакции окисления
CH3 – CH2 – CH =CH2
Но метановая (муравьиная) кислота окисляется до угольной кислоты,
HCOOH + [O] ?
CH3 –CH2–CH2–C H=C H2
+
HCOOH
CH3 – CH2 – COOH
+H3O+, t°
бутилен-1
угольная кислота
(муравьиная)
метановая
кислота
пропановая
кислота
CO2↑
+
H2O
?
(т.е. H2CO3)
HOCOOH
метановая кислота
которая распадается на углекислый газ и воду:
4 3 2 1
+ 4 [O]
пентен-1
5 4 3 2 1
H2O
+
4
+
→
?
K2SO4
2
Mn SO4
+
H2SO4
3
+
KMn O4
CH3 –CH2–CH2–C OOH
C O2 ↑
2
+
бутановая кислота
+
+
-1
-2
+2
+7
+3
+4
C+3
-6ē
→
C+4
C-1
-4ē
+10ē
→
Mn+2
2
C-2
2
1
2
Mn+7
→
+ 5ē
Mn
-10ē
10
→
– 6ē
Mn
C
C
– 4ē
→
C
C
-1
+3
-2
+4
+7
+2
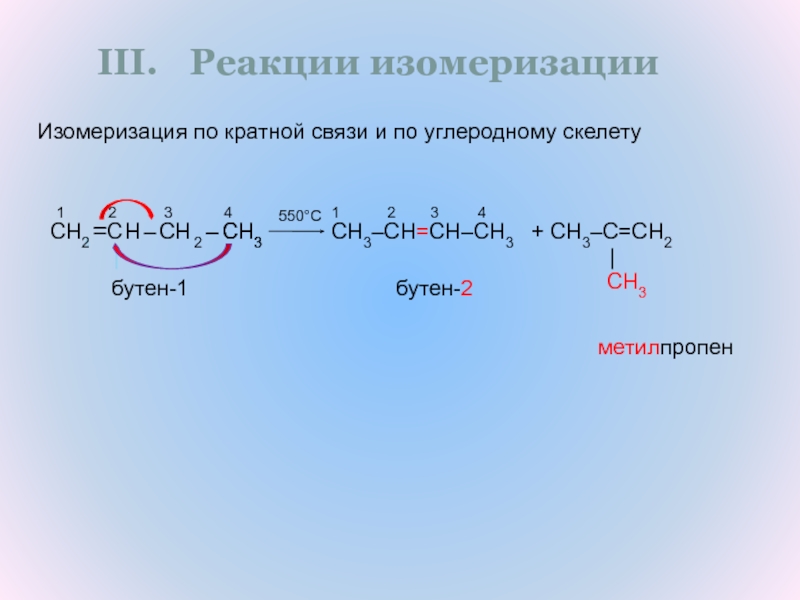
Слайд 19Реакции изомеризации
метилпропен
+
CH3–CH=CH–CH3
CH3–C=CH2
бутен-2
бутен-1
550°C
1 2 3
1 2 3 4
CH C C
H
2
H
CH3
–
|
CH3
–
–
|
3
H
2
–
CH3
4
–
H
–
Изомеризация по кратной связи
и по углеродному скелету
Слайд 20до алкадиенов
CH2 CH C C
Реакции отщепления
(элиминирования)
CH2 = CH – CH = CH2
бутадиен-1,3
бутен-1
MgO, ZnO
H2
+
1200°C
этен
(этилен)
(ацетилен)
H – C ≡ C – H
+
H2
этин
1 2 3 4
1 2 3 4
–
2
–
–
–
–
2
3
|
|
H
H
H
H
H
–
H – C C – H
–
–
–
|
|
H
–
до алкинов
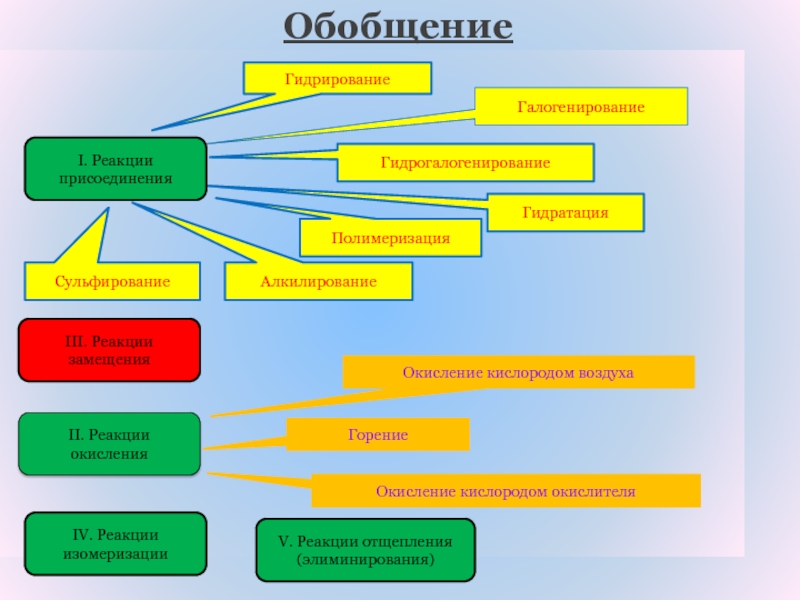
Слайд 21Обобщение
II. Реакции окисления
III. Реакции замещения
IV. Реакции изомеризации
Гидрирование
Галогенирование
Гидрогалогенирование
Гидратация
Полимеризация
Горение
Окисление кислородом воздуха
Окисление
кислородом окислителя
V. Реакции отщепления (элиминирования)
I. Реакции присоединения
Сульфирование
Алкилирование
Слайд 22Крекинг нефтепродуктов
C C C
– CH3
2
Получение алкенов
C16H34
C8H18
+
C8H16
гексадекан
октан
октен
Обычно образуется смесь различных углеводородов: например,
при крекинге бутанаконечными продуктами будет – смесь бутенов, пропилена, этилена и метана; при
крекинге пропана – смесь пропилена, этилена и метана; при крекинге метилпропана –
смесь метилпропилена, пропилена и метана.
Дегидрирование предельных углеводородов
CH2 = CH – CH2 – CH3
CH3 – CH = CH – CH3
бутен-1
бутен-2
1 2 3 4
1 2 3 4
- H2
2CH4
550-650oc, Kt
C2H4
+
H2
2
метан
этилен
H
H
H
H
2
2
–
–
–
–
|
|
|
3
H
H
–
2
бутан
H
–
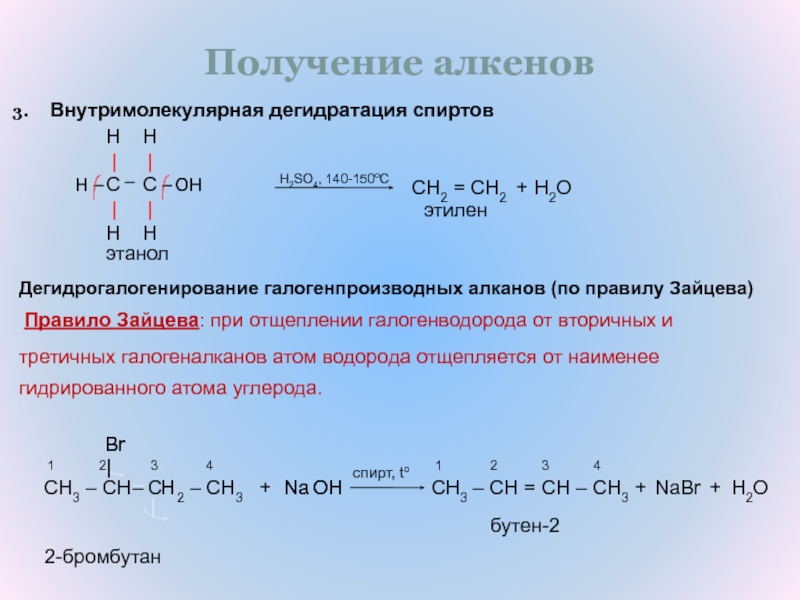
Слайд 23Получение алкенов
Внутримолекулярная дегидратация спиртов
H2SO4, 140-150oC
H2O
+
H H
| |
C C
| |
H H
этанол
этилен
CH2 = CH2
Правило Зайцева: при отщеплении галогенводорода от вторичных и
CH3 – CH = CH – CH3
+
NaBr
H2O
+
+
OH
спирт, to
бутен-2
2-бромбутан
Дегидрогалогенирование галогенпроизводных алканов (по правилу Зайцева)
–
–
–
H
H
OH
OH
–
–
третичных галогеналканов атом водорода отщепляется от наименее
гидрированного атома углерода.
CH3 – CH C – CH3
Na
2
|
|
H
H
Br
OH
Na
–
–
Br
|
1 2 3 4
1 2 3 4
Слайд 24Получение алкенов
Дегалогенирование дигалогенпроизводных алканов
ZnBr2
+
CH3 –
CH = CH – CH3
+
Zn
2.3-дибромбутан
бутен-2
1
2 3 4 1 2 3 4
CH3 – CH CH – CH3
|
|
|
|
–
–
Br
Br
Br
Br
Слайд 29Используемая литература
«Репетитор по химии (издание 15-ое)», под редакцией Егорова А.
С., Феникс – Ростов-на-Дону, 2006
Габриелян О. С., Маскаев Ф. Н.,
Пономарев С. Ю., Теренин В. И. « Химия 10 класс: профильный уровень». (Учебник для общеобразовательных учреждений), Дрофа – Москва, 2005Рудзитис Г. Е., Фельдман Ф. Г. «Химия 10: органическая химия (Учебник для 10 класса средней школы)», Просвещение – Москва, 1991
Перекалин В. В., Зонис С. А. «Органическая химия (учебное пособие для студентов педагогических институтов по химическим и биологическим специальностям)», Просвещение – Москва, 1982
«Органическая химия. Том1 (Основной курс)» под редакцией Н. А. Тюкавкиной (учебник для студентов вузов по специальности «Фармация»), Дрофа – Москва, 2004