Слайд 1Гидролиз солей
Цель урока:
Исследовать реакцию среды растворов солей и
вывести знания о гидролизе солей.
Формировать умения написания уравнений гидролиза
разных типов солей, определять с помощью рН среду растворов.
Совершенствовать практические навыки.
Систематизировать знания о гидролизе солей.
Формировать системное мышление.
Слайд 2Лабораторная работа
Исследуйте реакцию среды в растворах солей: хлорида цинка,
карбоната натрия, хлорида натрия.
Почему среда растворов различная?
Реакция ионного обмена между
водой и растворённым в ней веществом называется гидролизом.
Слайд 3А) Соль, образованная слабым основанием и сильной кислотой.
→ Zn(OH) 2 – слабое основание
ZnCl2 - |
→ HCl – сильная кислота
1) диссоциация соли:
ZnCl2 ↔ Zn 2+ + 2Cl- → эти ионы
остаются
в растворе
2) диссоциация воды:
H2O ↔ OH- + H+
↓
эти ионы соединяются в
катион слабого электролита
Слайд 4Краткое ионное уравнение:
Zn 2+ + H2O ↔ ZnOH+
+ H+
Среда раствора соли кислая, рН < 7,
лакмус красный.
Поскольку « виновником» гидролиза является катион Zn 2+, говорят, что гидролиз идёт по катиону.
Составьте полное ионное уравнение:
Zn2+ + 2Cl- + H2O ↔ ZnOH+ + H+ + 2Cl-
Составьте молекулярное уравнение:
Zn Cl2 + H2O ↔ ZnOHCl + HCl
(основная соль)
Гидроксохлорид
цинка
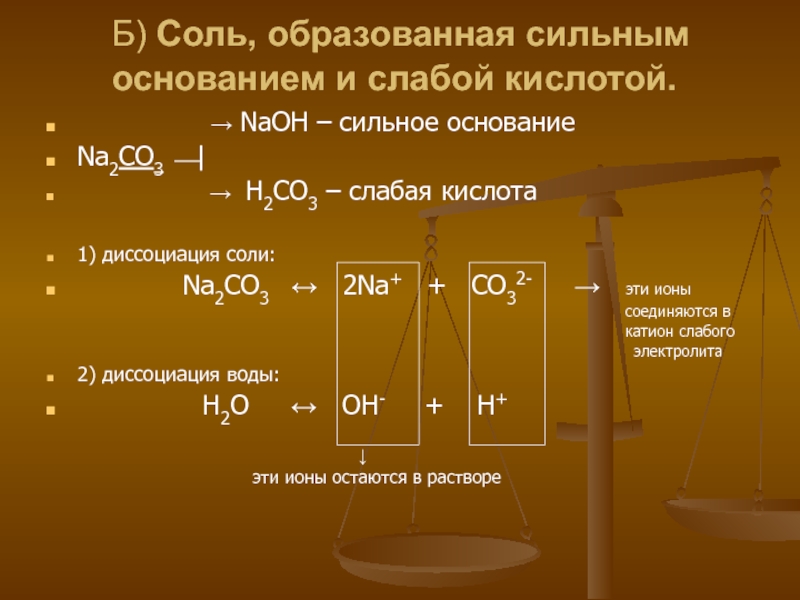
Слайд 5 Б) Соль, образованная сильным основанием и слабой кислотой.
→ NaOH – сильное
основание
Na2CO3 ⎯|
→ H2CO3 – слабая кислота
1) диссоциация соли:
Na2CO3 ↔ 2Na+ + CO32- → эти ионы
соединяются в
катион слабого
электролита
2) диссоциация воды:
H2O ↔ OH- + H+
↓
эти ионы остаются в растворе
Слайд 6Краткое ионное уравнение:
CO32- + H2O ↔
HCO3- + OH-
Среда раствора соли – щелочная,
рН >7,
лакмус синий.
Поскольку «виновником» гидролиза является анион СО32-, говорят гидролиз идёт по аниону.
Составьте полное ионное уравнение:
2Na+ + СО3 2- + Н2О ↔ 2Na+ + HCO3- + ОН-
Составьте молекулярное уравнение:
Na2CO3 + H2O ↔ NaHCO3 + NaOH
Определите тип соли, дайте ей название
Кислая соль, гидрокарбонат натрия.
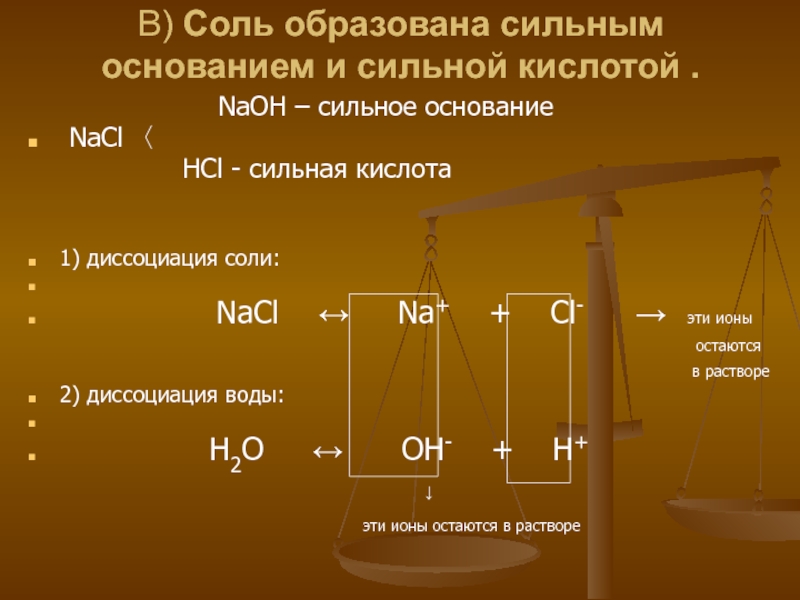
Слайд 7В) Соль образована сильным основанием и сильной кислотой .
NaOH – сильное основание
NaCl 〈
HCl - сильная кислота
1) диссоциация соли:
NaCl ↔ Na+ + Cl- → эти ионы
остаются
в растворе
2) диссоциация воды:
H2O ↔ OH- + H+
↓
эти ионы остаются в растворе
Слайд 8Какие ионы соли при растворении в воде связываются с ионами
воды ?
Ионы соли не образуют с ионами воды слабого электролита,
соль гидролизу не подвергается
Определите среду раствора соли
Среда раствора соли нейтральная,
рН = 7,
лакмус фиолетовый.
Слайд 9Г) Соль , образована слабым основанием и слабой кислотой.
Лабораторный опыт:
Исследуйте среду раствора нитрита аммония.
Почему среда раствора слабокислая?
NH4OH - слабое основание
NH4NO2 〈
HNO2 - слабая кислота
Слайд 10
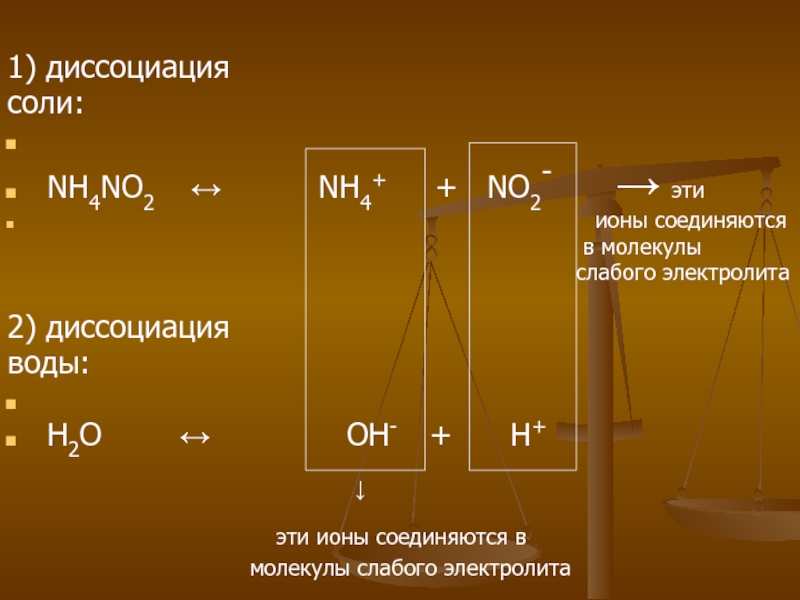
1) диссоциация
соли:
NH4NO2 ↔
NH4+ + NO2- → эти
ионы соединяются
в молекулы
слабого электролита
2) диссоциация
воды:
H2O ↔ OH- + H+
↓
эти ионы соединяются в
молекулы слабого электролита
Слайд 11Какие ионы соли при растворении в воде связываются с ионами
воды ?
Гидролиз идет и по катиону и по аниону одновременно.
Какая будет среда раствора?
Среда растворов солей, образованных слабой кислотой и слабым основанием может быть нейтральной, слабокислой, слабощелочной
(рН=7).
Слайд 12
Составьте краткое ионное, полное ионное уравнение гидролиза NH4NO2
NH4+ + NO2-
+ H2O ↔ NH4OH + HNO2
Составьте молекулярное уравнение гидролиза
NH4NO2 +
H2O ↔ NH4OH + HNO2
Среда раствора NH4NO2 - слабокислая.
рН=7, лакмус розовый.
Слайд 13Гидролиз соли протекает полностью необратимо, если продукты реакции выводятся из
раствора в виде малорастворимого или летучего соединения.
Составьте уравнение гидролиза Al2S3
Al(OH)3 - слабое основание
Al2 S3 〈
H2S - слабая кислота
Al2S3 + 6H2O → 2Al(OH)3 ↓ + 3H2S ↑
Среда раствора – нейтральная,
рН = 7
Лакмус фиолетовый.
Такие соли в водных растворах не существуют.
Слайд 14Найдите в таблице растворимости две такие соли и запишите уравнения
гидролиза этих cолей.
Be(CH3COO)2 + 2H2O → Be(OH)2 ↓ + CH3COOH
Среда раствора нейтральная
рН =7
Лакмус фиолетовый
2 FeCO3 + H2O → (FeOH)2CO3↓ + CO2 ↑
Среда раствора нейтральная
рН =7
Лакмус фиолетовый
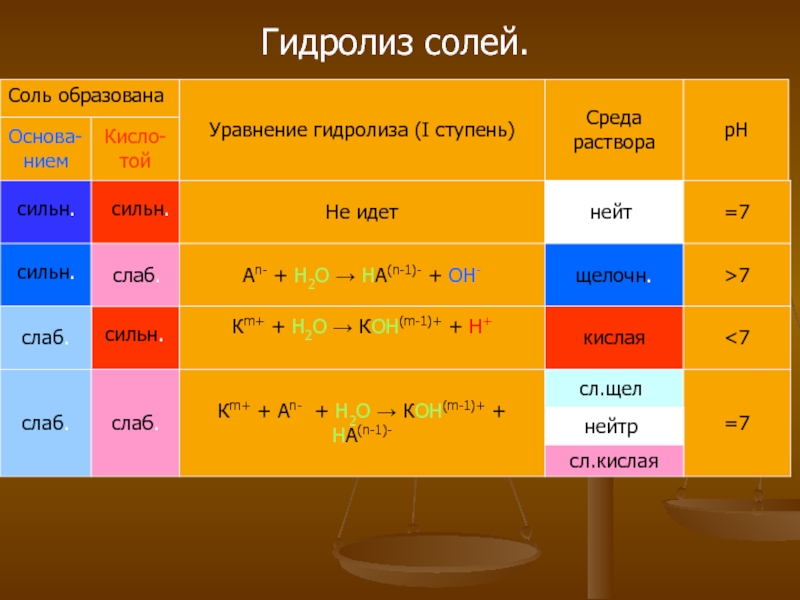
Слайд 15Гидролиз солей.
Уравнение гидролиза (I ступень)
Среда
раствора
рН
Основа-
нием
Кисло-
той
Соль образована
слаб.
слаб.
слаб.
слаб.
Не идет
Аn- + Н2О
→ НА(n-1)- + ОН-
Кm+ + Н2О → КОН(m-1)+ + Н+
Кm+
+ Аn- + Н2О → КОН(m-1)+ + НA(n-1)-
нейт.
щелочн.
кислая
сл.щел.
=7
>7
<7
=7
нейтр.
сл.кислая
сильн.
сильн.
сильн.
сильн.
Слайд 16Самостоятельная работа.
Напишите краткие ионные, полные ионные, молекулярные уравнения реакций гидролиза
растворов солей: сульфида калия, нитрата магния, сульфата цезия, карбоната марганца(II).
Укажите характер среды, рН раствора,
цвет лакмуса.
Слайд 17 KOH → сильное основание
/
а) K2S
\
H2S → слабая кислота
S2- + H2O ↔ HS- + OH- среда щелочная;
рН > 7;
лакмус синий
2K+ + S2- + H2O ↔ 2K+ + HS- + OH-
K2S + H2O ↔ KHS + KOH
гидросульфид
калия
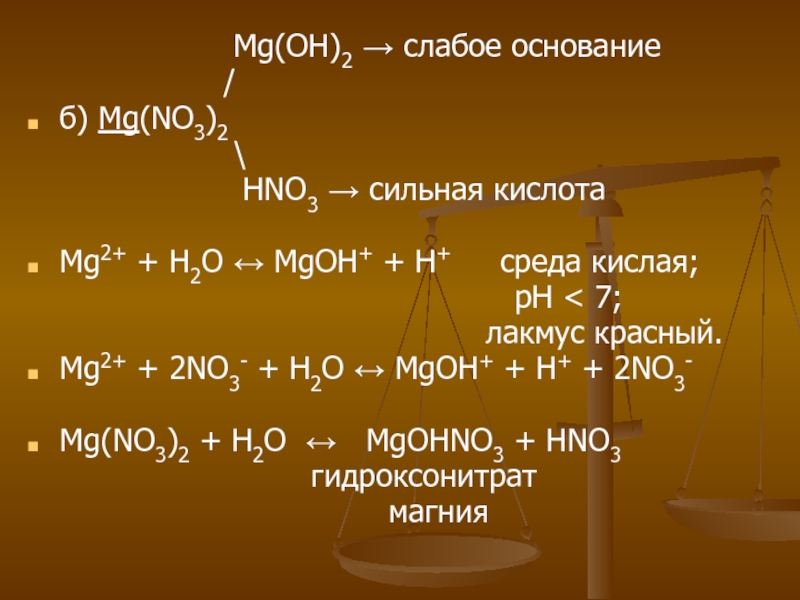
Mg(OH)2 → слабое основание
/
б) Mg(NO3)2
\
HNO3 → сильная кислота
Mg2+ + H2O ↔ MgOH+ + H+ среда кислая;
рН < 7;
лакмус красный.
Mg2+ + 2NO3- + H2O ↔ MgOH+ + H+ + 2NO3-
Mg(NO3)2 + H2O ↔ MgOHNO3 + HNO3
гидроксонитрат
магния
CsOH – сильное основание
/
в) Cs2SO4
\
H2SO4 – сильная кислота
Гидролиз не идёт,
среда нейтральная.
рН = 7; лакмус фиолетовый.
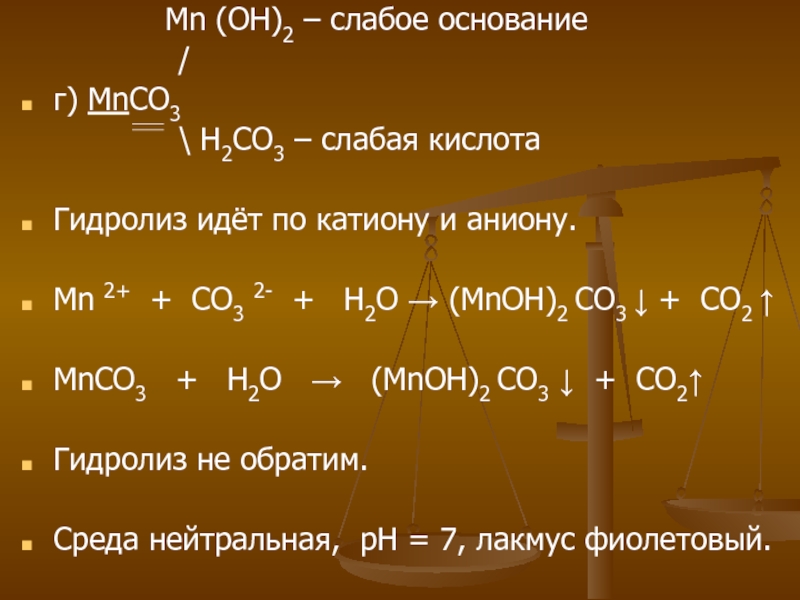
(OH)2 – слабое основание
/
г) MnCO3
\ H2CO3 – слабая кислота
Гидролиз идёт по катиону и аниону.
Mn 2+ + CO3 2- + H2O → (MnOH)2 CO3 ↓ + CO2 ↑
MnCO3 + H2O → (MnOH)2 CO3 ↓ + CO2↑
Гидролиз не обратим.
Среда нейтральная, рН = 7, лакмус фиолетовый.
Слайд 21Литература:
Н. Е. Дерябина «Общая химия», часть II, 2011г.
О.С. Габриелян, Г.Г. Лысова «Химия», 11класс, профильный
уровень, 2010г.