Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Металлы - простые вещества
Содержание
- 1. Металлы - простые вещества
- 2. ОБЩИЕ СВЕДЕНИЯМеталлы — это химические элементы, атомы
- 3. Исключение составляют лишь 6 металлов:
- 4. ПОЛОЖЕНИЕ В ПСХЭ
- 5. Большинство металлов ведут себя только
- 6. СТРОЕНИЕ АТОМОВМе главных подгрупп на внешнем уровне
- 7. КРИСТАЛИЧЕСКАЯ РЕШЕТКА МЕТАЛЛОВКристаллические решетки, в узлах которых
- 8. Некоторые металлы кристаллизуются в двух или более
- 9. Ионная связь так же присутствует
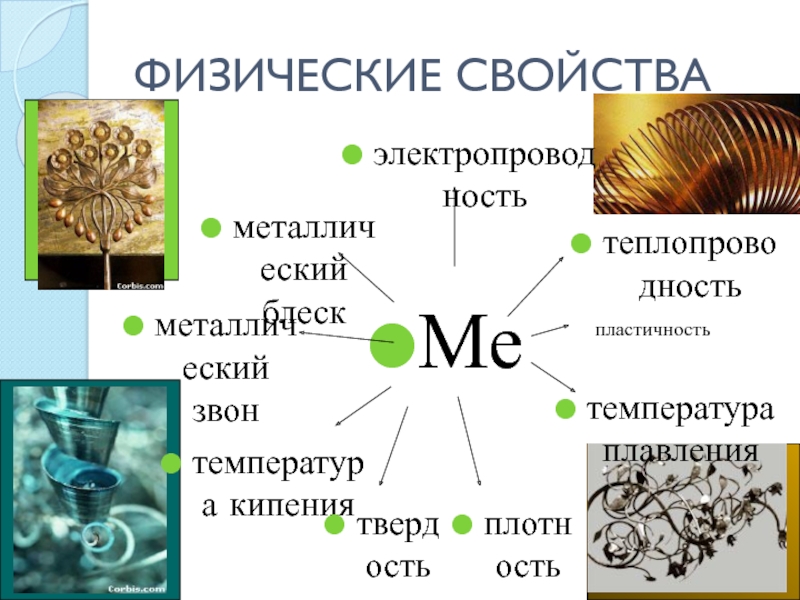
- 10. ФИЗИЧЕСКИЕ СВОЙСТВАпластичность
- 11. Слайд 11
- 12. Механическое воздействие на кристалл с
- 13. Электроны, заполняющие межатомное пространство, отражают
- 14. Теплопроводность металлов обусловлена большой подвижностью свободных
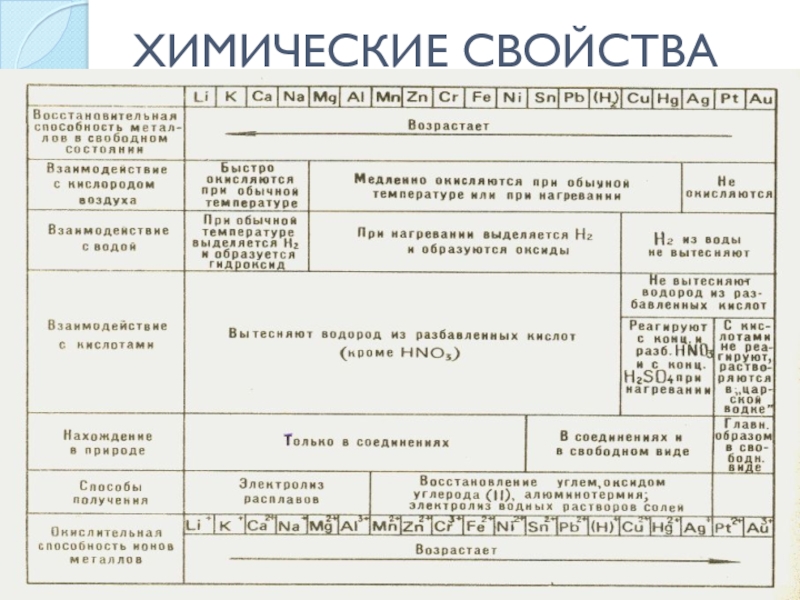
- 15. ХИМИЧЕСКИЕ СВОЙСТВА
- 16. Слайд 16
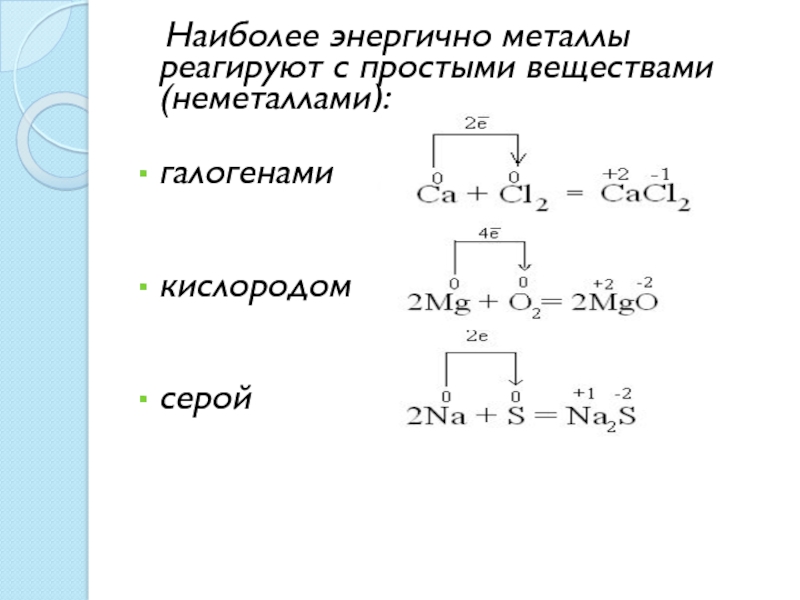
- 17. Наиболее энергично металлы реагируют с простыми веществами (неметаллами):галогенами кислородомсерой
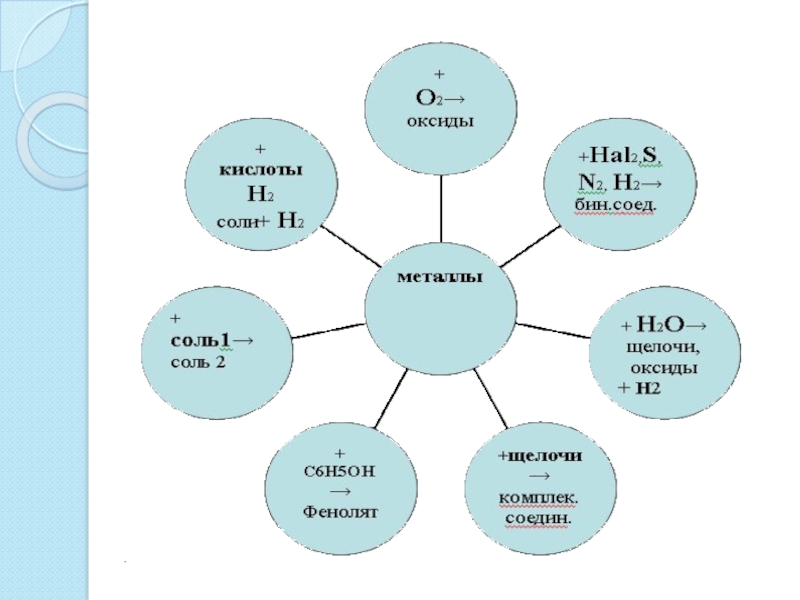
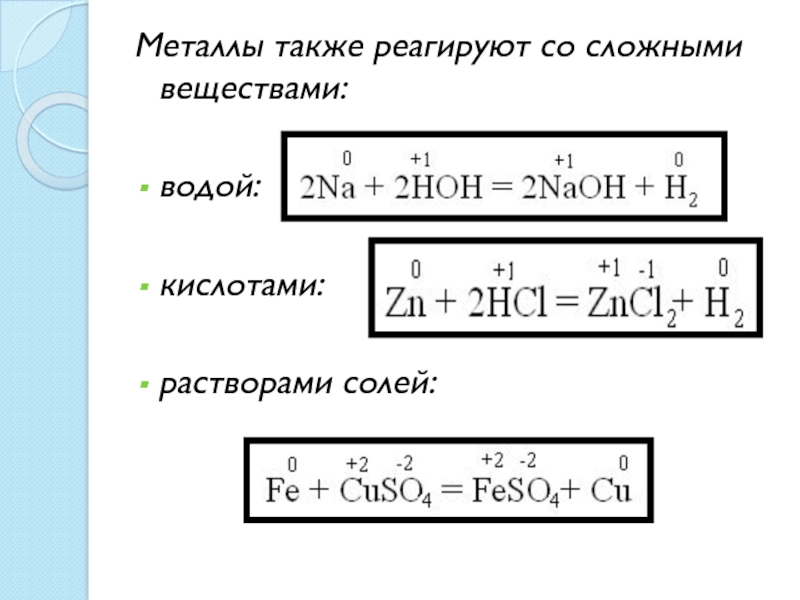
- 18. Металлы также реагируют со сложными веществами:водой:кислотами:растворами солей:
- 19. Металлы, гидроксиды которых амфотерны, как правило взаимодействуют
- 20. Металлы могут образовывать химические соединения
- 21. Металлы в природе, общие способы получения
- 22. Самородок серебраСамородок платинынефелинСамородок золота
- 23. Электролиз расплава соли Восстановление углем, водородом ,алюмотермия ,оксидом углерода (II)
- 24. Наиболее активные металлы получают электролизомNaCl = Na+
- 25. 2. Обжиг сульфидов Ме с последующим восстановлением
- 26. ПРИМЕНЕНИЕ АЛЮМИНИЯ
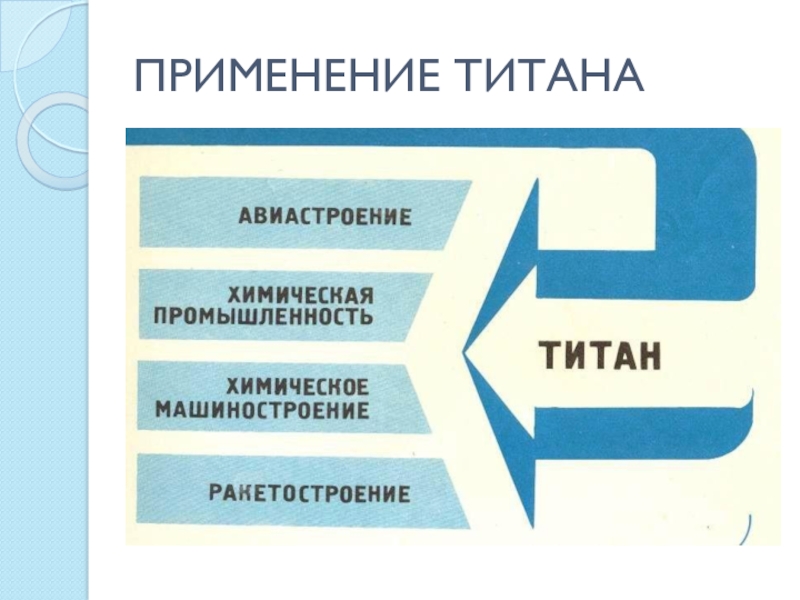
- 27. ПРИМЕНЕНИЕ ТИТАНА
- 28. Слайд 28
- 29. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1МЕТАЛЛЫ В ПРИРОДЕ И ТЕХНИКЕ
Подготовила учитель химии МБОУ СОШ №24
г. Костромы – Карташова Л.А.
Слайд 2ОБЩИЕ СВЕДЕНИЯ
Металлы — это химические элементы, атомы которых отдают электроны
внешнего (а некоторые — и предвнешнего) электронного слоя, превращаясь в
положительные ионы.Это свойство атомов металлов, как вы знаете, определяется тем, что они имеют сравнительно большие радиусы и малое число электронов (в основном от 1 до 3) на внешнем слое.
Слайд 3 Исключение составляют лишь 6 металлов: атомы германия, олова,
свинца на внешнем слое имеют 4 электрона, атомы сурьмы, висмута
-5, атомы полония — 6. Для атомов металлов характерны небольшие значения электроотрицательности (от 0,7 до 1,9) и исключительно восстановительные свойства, то есть способность отдавать электроны.Слайд 5 Большинство металлов ведут себя только как восстановители. Химические
элементы, расположенные вблизи диагонали бор -астат, обладают двойственными свойствами: в
одних своих соединениях ведут себя как металлы, в других — проявляют свойства неметалла.Слайд 6СТРОЕНИЕ АТОМОВ
Ме главных подгрупп на внешнем уровне имеют 1-3 электрона
(4 электрона имеют металлы IV группы).У Ме побочных подгрупп предвнешний
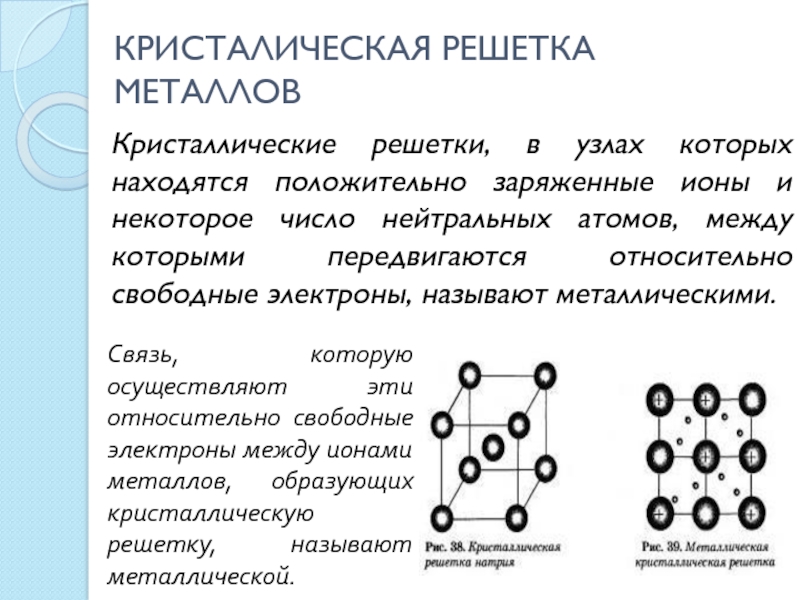
уровень незавершенный, внешний уровень имеет 1-2 электронаСлайд 7КРИСТАЛИЧЕСКАЯ РЕШЕТКА МЕТАЛЛОВ
Кристаллические решетки, в узлах которых находятся положительно заряженные
ионы и некоторое число нейтральных атомов, между которыми передвигаются относительно
свободные электроны, называют металлическими.Связь, которую осуществляют эти относительно свободные электроны между ионами металлов, образующих кристаллическую решетку, называют металлической.
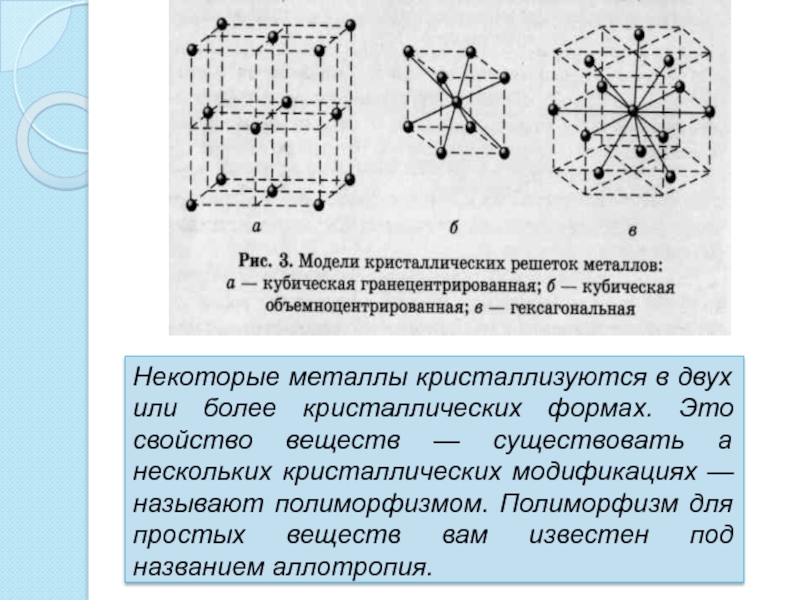
Слайд 8Некоторые металлы кристаллизуются в двух или более кристаллических формах. Это
свойство веществ — существовать а нескольких кристаллических модификациях — называют
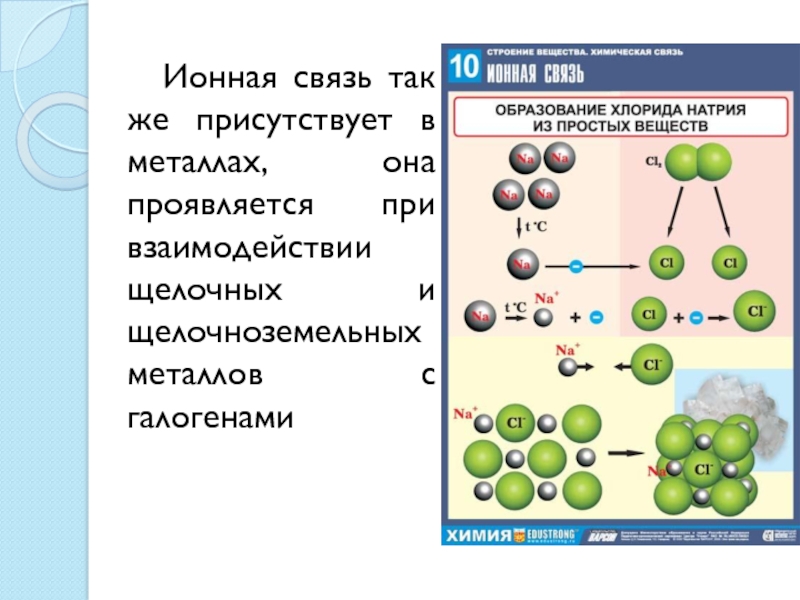
полиморфизмом. Полиморфизм для простых веществ вам известен под названием аллотропия.Слайд 9 Ионная связь так же присутствует в металлах, она
проявляется при взаимодействии щелочных и щелочноземельных металлов с галогенами
Слайд 12 Механическое воздействие на кристалл с металлической кристаллической решеткой
вызывает смещение слоев ион-атомов относительно друг друга, в так как
электроны перемещаются но всему кристаллу, разрыв связей не происходит, поэтому дли металлов характерна большая пластичность. Наиболее пластичные металлы — это Аu,, Cu, Sn, РЪ, ZnСлайд 13 Электроны, заполняющие межатомное пространство, отражают световые лучи (а
не пропускают, как стекло), причем большинство металлов в равной степени
рассеивают все лучи видимой части спектра. Поэтому они имеют серебристо-белый или серый цвет. Стронций, золото и медь в большей степени поглощают короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового спектра, поэтому имеют соответственно светло-желтый, желтый и медный цвета.Слайд 14 Теплопроводность металлов обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с
колеблющимися ионами и атомами, обмениваются с ними энергией. Поэтому происходит
выравнивание температуры по всему куску металла.Слайд 17 Наиболее энергично металлы реагируют с простыми веществами (неметаллами):
галогенами
кислородом
серой
Слайд 19Металлы, гидроксиды которых амфотерны, как правило взаимодействуют с растворами и
кислот, и щелочей.
Гидроксид – смешанный комплекс
[Al(OH)3(H2O)3]
С кислотами
+H+
[Al(H2O)6]3+
Со щелочами
+OH-
[Al(OH)6]3-
[Al(OH)3(H2O)3] + 3HCl
= [Al(H2O)6]Cl3 + 3H2O2[Al(OH)3(H2O)3] + 3Ca(OH)2 = Ca3[Al(OH)6] + 3H2O
Слайд 20 Металлы могут образовывать химические соединения между собой. Они
имеют общее название – интерметаллические соединения или интерметаллиды. Примером могут
служить соединения некоторых металлов с сурьмой: Na2Sb, Ca3Sb, NiSb, Ni4Sb, FeSbx (х = 0,72 – 0,92). В них чаще всего не соблюдаются степени окисления, характерные в соединениях с неметаллами.Слайд 21Металлы в природе, общие способы получения
Самым распространенным Ме
в земной коре является алюминий. За ним следует железо, натрий,
калий, магний и титан. Содержание остальных металлов незначительно. Так, например, хрома в земной коре по массе всего лишь 0,3%, никеля – 0,2%, а меди – 0,01%. Ме встречаются в природе как в свободном виде, так и в различных соединенияхбоксит
гематит
магнетит
Слайд 23Электролиз расплава соли
Восстановление углем, водородом ,
алюмотермия ,оксидом углерода (II)
Слайд 24Наиболее активные металлы получают электролизом
NaCl = Na+ + Cl-
Электролиз расплава
A(+):
2Cl- - 2e = Cl2
К(-): Na+ + 1e = Na0
2NaCl
= 2Na + Cl2Электролиз раствора
A(+): Cl-, H2O
2H2O – 4e = 4H+ + O2
К(-): Na+, H2O
2H2O + 2e = 2OH- + H2
2H2O = 2H2 + O2
Слайд 252. Обжиг сульфидов Ме с последующим восстановлением образовавшихся оксидов:
3. Восстановление
Ме из их оксидов более активными Ме:
1. Восстановление Ме из
их оксидов углем или оксидом углерода (II): Менее активные Ме восстанавливают из их оксидов










![Металлы - простые вещества Металлы, гидроксиды которых амфотерны, как правило взаимодействуют с растворами и кислот, Металлы, гидроксиды которых амфотерны, как правило взаимодействуют с растворами и кислот, и щелочей.Гидроксид – смешанный комплекс[Al(OH)3(H2O)3]С кислотами+H+[Al(H2O)6]3+Со](/img/thumbs/b374f34814e6581a93764fdb4bc47669-800x.jpg)