Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электролитическая диссоциация 8 класс
Содержание
- 1. Электролитическая диссоциация 8 класс
- 2. Сванте-Август АррениусАвтор теории электролитической диссоциации. Лауреат Нобелевской
- 3. В чём причина возникновения электрического тока? ??
- 4. Причина возникновения электрического токанаправленное движение электроновобразование заряженных частиц в растворе или расплаве электролита
- 5. Все ли вещества проводят электрический ток?электролитывсе растворимые
- 6. Все ли вещества проводят электрический ток?электролитыNaCl (раствор)NaOH(раствор)Н2SO4 (раствор)СuSO4 (раствор)CH3COOH (раствор; столовый уксус 9%)неэлектролитыН2О (прот.)сахар (раствор)Н2О (дист.)NaCl (крист.)сахар (крист.)C2H5OH (этиловый спирт)
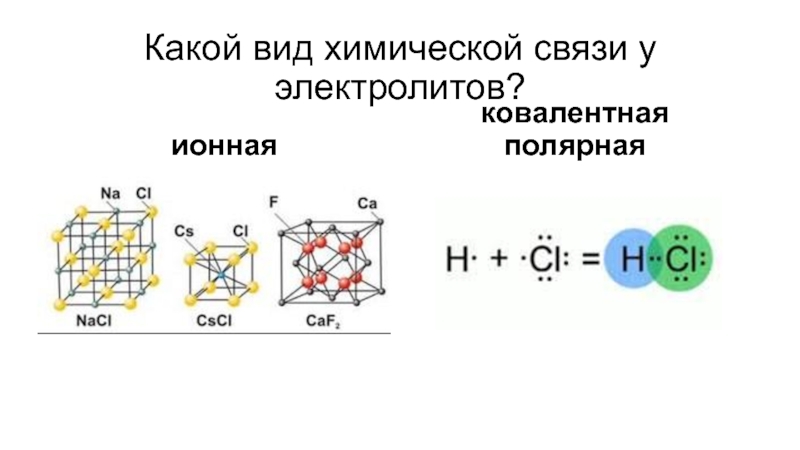
- 7. Какой вид химической связи у электролитов?ионнаяковалентная полярная
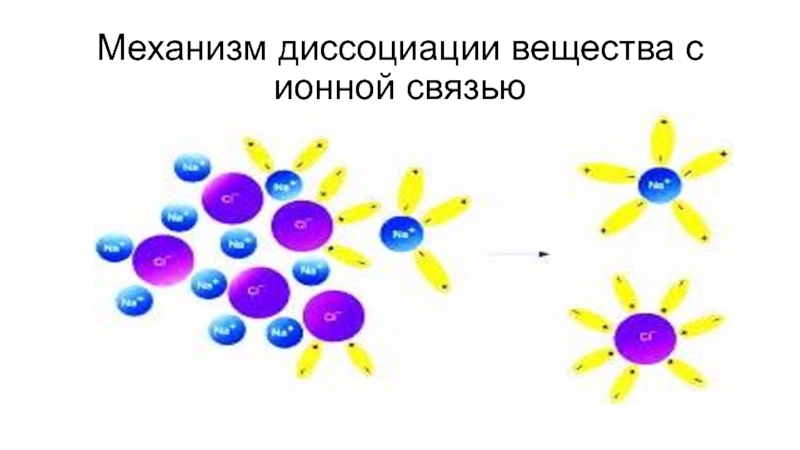
- 8. Механизм диссоциации вещества с ионной связью
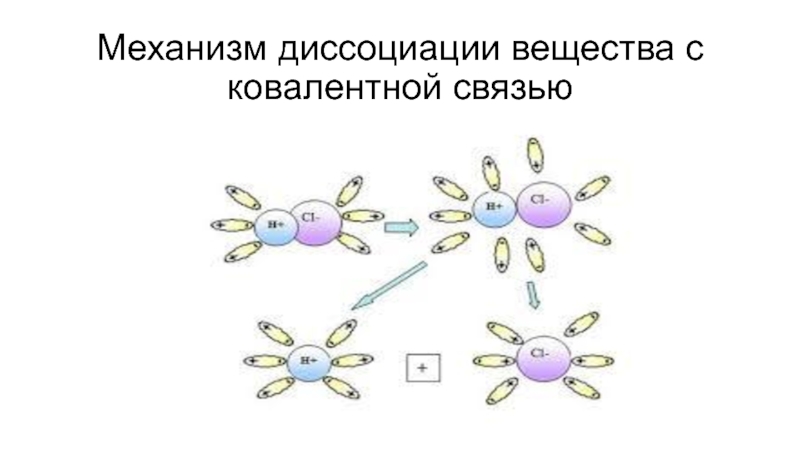
- 9. Механизм диссоциации вещества с ковалентной связью
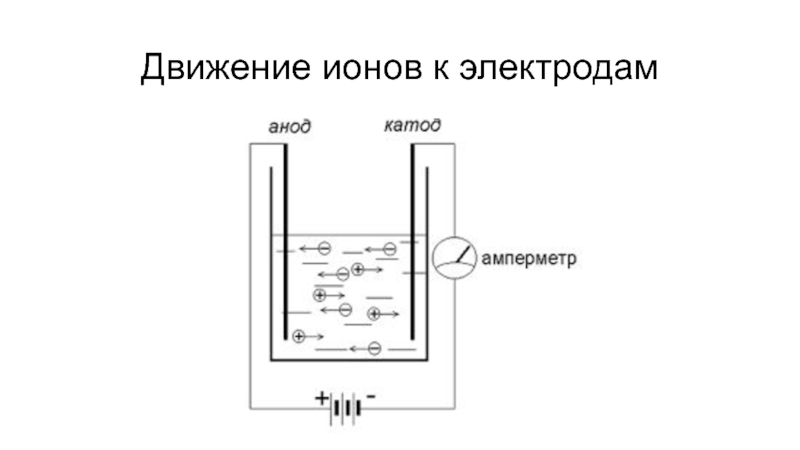
- 10. Движение ионов к электродам
- 11. Запомни!Для двух ребят подарков грузИон взвалил себе
- 12. Электролитическая диссоциация- процесс распада электролита на ионы при растворении или расплавлении
- 13. Степень диссоциации -это отношение числа частиц,
- 14. В зависимости от степени диссоциации электролиты делят
- 15. Запишите уравнение диссоциацииДопишите уравнения диссоциацииNaCl = HCl=NaOH=CuSO4 =H2 SO4 =FeCl3 =Допишите возможные реакцииAl2(SO4)3 =Ba(OH)2=H2SiO3=BaSO4=H2S=Fe(OH)2 =
- 16. что мы сегодня узнали?
- 17. Запишите домашнее задание и выберите смайликРаспределите вещества
- 18. Скачать презентанцию
Сванте-Август АррениусАвтор теории электролитической диссоциации. Лауреат Нобелевской премииРодился 19 февраля 1859 года в старинном шведском городе Упсале. В гимназии он был одним из лучших учеников, особенно легко ему давалось изучение физики
Слайды и текст этой презентации
Слайд 2Сванте-Август Аррениус
Автор теории электролитической диссоциации. Лауреат Нобелевской премии
Родился 19 февраля
1859 года в старинном шведском городе Упсале.
В гимназии он
был одним из лучших учеников, особенно легко ему давалось изучение физики и математики.
В 1876 году юноша был принят в Упсальский университет. И уже через два года (на шесть месяцев раньше срока) он сдал экзамен на степень кандидата философии. Слайд 4Причина возникновения электрического тока
направленное движение электронов
образование заряженных частиц в растворе
или расплаве электролита
Слайд 5Все ли вещества проводят электрический ток?
электролиты
все растворимые соли
щёлочи
растворимые кислоты
неэлектролиты
нерастворимые соли,
кислоты,
основания
оксиды
вещества с ковалентной неполярной связью (газы)
большинство органических веществ
Слайд 6Все ли вещества проводят электрический ток?
электролиты
NaCl (раствор)
NaOH(раствор)
Н2SO4 (раствор)
СuSO4 (раствор)
CH3COOH (раствор; столовый уксус 9%)
неэлектролиты
Н2О (прот.)
сахар
(раствор)
Н2О (дист.)
NaCl (крист.)
сахар (крист.)
C2H5OH (этиловый спирт)
Слайд 11Запомни!
Для двух ребят подарков груз
Ион взвалил себе на спину.
Для Кати
он несёт свой плюс,
для Ани он несёт свой минус
ион
Слайд 12Электролитическая диссоциация
- процесс распада электролита на ионы при растворении или
расплавлении
Слайд 13Степень диссоциации
-это отношение числа частиц, распавшихся на ионы (N
д), к общему числу растворенных частиц (NP):
α=N д/NP
Слайд 14В зависимости от степени диссоциации электролиты делят на
сильные электролиты
1.Практически все
соли;
2.Сильные кислоты(HCl, HNO3,H2SO4и др.);
3.Все щелочи (KOH, NaOH,
Ca(OH)2 и др.)
слабые электролиты
1.H2O
2.Слабые кислоты (H2S, HNO2,
H2CO3 и др.);3.Водный раствор аммиака
NH3*H2O
Слайд 15Запишите уравнение диссоциации
Допишите уравнения диссоциации
NaCl =
HCl=
NaOH=
CuSO4 =
H2 SO4 =
FeCl3
=
Допишите возможные реакции
Al2(SO4)3 =
Ba(OH)2=
H2SiO3=
BaSO4=
H2S=
Fe(OH)2 =
Слайд 16
что мы сегодня узнали?
1. Какие вещества называются электролитами?
Приведите примеры.
2. Почему эти вещества проводят электрический ток?
3. Какие вещества
называются неэлектролитами? Приведите примеры.4. Что понимают под электролитической диссоциацией?
5. Что показывает степень диссоциации?
6. Как классифицируют электролиты по степени диссоциации?
Слайд 17Запишите домашнее задание и выберите смайлик
Распределите вещества в 2 столбика
(I- электролиты, II-неэлектролиты)
Жидкий аммиак, раствор хлорида кальция, серная
кислота, нитрат калия, гидроксид калия, ацетон, фосфат кальция, бензол, раствор сахара, азотная кислота, карбонат кальция, иодоводородСпасибо, ребята за урок !