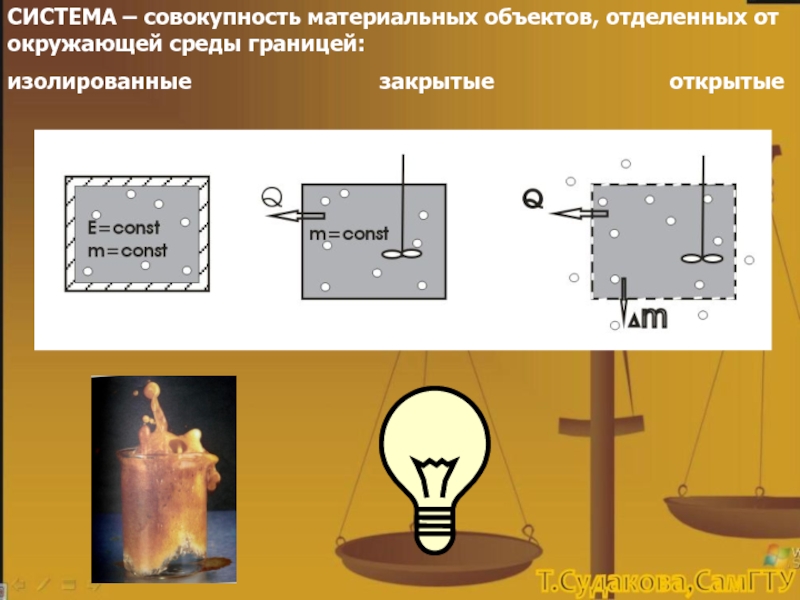
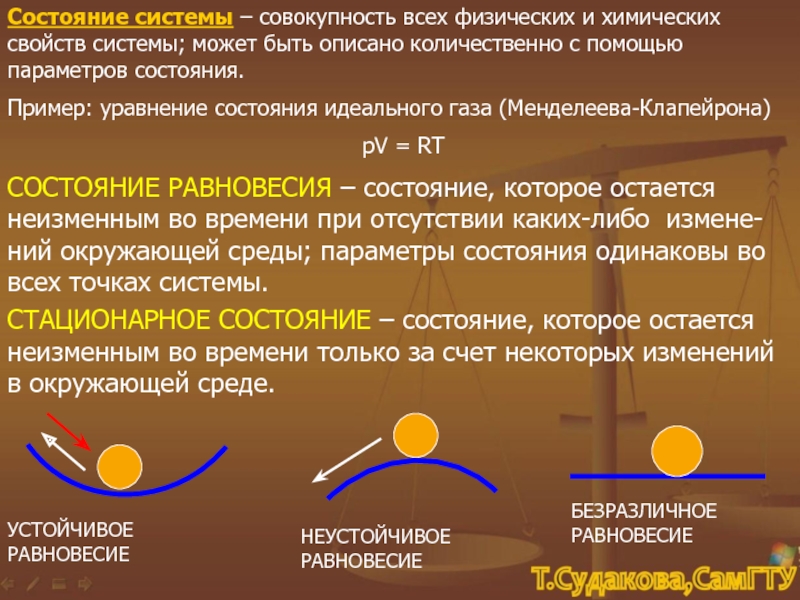
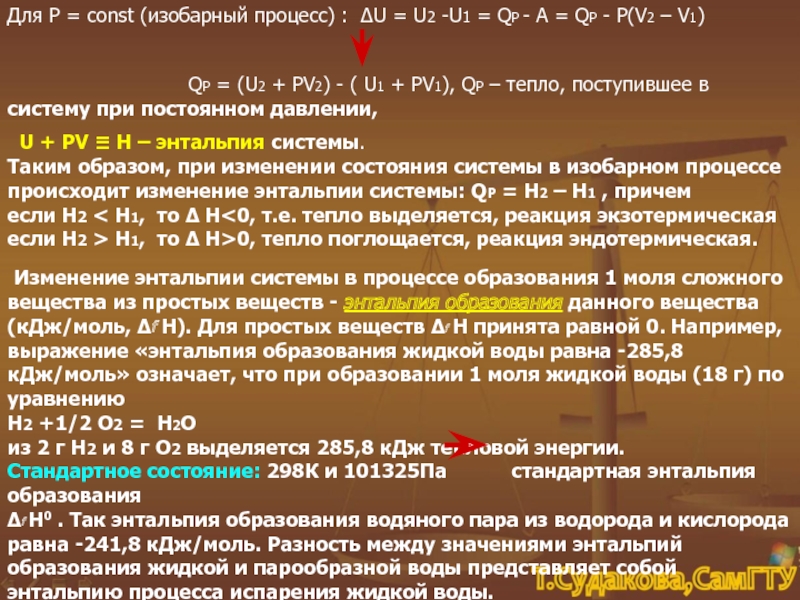
-U1 = QP - А = QР - Р(V2 –
V1)
QP = (U2 + РV2) - ( U1 + РV1), QP – тепло, поступившее в систему при постоянном давлении,
U + РV ≡ Н – энтальпия системы.
Таким образом, при изменении состояния системы в изобарном процессе происходит изменение энтальпии системы: QP = Н2 – Н1 , причем
если Н2 < Н1, то Δ Н<0, т.е. тепло выделяется, реакция экзотермическая
если Н2 > Н1, то Δ Н>0, тепло поглощается, реакция эндотермическая.
Изменение энтальпии системы в процессе образования 1 моля сложного вещества из простых веществ - энтальпия образования данного вещества (кДж/моль, Δf Н). Для простых веществ Δf Н принята равной 0. Например, выражение «энтальпия образования жидкой воды равна -285,8 кДж/моль» означает, что при образовании 1 моля жидкой воды (18 г) по уравнению
Н2 +1/2 О2 = Н2О
из 2 г Н2 и 8 г О2 выделяется 285,8 кДж тепловой энергии.
Стандартное состояние: 298К и 101325Па стандартная энтальпия образования
Δf Н0 . Так энтальпия образования водяного пара из водорода и кислорода равна -241,8 кДж/моль. Разность между значениями энтальпий образования жидкой и парообразной воды представляет собой энтальпию процесса испарения жидкой воды.