Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Пептиды и белки
Содержание
- 1. Пептиды и белки
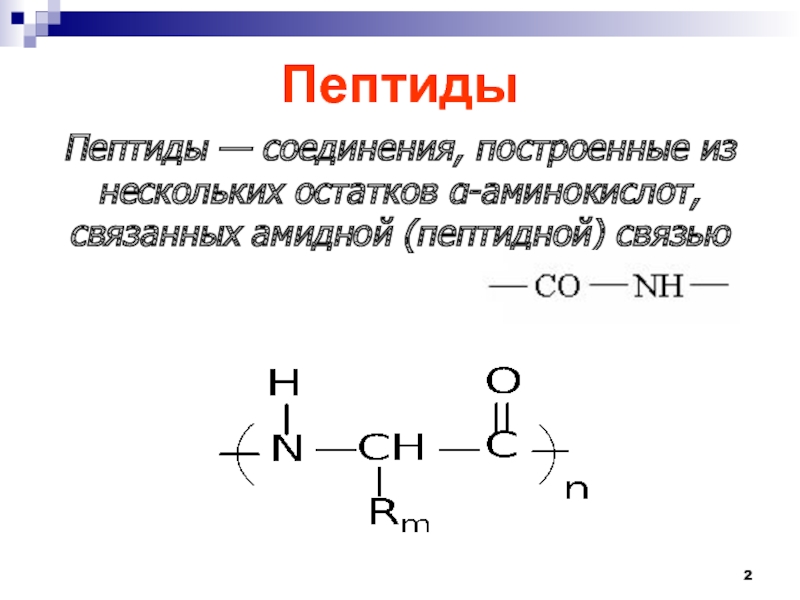
- 2. ПептидыПептиды — соединения, построенные из нескольких остатков -аминокислот, связанных амидной (пептидной) связью
- 3. (греч. Πεπτος, peptós
- 4. Слайд 4
- 5. Пептиды, названияNGF
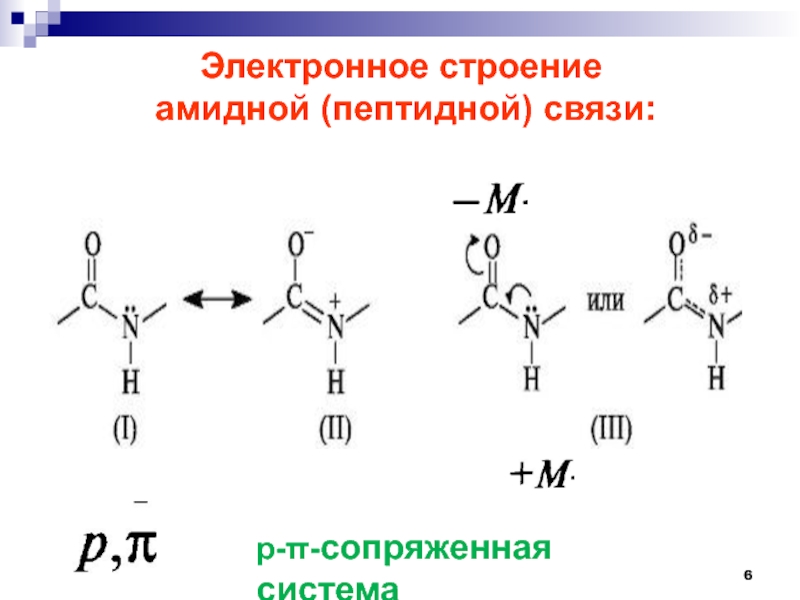
- 6. Электронное строение амидной (пептидной) связи: р--сопряженная система
- 7. ЭЛЕКТРОННОЕ И ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПЕПТИДНОЙ СВЯЗИ.р--сопряженная системабарьер
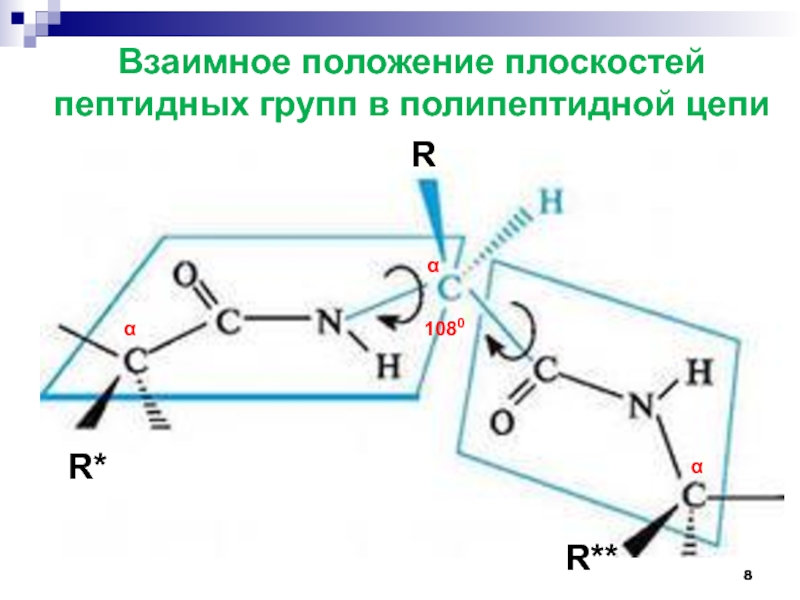
- 8. Взаимное положение плоскостей пептидных групп в полипептидной цепиαααRR*R**1080
- 9. Основные функции пептидов:регуляторная (рилизинг-факторы или либерины, нейромедиаторы);гормональная
- 10. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ ПЕПТИДОВ
- 11. Выполняет функцию протектора белков
- 12. ТафтсинСеланк — (Thr-Lys-Pro-Arg-Pro-Gly-Pro, лекарственный препарат, обладающий наиболее выраженной анксиолитической активностью (противотревожным действием).
- 13. Селанк – первый в мире пептидный анксиолитик
- 14. Нейропептиды (опиатные пептиды). пептиды, содержащиеся в головном
- 15. Вазопрессин (от лат. vas – cocyд и
- 16. Окситоцин (1954) вызывает сокращение гладких мышц матки
- 17. Даларгин - синтетический аналог энкефалинов,биологически активных
- 18. Применяется Даларгин при обострении язвенной болезни желудка
- 19. Слайд 19
- 20. Пептид АКТГ4-10 («Семакс») обладает нейроспецифическим эффектом в
- 21. Слайд 21
- 22. Цепь А содержит 21, а цепь Б
- 23. шесть молекул инсулина ассоциированы в гексамер (видны
- 24. Слайд 24
- 25. при стрессе и заболеваниях нервной системы; при
- 26. Принципиальная схема синтеза пептида
- 27. ИСКУССТВЕННЫЙ СИНТЕЗ ПЕПТИДОВСхема синтеза дипептида аланил-валина:Первый
- 28. II. Активация группы –СООНэтилхлорформиатZ Ala OH Z Ala OC(O)OC2H5 1N NaoHсмешанный ангидрид
- 29. Второй компонент – С-концевая аминокислота валинIII. Защита группы –СООНVal Val OEt 1 экв.1N NaOH
- 30. IV. Образование амидной связиZ Ala OC(O)OC2H5O Val OEt Z Ala Val OEt
- 31. Z Ala Val OEtZAla Val OH H Ala Val OH
- 32. Схема твердофазного синтеза полипептидов:
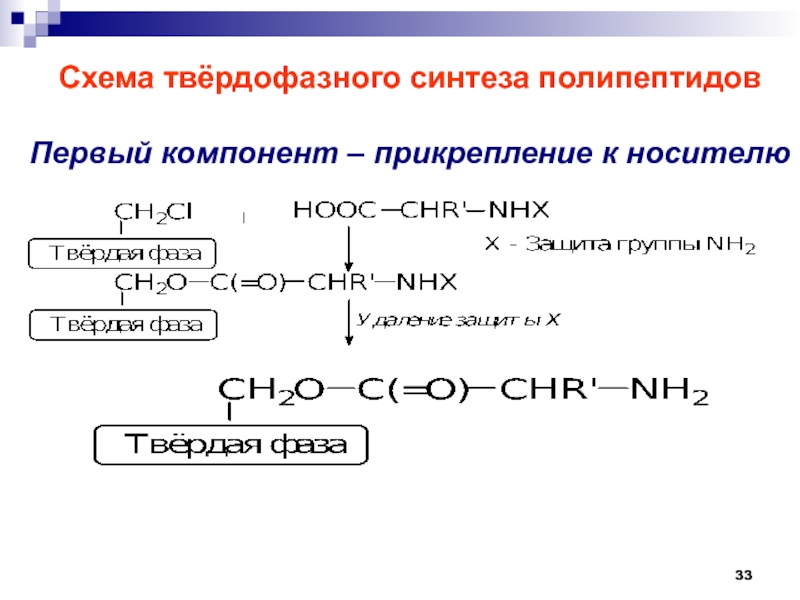
- 33. Схема твёрдофазного синтеза полипептидовПервый компонент – прикрепление к носителю
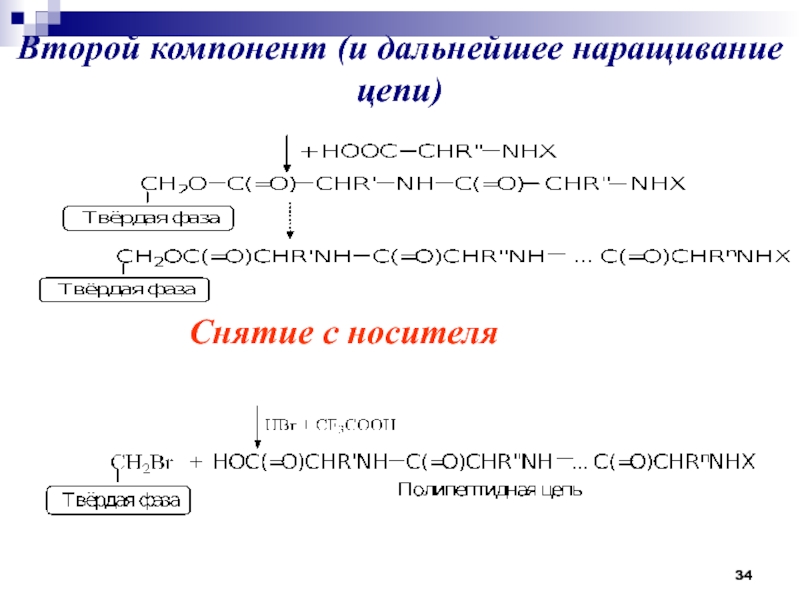
- 34. Второй компонент (и дальнейшее наращивание цепи)Снятие с носителя
- 35. Слайд 35
- 36. Строительная (пластическая) – белки участвуют в образовании
- 37. Степень организации белковых молекул
- 38. Первичная структура пептидов и белков.Аминокислотный состав пептидов
- 39. Белки в медицине.Серповидноклеточная анемия – наследственная болезнь,
- 40. Вторичная структура белков Вторичная
- 41. Лайнус Карл
- 42. a-спираль молекулы белка
- 43. Водородные связиостаток АК образует водородную связь с
- 44. -Структура (анти) параллельный -складчатый слой (лист)«меха аккордеона»Межцепочечные Н-связи
- 45. Слайд 45
- 46. b-структура белка
- 47. Вторичная структура белков А
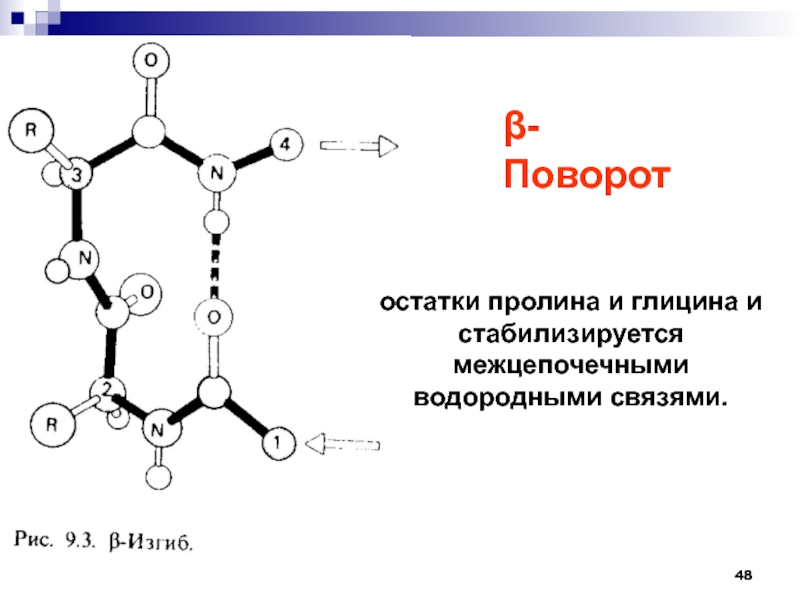
- 48. остатки пролина и глицина и стабилизируется межцепочечными водородными связями.-Поворот
- 49. Домены – глобулярные области в пределах одной
- 50. Полипептидная цепь, включающая элементы той или иной
- 51. молекула приобретает форму компактного клубка – глобулярные
- 52. Слайд 52
- 53. Глобулярные белкиГЛОБУЛЯРНАЯ СТРУКТУРА АЛЬБУМИНА (белок
- 54. РАЗЛИЧНЫЕ ВАРИАНТЫ ИЗОБРАЖЕНИЯ третичной СТРУКТУРЫ
- 55. Фибриллярные белкиФИБРИЛЛЯРНЫЙ БЕЛОК ФИБРОИН
- 56. НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА ФИБРИЛЛЯРНОГО БЕЛКА КОЛЛАГЕНА.
- 57. Молекула коллагена представляет собой правозакрученную спираль из
- 58. от греч. lýsis — растворение, распад и
- 59. Сериновая протеаза - трипсинРодопсинфермент класса гидролаз, катализирующий
- 60. ацилтрансфераза
- 61. У бактерий имеются трансмембранные каналообразующие белки, так
- 62. Этот белок может существовать в двух конформациях
- 63. Губчатые энцефалопатии* Синдром Крейцфельда-Якоба * синдром Герсманна–Штройслера–Шейнкера
- 64. Проявляется болезнь медленно прогрессирующими нарушениями памяти и
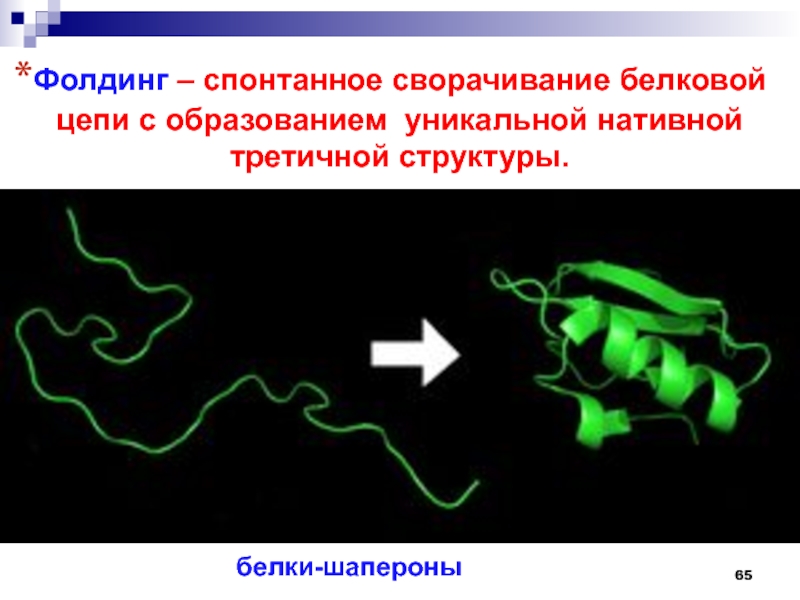
- 65. Фолдинг – спонтанное сворачивание белковой цепи с образованием уникальной нативной третичной структуры.белки-шапероны
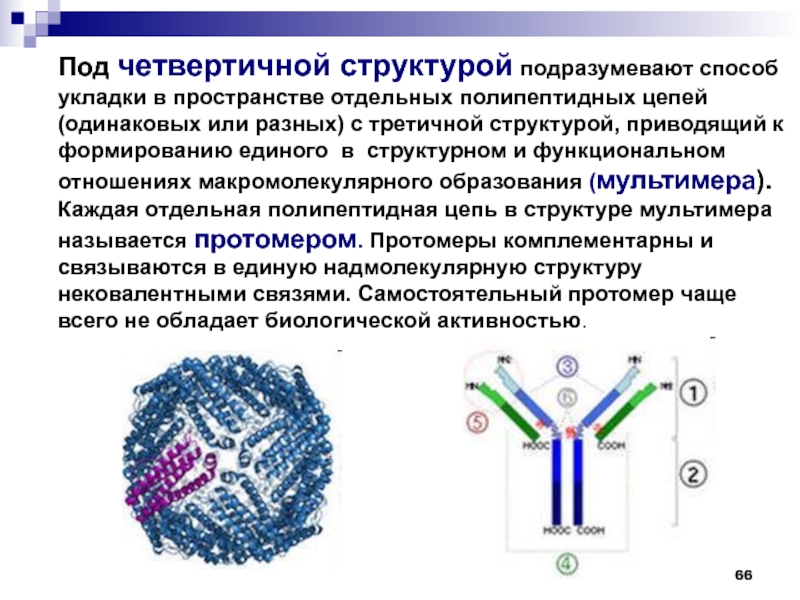
- 66. Под четвертичной структурой подразумевают способ укладки в
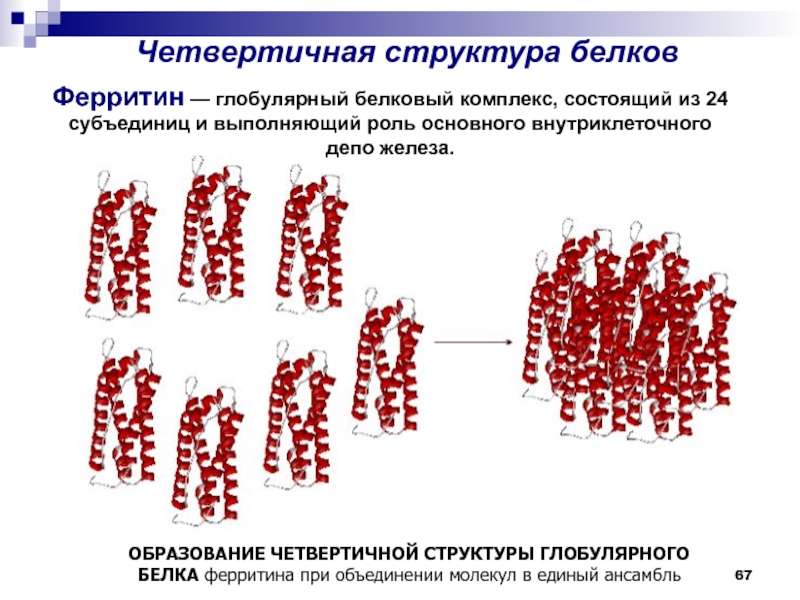
- 67. Четвертичная структура белков ОБРАЗОВАНИЕ ЧЕТВЕРТИЧНОЙ
- 68. Пример четвертичной структуры - вирус табачной мозаики:2130
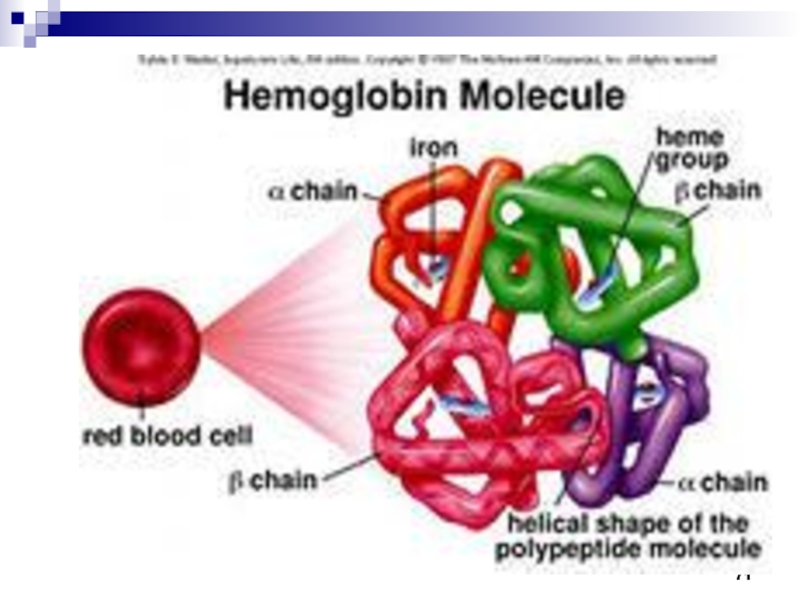
- 69. Гемоглобин выполняет роль переносчика кислорода от
- 70. Гемоглобин человека Схема связывания кислорода гемоглобином His93
- 71. Слайд 71
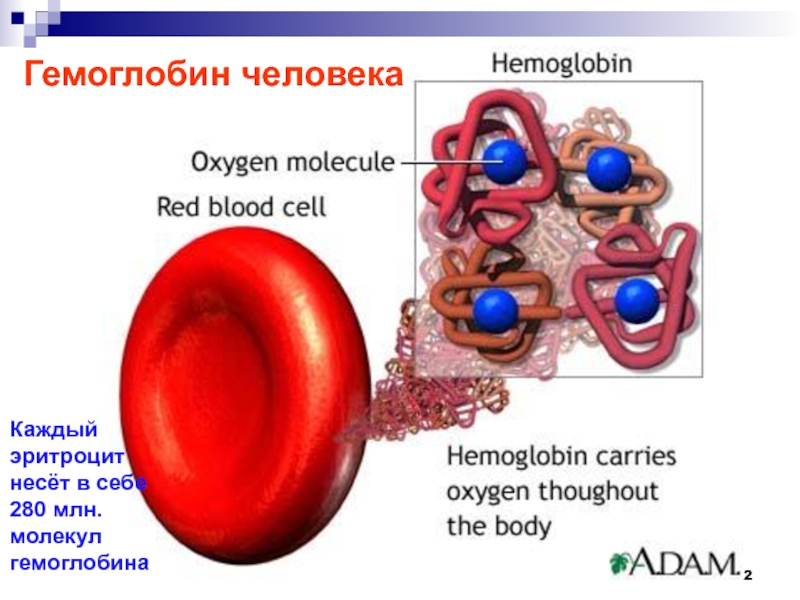
- 72. Гемоглобин человека Каждый эритроцит несёт в себе 280 млн. молекул гемоглобина
- 73. Строение белковой молекулы
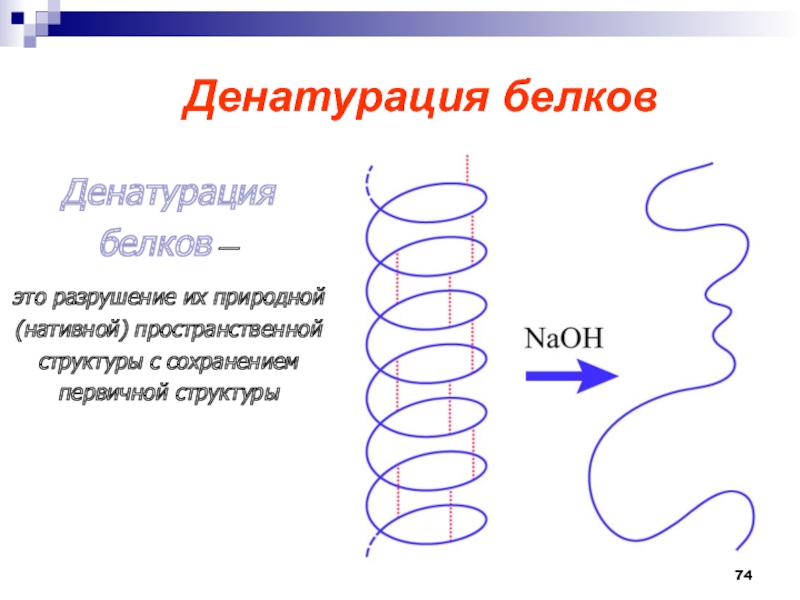
- 74. Денатурация белковДенатурация белков — это
- 75. Денатурированный белок теряет свои биологические свойства.
- 76. По данным Всемирной организации здравоохранения примерно половина
- 77. Цветные реакции на белки1. Ксантопротеиновая – взаимодействие
- 78. Спасибо!!!
- 79. Скачать презентанцию
Слайды и текст этой презентации
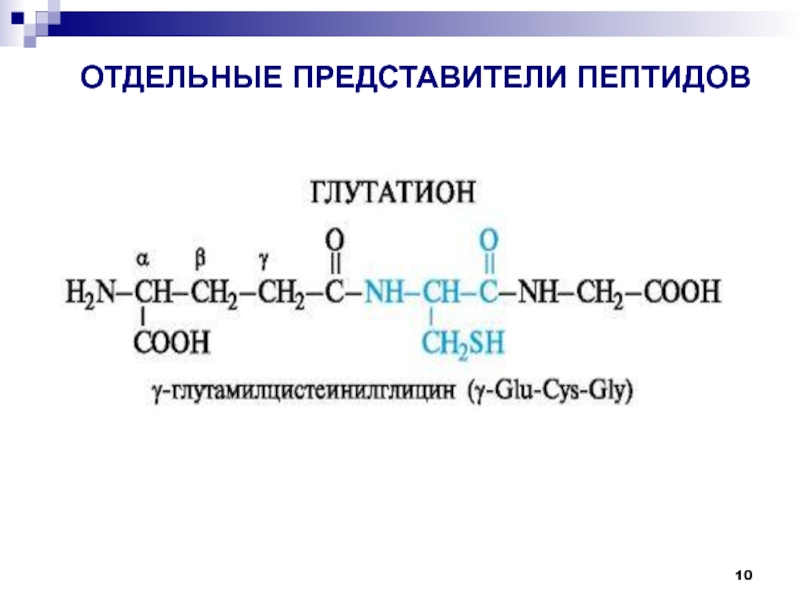
Слайд 2Пептиды
Пептиды — соединения, построенные из нескольких остатков -аминокислот, связанных амидной
(пептидной) связью
Слайд 3 (греч. Πεπτος, peptós — сваренный, переваренный,
питательный).
Термин «пептиды» был предложен известным химиком Эмилем Фишером. Слово
образовано из первых четырёх букв названия пептоны (продукты расщепления белков пепсином) и конечных букв названия углеводов полисахариды. ФИШЕР (Fischer), Эмиль
9 октября 1852 г. – 15 июля 1919 г.
Нобелевская премия по химии, 1902 г.
Пептиды
Слайд 4
Классификация пептидов.
В зависимости от числа аминокислотных остатков
различают ди-, три-, тетра-, пента- и тому подобные пептиды;пептиды с молекулярной массой не более
10 000 у.е., (т.е. содержащие
не более 50-60 аминокислотных остатков) называют олигопептидами,
а с молекулярной массой, большей 10 000 у.е. полипептидами или белками.
Слайд 7ЭЛЕКТРОННОЕ И ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ
ПЕПТИДНОЙ СВЯЗИ.
р--сопряженная система
барьер вращения
Составляет
63-84
кДж/моль
(С=О 0,121 нм)
α
α
транс- положение
С-О 0,143 нм
C=N
0,127нмСлайд 9Основные функции пептидов:
регуляторная (рилизинг-факторы или либерины, нейромедиаторы);
гормональная (окситоцин, вазопрессин, брадикинин,
гастрин и др.);
антибиотическая (грамицидин А, В, С, S; актиномицин D
и др.);антиоксидантная (глутатион и др.);
регуляторы митоза (факторы роста);
функция витаминов (фолиевая кислота);
пептидные алкалоиды (эрготамин и др.);
токсическая (фаллоидин, аманитин и др.).
Слайд 12Тафтсин
Селанк — (Thr-Lys-Pro-Arg-Pro-Gly-Pro, лекарственный препарат, обладающий наиболее выраженной анксиолитической активностью
(противотревожным действием).
Слайд 13Селанк – первый в мире пептидный анксиолитик с уникальным сочетанием
психотропной активности: антидепрессивной, антиастенической и ноотропной
«Селанк можно применять и здоровым
людям. Я, кстати, считаю, что это даже нужно. Ведь нервозность общества из-за урбанизации только возрастает»- Академик РАН Н. Ф. МясоедовСлайд 14Нейропептиды (опиатные пептиды). пептиды, содержащиеся в головном мозге.
1975 г.
TyrGlyGlyPheMet
метионин-энкефалинTyrGlyGlyPheLeu лейцин-энкефалин
Эти пептиды оказывают обезболивающее действие и используются как лекарственные средства.
контролируют деятельность эндокринных желез в организме человека
- влияют на эмоциональное состояние
(Любовь, творчество, слава, власть)
Слайд 15Вазопрессин (от лат. vas – cocyд и presso – давлю),
гормон, выделяемый задней долей гипофиза,вызывает сужение сосудов (действуя на гладкие
мышцы их стенок) и повышение кровяного давления (прессорный эффект), а также поддерживает на должном уровне обратное всасывание воды в прямых канальцах почек, то есть уменьшает количество выделяющейся мочи (антидиуретический эффект).3
8
Слайд 16Окситоцин (1954) вызывает сокращение гладких мышц матки и в меньшей
степени — мышц мочевого пузыря и кишечника, стимулирует отделение молока
молочными железами.воздействие на психоэмоциональную сферу мужчин
Слайд 17 Даларгин
- синтетический аналог энкефалинов,биологически активных веществ из класса
эндогенных опиоидных пептидов, оказывающих влияние практически на все функции органов
пищеварительного тракта.Tyr-D-Ala-Gly-Phe-Leu-Arg
Слайд 18Применяется Даларгин при обострении язвенной болезни желудка и двенадцатиперстной кишки,
ускоряет заживление язвы; панкреатите, панкреанекрозе. а так же при нарушениях
психического состояния при алкоголизмеСлайд 19
Семакс.
гептапептид метионил-глутамил-гистидил-фенилаланил-пролил-глицил-пролин, MetGluHisPheProGlyPro
, — лекарственное средство, оказывающее ноотропное и нейропротективное действие Слайд 20Пептид АКТГ4-10 («Семакс») обладает нейроспецифическим эффектом в отношении ЦНС, влияет
на процессы, связанные с формированием памяти и обучением, обладающий ноотропным,
нейрометаболическим, нейропротективным, противоишемическим, антигипоксическим, антиоксидантным действием.Препарат усиливает внимание при обучении и анализе информации, улучшает консолидацию памятного следа, улучшает адаптацию организма к гипоксии, церебральной ишемии, наркозу и другим повреждающим воздействиям. Препарат практически не токсичен при однократном и длительном введении.
Слайд 21
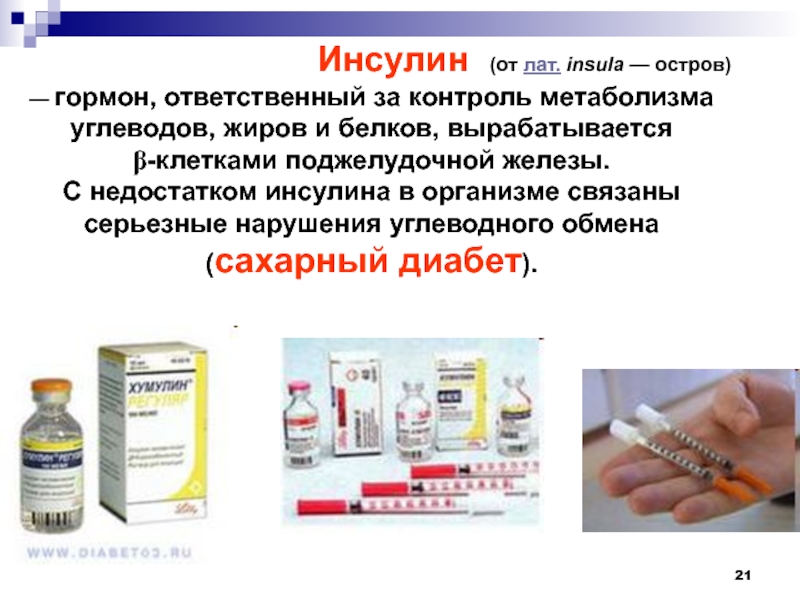
Инсулин (от лат. insula — остров)
— гормон, ответственный за контроль метаболизма углеводов, жиров и белков, вырабатывается
-клетками поджелудочной железы.
С недостатком инсулина в организме связаны серьезные нарушения углеводного обмена (сахарный диабет).
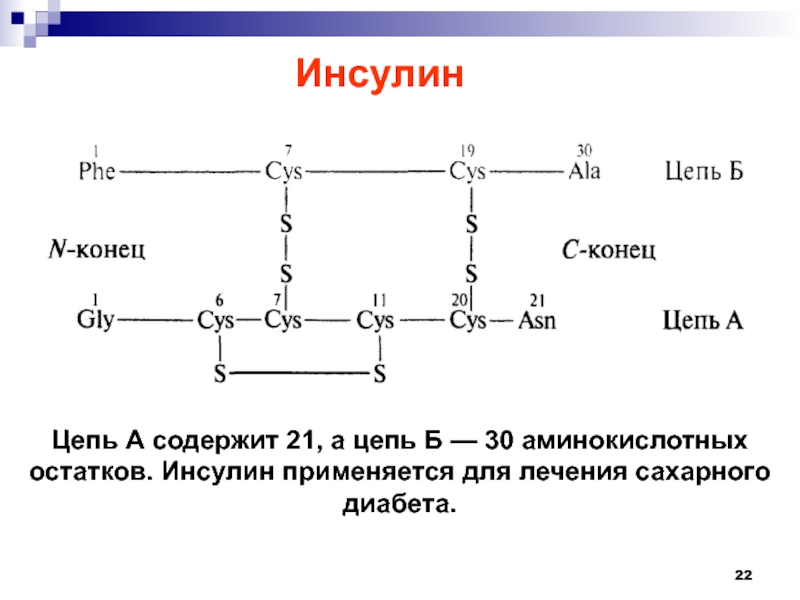
Слайд 22Цепь А содержит 21, а цепь Б — 30 аминокислотных
остатков. Инсулин применяется для лечения сахарного диабета.
Инсулин
Слайд 23шесть молекул инсулина ассоциированы в гексамер (видны три симметричные оси).
Молекулы удерживают вместе остатки гистидина, связанные ионами цинка. Введенный инсулин
находится под кожей в виде гексамера, постепенно распадаясь на биологически активные мономеры, поступающие в кровоток.NPH-инсулины Длительного действия
16-18 час.
«Изофан»
Слайд 24 Биолан
комплекс веществ
пептидной группы, природных нейропротекторных аминокислот и пептидов, оптимально сбалансированных и
необходимых для нормального и стабильного функционирования нервной системы и организма человека.- TrpAlaGlyGlyAspAlaSerGlyGlu -
Delta sleep inducng peptide, DSIP
-βAlaHis - карнозин
- Gly - глицин
Слайд 25при стрессе и заболеваниях нервной системы;
при хронической усталости, депрессии,
раздражительности, бессоннице;
в экстремальных ситуациях;
для повышения физической и умственной
работоспособности; для улучшения памяти, концентрации внимания, способности к обучению;
для укрепления иммунной системы, повышения сопротивляемости организма;
для ускорения выздоровления после заболеваний;
для повышения адаптационных возможностей организма;
для защиты от стрессов сердечно-сосудистой, дыхательной и эндокринной систем;
для уменьшения побочных явлений химио- и радиотерапии при лечении онкологических заболеваний;
при лечении алкоголизма и наркомании, при отвыкании от курения;
для защиты организма от воздействия экологических загрязнений.
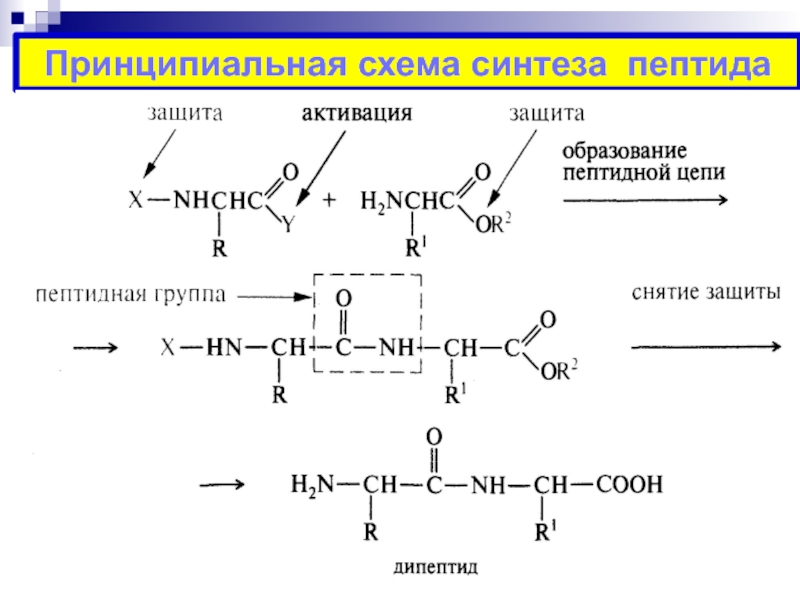
Слайд 27ИСКУССТВЕННЫЙ СИНТЕЗ ПЕПТИДОВ
Схема синтеза дипептида аланил-валина:
Первый компонент – N-концевая
аминокислота аланин
I. Защита группы –NH2
Z Ala OH
ZCl
Ala
2
экв. 1N NaoHСлайд 28II. Активация группы –СООН
этилхлорформиат
Z Ala OH
Z Ala OC(O)OC2H5
1N NaoH
смешанный ангидрид
Слайд 29Второй компонент
– С-концевая аминокислота валин
III. Защита группы –СООН
Val
Val
OEt
1 экв.1N NaOH
Слайд 36Строительная (пластическая) – белки участвуют в образовании оболочки клетки, органоидов
и мембран клетки.
Каталитическая – все клеточные катализаторы – белки
(активные центры фермента). Двигательная – сократительные белки вызывают всякое движение.
Транспортная – белок крови гемоглобин присоединяет кислород и разносит его по всем тканям.
Защитная – выработка белковых тел и антител для обезвреживания чужеродных веществ.
Энергетическая – 1 г белка эквивалентен 17,6 кДж.
Рецепторная – реакция на внешний раздражитель
Функции белков
Слайд 38Первичная структура пептидов и белков.
Аминокислотный состав пептидов и белков -
это природа и количественное соотношение входящих в них α-аминокислот.
Первичная структура
пептидов и белков –это аминокислотная последовательность,
т. е. порядок чередования α-аминокислотных остатков.
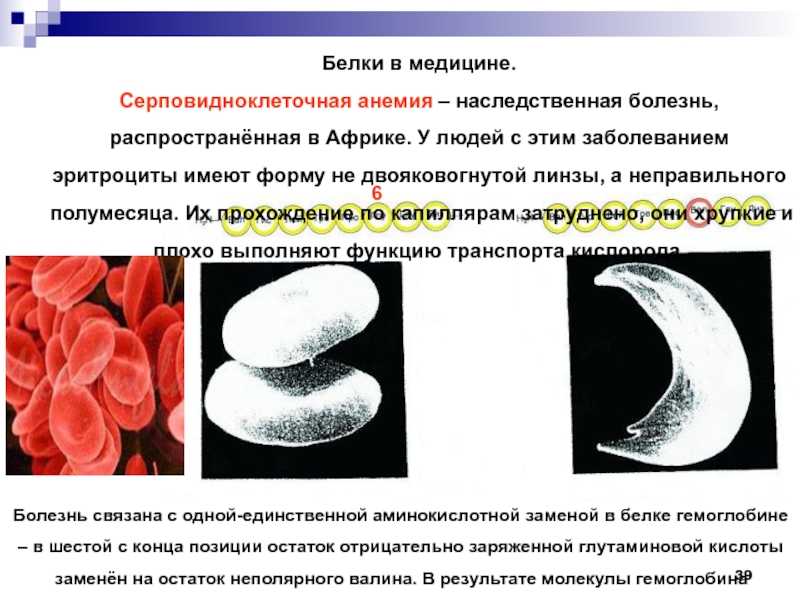
Слайд 39Белки в медицине.
Серповидноклеточная анемия – наследственная болезнь, распространённая в Африке.
У людей с этим заболеванием эритроциты имеют форму не двояковогнутой
линзы, а неправильного полумесяца. Их прохождение по капиллярам затруднено, они хрупкие и плохо выполняют функцию транспорта кислорода.Болезнь связана с одной-единственной аминокислотной заменой в белке гемоглобине – в шестой с конца позиции остаток отрицательно заряженной глутаминовой кислоты заменён на остаток неполярного валина. В результате молекулы гемоглобина слипаются в цепочки.
6
Слайд 40
Вторичная структура белков
Вторичная структура белка — это более
высокий уровень структурной организации, в котором закрепление конформации происходит за
счет водородных связей между пептидными группами.Слайд 41 Лайнус Карл
Полинг
1901—1994
выдающийся
американский химик и физик, общественный деятель.
Нобелевская премия по химии
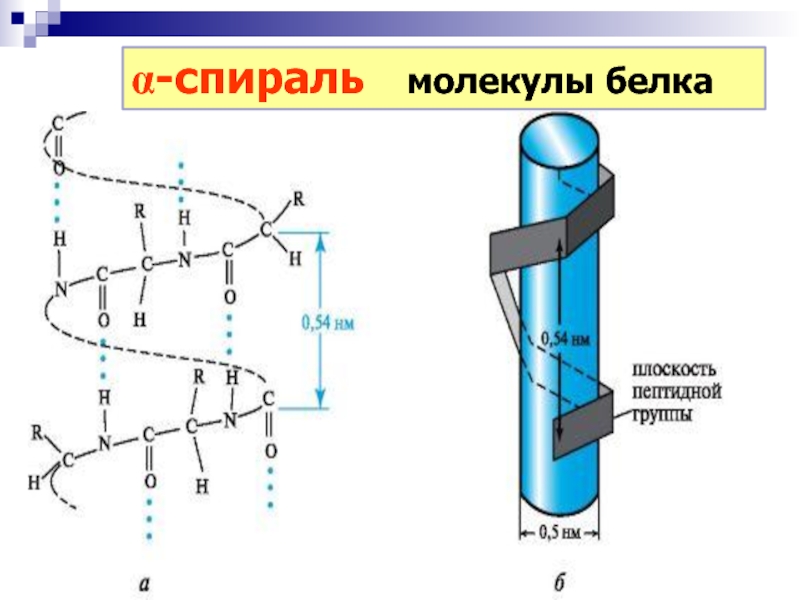
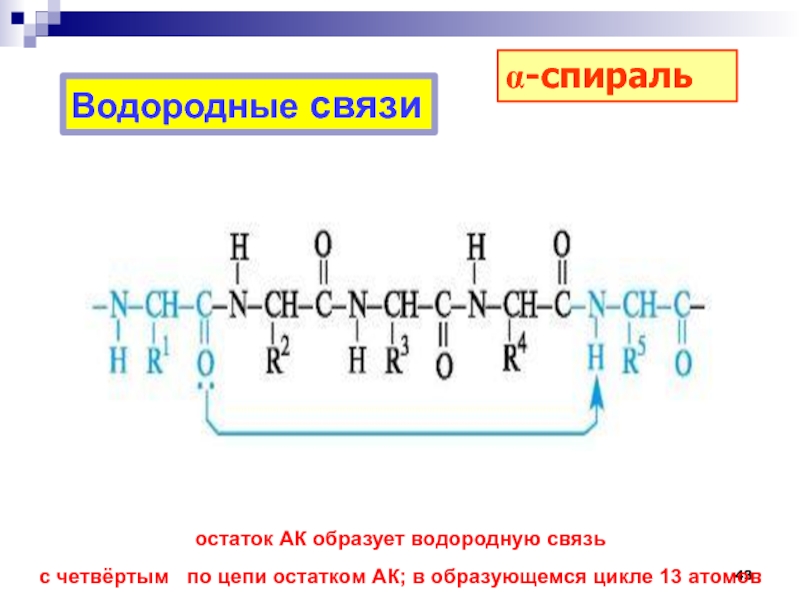
(1954), Нобелевская премия Мира (1962) Слайд 43Водородные связи
остаток АК образует водородную связь
с четвёртым по
цепи остатком АК; в образующемся цикле 13 атомов
a-спираль
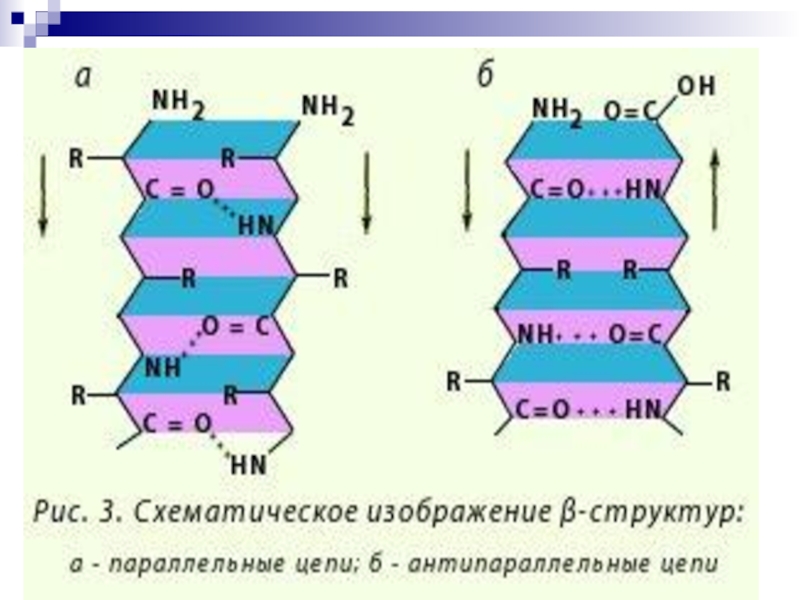
Слайд 44-Структура
(анти) параллельный -складчатый слой (лист)
«меха аккордеона»
Межцепочечные
Н-связи
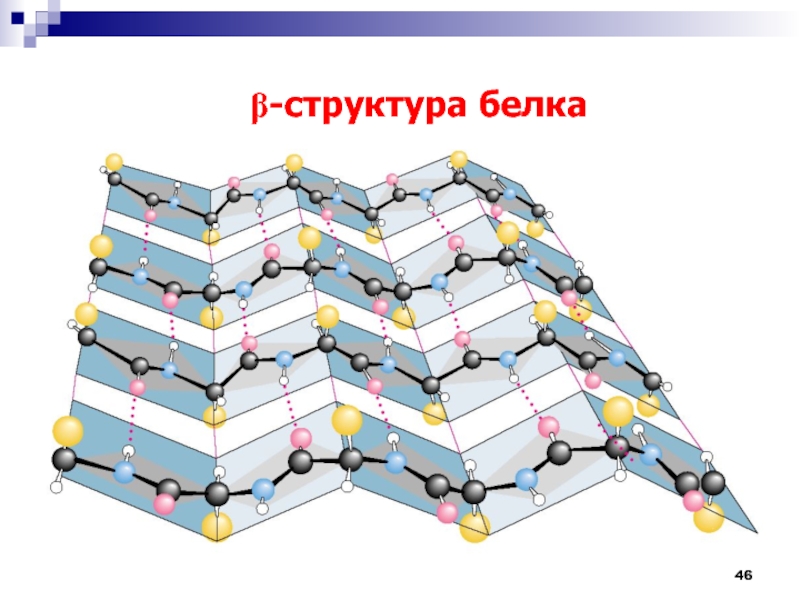
Слайд 47
Вторичная структура белков
А – участок полипептидной цепи, соединенный
водородными связями (зеленые пунктирные линии).
Б – условное изображение b-структуры
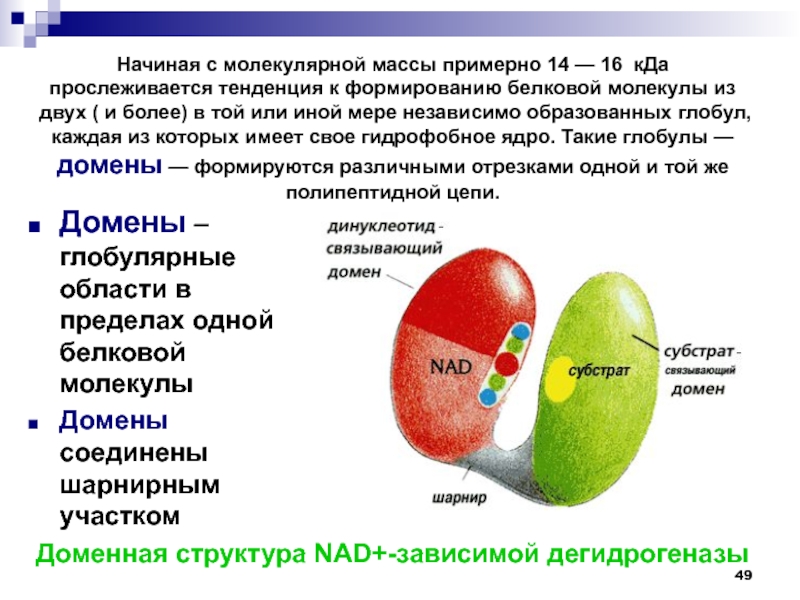
в форме плоской ленты, проходящей через атомы полимерной цепи (атомы водорода не показаны). Слайд 49Домены – глобулярные области в пределах одной белковой молекулы
Домены соединены
шарнирным участком
Доменная структура NAD+-зависимой дегидрогеназы
Начиная с молекулярной массы примерно 14
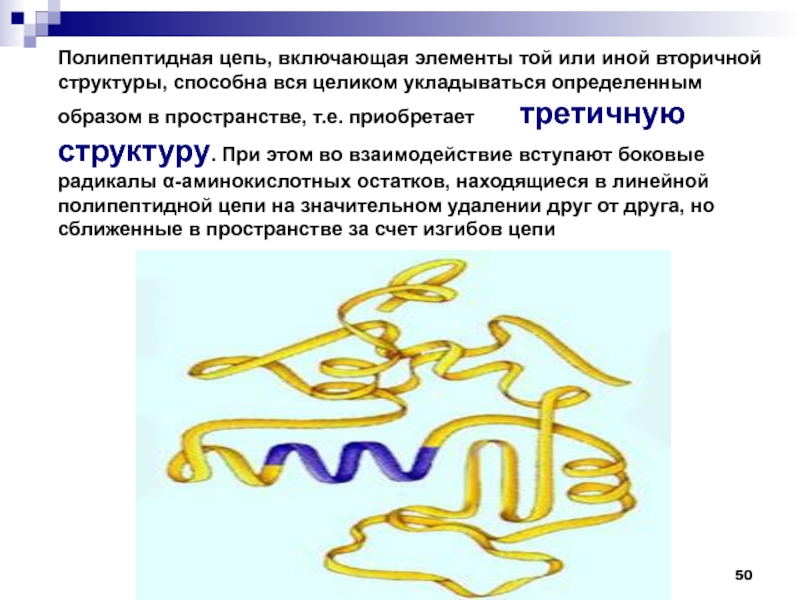
— 16 кДа прослеживается тенденция к формированию белковой молекулы из двух ( и более) в той или иной мере независимо образованных глобул, каждая из которых имеет свое гидрофобное ядро. Такие глобулы — домены — формируются различными отрезками одной и той же полипептидной цепи. Слайд 50Полипептидная цепь, включающая элементы той или иной вторичной структуры, способна
вся целиком укладываться определенным образом в пространстве, т.е. приобретает
третичную структуру. При этом во взаимодействие вступают боковые радикалы -аминокислотных остатков, находящиеся в линейной полипептидной цепи на значительном удалении друг от друга, но сближенные в пространстве за счет изгибов цепиСлайд 51молекула приобретает форму компактного клубка – глобулярные белки
(globules, лат.
шарик, эллипсоид вращения),
мало Н-связей, растворимы в воде.
Нитевидная форма –
фибриллярные белки, (fibra, лат. волоконце), много межцепочечных Н-связей, нерастворимы в воде .Третичная структура
Третичной структурой белка называется способ укладки полипептидной цепи в пространстве
Слайд 53
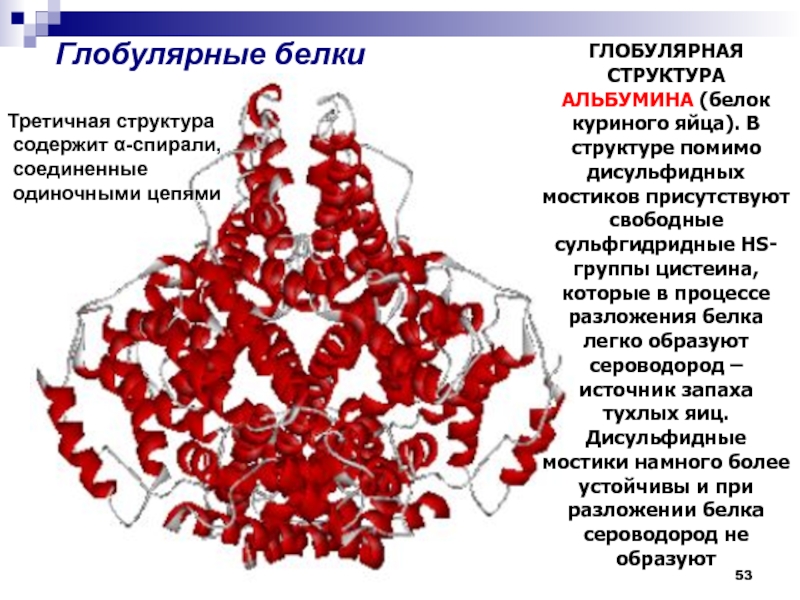
Глобулярные белки
ГЛОБУЛЯРНАЯ СТРУКТУРА АЛЬБУМИНА (белок куриного яйца). В структуре помимо
дисульфидных мостиков присутствуют свободные сульфгидридные HS-группы цистеина, которые в процессе
разложения белка легко образуют сероводород – источник запаха тухлых яиц. Дисульфидные мостики намного более устойчивы и при разложении белка сероводород не образуютТретичная структура
содержит α-спирали,
соединенные
одиночными цепями
Слайд 54
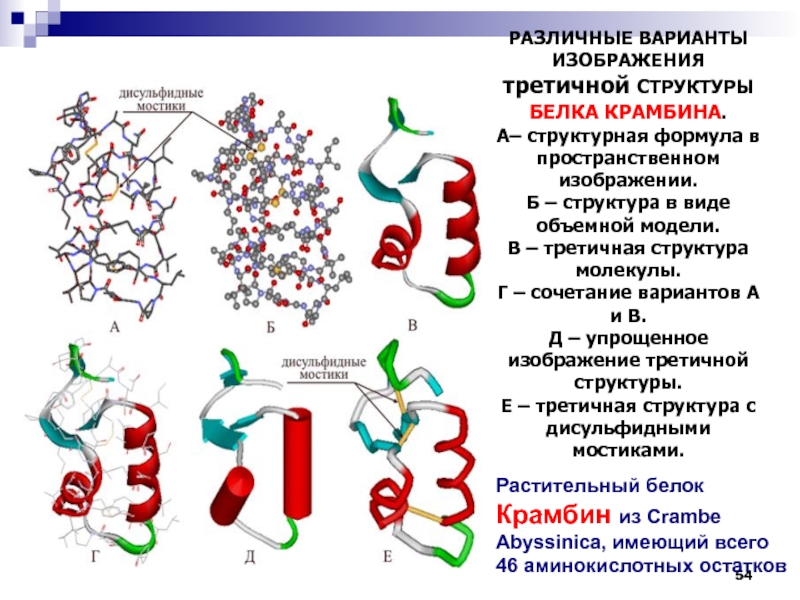
РАЗЛИЧНЫЕ ВАРИАНТЫ ИЗОБРАЖЕНИЯ третичной СТРУКТУРЫ БЕЛКА КРАМБИНА.
А– структурная формула
в пространственном изображении.
Б – структура в виде объемной модели.
В – третичная структура молекулы.
Г – сочетание вариантов А и В.
Д – упрощенное изображение третичной структуры.
Е – третичная структура с дисульфидными мостиками.
Растительный белок Крамбин из Crambe Abyssinica, имеющий всего 46 аминокислотных остатков
Слайд 55
Фибриллярные белки
ФИБРИЛЛЯРНЫЙ БЕЛОК ФИБРОИН – основной компонент натурального шелка
и паутины
содержат большое количество остатков глицина, аланина и серина
(каждый второй аминокислотный остаток – глицин); остатки цистеина
отсутствуют
Слайд 56
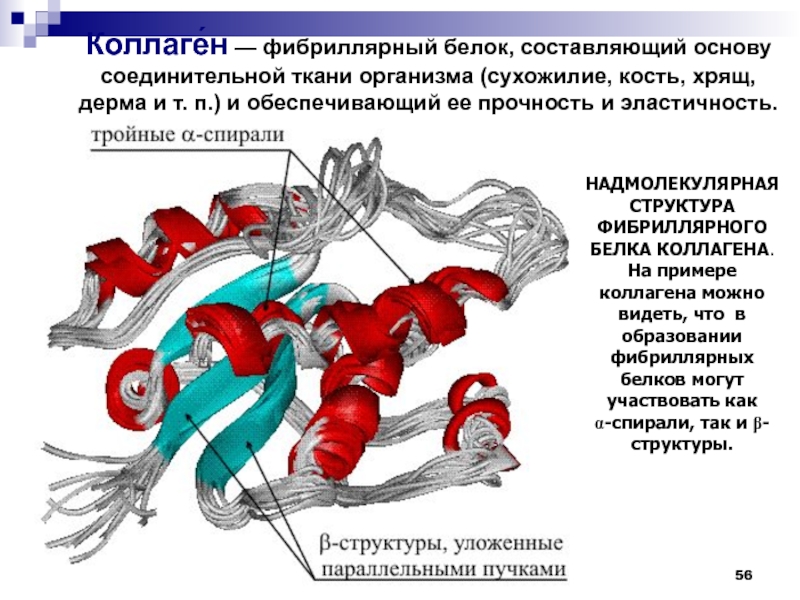
НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА ФИБРИЛЛЯРНОГО БЕЛКА КОЛЛАГЕНА. На примере коллагена можно видеть,
что в образовании фибриллярных белков могут участвовать как a-спирали, так
и b-структуры.Коллаге́н — фибриллярный белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и т. п.) и обеспечивающий ее прочность и эластичность.
Слайд 57Молекула коллагена представляет собой правозакрученную спираль из 3 α-цепей (тропоколлаген).
Один виток спирали α-цепи содержит три аминокислотных остатка -Gly-Pro-HyPro-
Молекулярная
масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм. Троично-спиральная модель
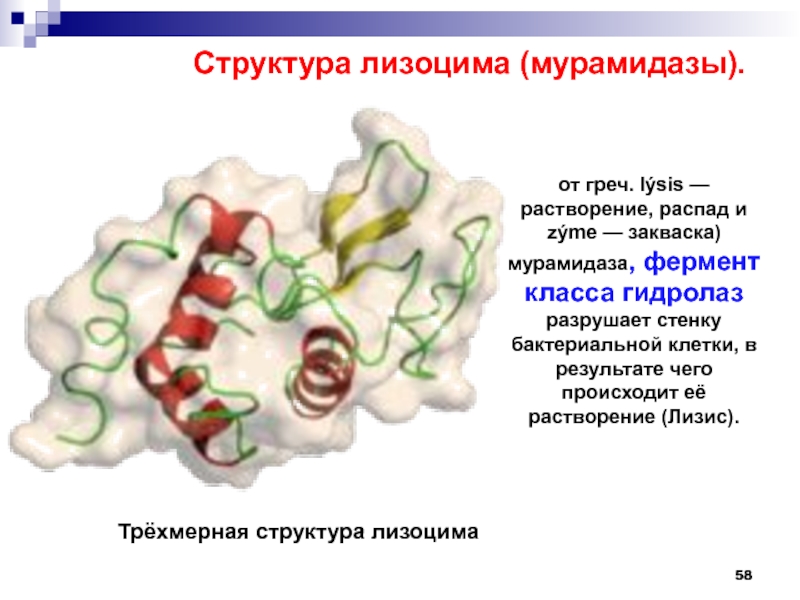
Слайд 58от греч. lýsis — растворение, распад и zýme — закваска)
мурамидаза, фермент класса гидролаз разрушает стенку бактериальной клетки, в результате
чего происходит её растворение (Лизис).Структура лизоцима (мурамидазы).
Трёхмерная структура лизоцима
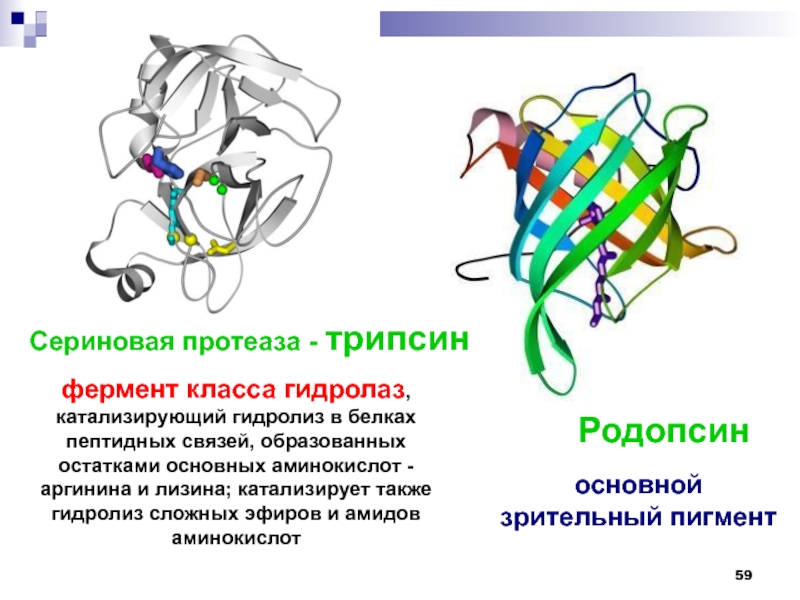
Слайд 59Сериновая протеаза - трипсин
Родопсин
фермент класса гидролаз, катализирующий гидролиз в белках
пептидных связей, образованных остатками основных аминокислот - аргинина и лизина;
катализирует также гидролиз сложных эфиров и амидов аминокислотосновной
зрительный пигмент
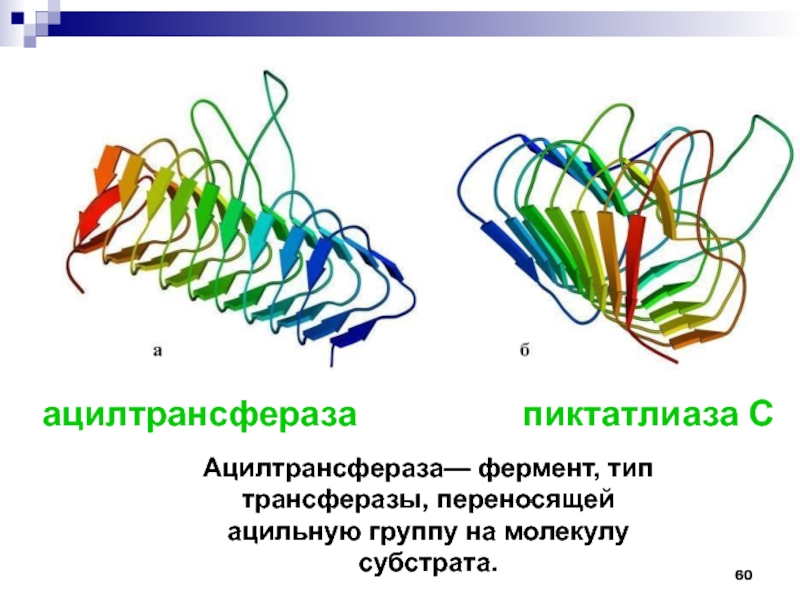
Слайд 60ацилтрансфераза
пиктатлиаза С
Ацилтрансфераза— фермент, тип трансферазы,
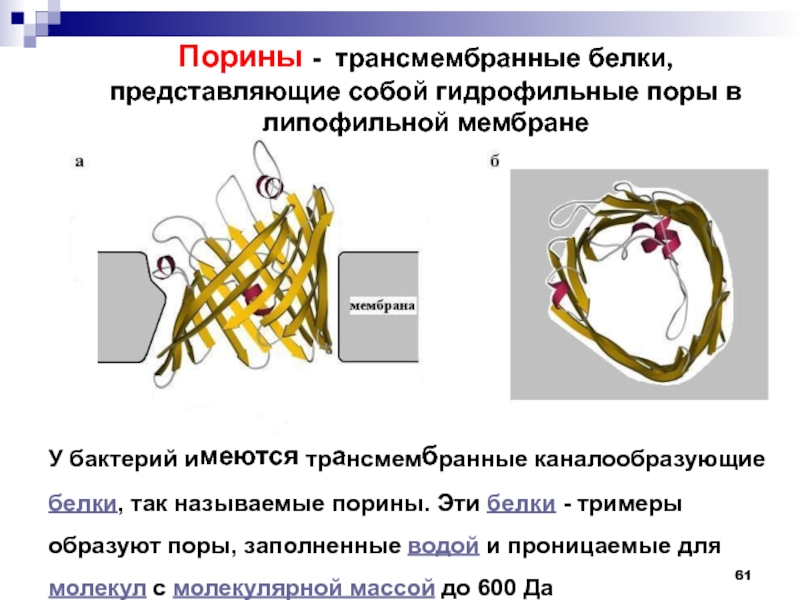
переносящей ацильную группу на молекулу субстрата.Слайд 61У бактерий имеются трансмембранные каналообразующие белки, так называемые порины. Эти
белки - тримеры образуют поры, заполненные водой и проницаемые для
молекул с молекулярной массой до 600 ДаПорины - трансмембранные белки, представляющие собой гидрофильные поры в липофильной мембране
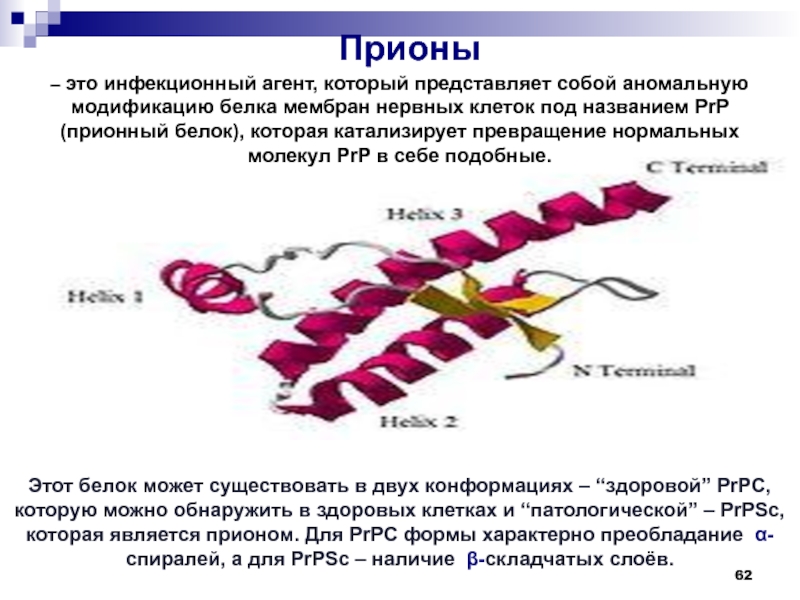
Слайд 62Этот белок может существовать в двух конформациях – “здоровой” PrPC,
которую можно обнаружить в здоровых клетках и “патологической” – PrPSc,
которая является прионом. Для PrPC формы характерно преобладание α- спиралей, а для PrPSc – наличие β-складчатых слоёв.Прионы
– это инфекционный агент, который представляет собой аномальную модификацию белка мембран нервных клеток под названием PrP (прионный белок), которая катализирует превращение нормальных молекул PrP в себе подобные.
Слайд 63Губчатые энцефалопатии
* Синдром Крейцфельда-Якоба
* синдром Герсманна–Штройслера–Шейнкера
* хроническая
семейная бессонница,
* болезнь куру (связана с ритуальным каннибализмом
народности Форе в восточной части Новой Гвинеи)* скрепи
дегенеративное изменение мозга под воздействием
инфекции или аномальных белков - ПРИОНОВ
* коровье бешенство
Лечения прионных инфекций не существует.
Слайд 64Проявляется болезнь медленно прогрессирующими нарушениями памяти и мыслительных функций (деменцией),
которые в итоге приводят к смерти.
Образование прионов может произойти
спонтанно, быть результатом наследуемой мутации соответствующего гена или возникнуть при попадании прионов извне – при нейрохирургических манипуляциях, каннибализме и употреблении в пищу мозга больных животных.В результате перерождения ткань мозга повреждается с образованием
множества небольших полостей, из-за чего мозговое вещество больных
напоминает губку.